рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Механизм распознавания антигенов Т-лимфоцитами, структурная организация антигенраспознающих рецепторов Т-лимфоцитов
Реферат Курсовая Конспект
Механизм распознавания антигенов Т-лимфоцитами, структурная организация антигенраспознающих рецепторов Т-лимфоцитов
Механизм распознавания антигенов Т-лимфоцитами, структурная организация антигенраспознающих рецепторов Т-лимфоцитов - раздел Философия, Определение иммунологии, основные ее понятия Антигенраспознающие Рецепторы Т-Лимфоцитов В Отличие От Таков...
Антигенраспознающие рецепторы Т-лимфоцитов в отличие от таковых В-лимфоцитов не являются иммуноглобулинами и распознают антиген «не в чистом виде», а в комплексе со специальными молекулами антигенпредставляющих клеток (нейтрофилов, моноцитов и макрофагов). Эти молекулы антигенпредставляющих клеток, принимающие участие в связывании антигенов и презентации их Т-лимфоцитам, являются молекулами главного комплекса гистосовместимости.
Главный комплекс гистосовместимости (МНС от англ. major histocompatibility complex) представляет собой совокупность клеточных белков, большинство из которых экспрессируется на поверхность клеток и принимает участие в их рецептивных функциях и иммунном ответе. Изучение молекул (т.н. антигенов) этого комплекса было начато с момента исследования причин отторжения генетически чужеродных трансплантатов у животных и человека. В настоящее время известно, что большинство генов, кодирующих антигены главного комплекса гистосовместимости у человека, расположены в 6 паре гомологичных хромосом, хотя некоторые из генов этого комплекса могут располагаться и в других хромосомах (например, в 15 паре). Комплекс генов МНС у человека занимает значительный участок ДНК 6 хромосомы: включает до 4х106 пар нуклеотидов, или около 50 генов. Основными особенностями генов этого комплекса являются:
Ø полигенность – наличие нескольких неаллельных, близкосцепленных генов, кодирующих сходные по своей структуре белки (изогенные признаки)
Ø полиморфизм генов – наличие большого количества аллельных форм одного и того же гена (от 20 до 72 аллельных форм для некоторых генов). Белки, кодируемые разными аллельными формами одного и того же гена, могут совсем незначительно отличаться друг от друга (всего по 20 аминокислотным остаткам)
Ø кодоминантный тип наследования генов (при наличии в генотипе разных аллельных форм одного и того же гена каждый аллель проявляет свое действие, т.е. полного доминирования одних аллелей над другими не происходит). Благодаря кодоминантному типу наследования генов МНС белки этого комплекса проявляют значительное разнообразие и выраженную индивидуальность у каждого конкретного человека, являющегося, как правило, гетерозиготным по многим генам МНС.
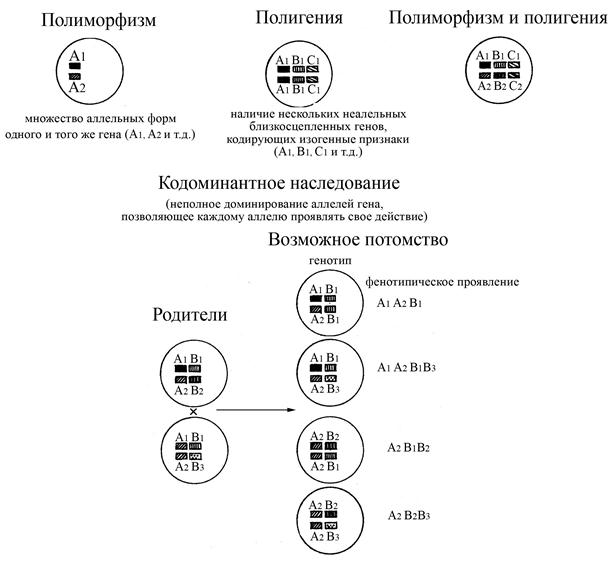
Рис. Схема кодоминантного наследования полиморфных и полигенных признаков, определяющих антигенную индивидуальность (по особенностям строения молекул МНС) особей вида. При кодоминантном наследовании сочетание полиморфизма и полигении создает набор фенотипических признаков, которые определяют индивидуальность особей вида
Огромное разнообразие генов МНС, сформировавшееся в процессе эволюции, обеспечивает возможность взаимодействия молекул МНС с любыми возможными потенциальными антигенами и связано с:
Ø тандемными дупликациями (процесс повторения исходного гена на той же самой хромосоме), которые обусловили формирование полигенных форм многих белков МНС
Ø точечными мутациями (спонтанные замены отдельных нуклеотидов в процессе редупликации ДНК), которые приводят к формированию новых аллельных форм каких-то генов, а, следовательно, к генному полиморфизму, а также возникновению небольших отличий в одинаковых генах, сформировавшихся в процессе тандемных дупликаций (т.е. служат отчасти причиной полигении)
Ø рекомбинацией и конверсией генетического материала. В частности, рекомбинации (обмен участками) между отдельными участками гомологичных хромосом в процессе мейоза могут привести к обмену как целыми участками этих хромосом, так и отдельными генами и даже частями каких-то генов (генной конверсии), что служит причиной образования множества новых аллельных форм каких-то генов и обуславливает их полиморфизм.
Все гены главного комплекса гистосовместимости человека, называемого еще НLA-комплекс (от англ. human leukocyte antigens в связи с тем, что первоначально белки этого комплекса – т.н. антигены гистосовместимости – были обнаружены на поверхности лейкоцитов человека) классифицируют на 3 группы, каждая из которых кодирует белки одного из трех классов (I, II и III классов соответственно).
Молекулы I класса антигенов МНС экспрессируются почти на всех клетках, имеющих ядра: особенно широко представлены они на лимфоидных клетках, в меньшей степени – на клетках печени, легких и почек, редко встречаются на клетках мозга и скелетных мышечных волокнах и полностью отсутствуют на поверхности ворсинчатых клеток трофобласта (что имеет огромное значение для сохранения беременности, поскольку делает невозможным встречу иммунокомпетентных клеток матери с антигенами отцовского происхождения на поверхностной оболочке эмбриона).
Молекулы МНС I классапредставляют собой гетеродимер, состоящий из двух цепей: тяжелой a-цепи (мол. масса 43 кДа) и связанного с ней нековалентно более легкого b2-микроглобулина (мол. масса 11 кДа). a-цепь, в свою очередь, кодируется генами НLA-А, -В и -С комплекса МНС 6-й хромосомы, а b2-микроглобулин – геном, не входящим в этот комплекс и расположенным на 15-й хромосоме. Тяжелая a-цепь молекул МНС I классасостоит из трех глобулярных доменов, выступающих над поверхностью клетки:
ü a1 и a2-доменов, в составе которых содержаться участки, имеющие как a-спиральную структуру (сравнительно длинные участки), так и b-складчатую структуру (более короткие участки)
ü и a3-домена, имеющего преимущественно b-складчатую структуру.
ü кроме того, в составе тяжелой a-цепи имеется короткий трансмембранный гидрофобный участок и короткая гидрофильная последовательность, выносящая С-концевой участок молекулы в цитоплазму.
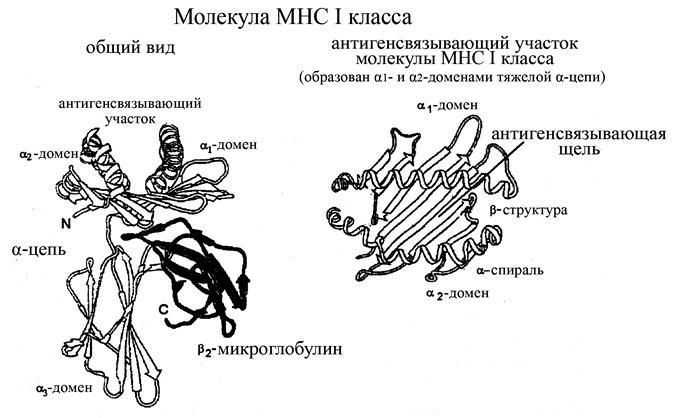
Рис. Структура молекул МНС I класса
Домены a1 и a2 различных молекул МНС I классахарактеризуются очень большой вариабельностью, и именно они отвечают за связывание антигенов этими молекулами. В частности, длинные a-спиральные участки этих доменов взаимодействуют между собой таким образом, что между ними образуется щель – место связывания антигенных детерминант. Собственно же комплекс антигена с a1 и a2-доменами молекул МНС I класса определяет иммуногенность экзогенного антигена (т.е. его способность далее взаимодействовать с антигенраспознающими рецепторами Т-лимфоцитов). Основное назначение молекул I класса МНС состоит в связывании определенных антигенных детерминант и последующей их презентации в иммуногенной форме Т-лимфоцитам.
Молекулы МНС II класса встречаются в организме человека гораздо реже таковых I класса: а именно, они ассоциированы только с В-лимфоцитами и антигенпрезентирующими клетками. В структурном плане эти молекулы, подобно таковым I класса, представляют собой гетеродимеры, состоящие из двух нековалентно связанных, но в то же время сходных по массе, строению и размерам цепей – a (мол. масса 34 кДа) и b (мол. масса 28 кДа), каждая из которых включает
ü по 2 домена (a1 и a2, b1 и b2 соответственно), которые расположены над поверхностью мембраны клеток,
ü и короткие гидрофобный трансмембранный и гидрофильный цитоплазматический участки.
Домены a1 и b1 в своем составе содержат как сравнительно длинные a-спиральные, так и более короткие b-складчатые участки, а домены a2 и b2 имеют преимущественно b-складчатую структуру. Антигенсвязывающий центр в молекулах МНС II классаформируется a-спиральными участками a1- и b1-доменов a- и b-цепей, которые характеризуются очень большой вариабельностью своего аминокислотного состава в различных молекулах МНС II класса, что делает возможным связывание этими молекулами различных потенциальных антигенных детерминант.
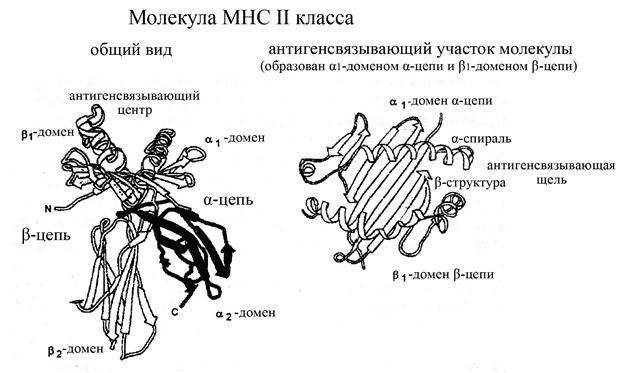
Рис. Структура молекул МНС II класса
Молекулы МНС II классакодируются генными кластерами HLA-DP, -DQ и -DR. Причем кластеры HLA-DP и -DQ включают по два близкосцепленных гена – a и b, кодирующих соответственно a- и b-цепи молекул МНС II класса. Кластер HLA-DR включает 3 близкосцепленных гена: a, b1 и b2, в связи с чем кодирует два типа молекул HLA-DR: ab1 и ab2. Кроме того, к генам МНС II классаотносятся гены LMP и TAP, кодирующие низкомолекулярные белки, которые принимают участие в подготовке чужеродного антигена к презентации Т-лимфоцитам.
Гены МНС III класса контролируют синтез белков, часть из которых участвует в иммунных процессах (некоторые компоненты системы комплемента – С2, С4, фактор В, факторы некроза опухолей – ФНО-a и b), а часть – кодирует некоторые ферменты синтеза стероидных гормонов.
Наличие в МНС генов, большинство из которых кодирует иммунологически значимые белки, дает основание считать, что этот комплекс эволюционно возник и развивался специально для осуществления иммунных форм защиты, а такие признаки этого комплекса, как полиморфизм генов, полигенность белков, им кодируемых, и кодоминантный тип наследования генов, обуславливают огромное разнообразие молекул, кодируемых генами МНС, а, следовательно, и возможность их взаимодействия с самыми различными многообразными потенциальными антигенными детерминантами.
Как уже было отмечено выше, антигенраспознающие рецепторы Т-лимфоцитов, в отличие от таковых В-лимфоцитов, распознают не самостоятельные антигеннные детерминанты, а их комплексы с определенными молекулами главного комплекса гистосовместимости антигенпрезентирующих клеток. Таким образом, для распознавания антигенов Т-лимфоцитами необходима предварительная подготовка антигенов в антигенпредставляющих клетках. Характер этой подготовки во многом зависит от природы антигена и способа его паразитирования. Так, вирусы самостоятельно (без участия фагосом, путем пиноцитоза) проникают в цитоплазму антигенпрезентирующих клеток (преимущественно дендритных клеток, которые, в отличие от макрофагов, не отличаются избирательной тропностью к каким-то строго определенным вирусам). После пиноцитоза вирусов антигенпрезентирующими клетками они подвергаются частичному расщеплению ферментами цитоплазмы этих клеток – т.н. протеосомным комплексом. Протеосомный каталитический комплекс состоит из 28 субъединиц с молекулярной массой 28-30 кДа, которые формируют цилиндр, состоящий из 4 колец (каждое из которых включает по 7 субъединиц). В состав протеосомы входит 2 белковые субъединицы, кодируемые генами LMP (от англ. low molecular weight protein) комплекса МНС. Под действием каталитических субъединиц протеосомы происходит частичный гидролиз белковых компонентов вирусов до более мелких пептидных фрагментов. Затем образовавшиеся пептидные фрагменты проникают внутрь гранулярной эндоплазматической сети макрофага или дендритной клетки через посредство специальных ворот в мембране этой сети, образованных молекулами белков ТАР-1 и ТАР-2 (от англ. transporters associated with antigen processing -1 and 2), кодируемых генами комплекса МНС. Каждый из этих белков состоит из двух доменов: гидрофобного трансмембранного и антигенсвязывающего домена. Белки ТАР-1 и ТАР-2 образуют в мембране эндоплазматического ретикулума гетеродимер, пронизывающий мембрану насквозь и выступающий в роли специального канала для прохождения антигенных детерминант внутрь цистерн эндоплазматической сети. На рибосомах гранулярной эндоплазматической сети, в свою очередь, идет постоянный синтез молекул I класса МНС (a-цепи, которая ассоциируется в полости ретикулума с b2-микроглобулином, причем такой комплекс стабилизируется специальным белком кальнексином (мол. масса 68 кДа), в отсутствии которого молекула I класса распадается на составляющие ее цепи). Комплекс молекулы I класса МНС с белком кальнексином остается в полости эндоплазматической сети до тех пор, пока не произойдет встреча этой молекулы с антигенной детерминантой. Причем прикрепление к антигенсвязывающему участку молекулы МНС I класса антигенной детерминанты сопровождается отщеплением кальнексина. Далее образовавшийся комплекс «молекула МНС I класса - антигенная детерминанта» через аппарат Гольджи транспортируется на поверхность антигенпредставляющей клетки и фиксируется в ее мембране. В такой форме антигенная детерминанта становится доступной для распознавания цитотоксическими лимфоцитами (Т-киллерами), которые своими антигенраспознающими рецепторами вступают во взаимодействие с антигенной детерминантой. Результатом такого взаимодействия является повреждение Т-киллером мембраны зараженной вирусом антигенпредставлющей клетки, а также других зараженных вирусом клеток организма, имеющих на своей поверхности антигенные детерминанты данного вируса, и, как следствие, гибель этих клеток.
В случае развития бактериальной инфекции или поражения организма внутриклеточными паразитами стратегия иммунитета выглядит иначе. Так, при инфицировании организма бактериями, размножающимися вне клетки, для представления их антигенных детерминант Т-лимфоцитам, вначале происходит фагоцитоз этих бактерий или их токсинов макрофагами (внутри макрофагов при этом образуются фагосомные вакуоли). После чего осуществляется внутриклеточное переваривание возбудителей в фаголизосомах макрофагов (фагосомы сливаются с лизосомами и под действием ферментов лизосом в кислой среде происходит переваривание возбудителя), следствием которого является образование коротких пептидных антигенных детерминант возбудителя. Далее эти антигенные детерминанты должны ассоциироваться с молекулами МНС II класса. Молекулы МНС II класса синтезируются на рибосомах гранулярной эндоплазматической сети антигенпредставляющей клетки, после чего попадают в полость цистерн этой сети и там соединяются с т.н. инвариантной цепью (g-цепью), которая защищает их от образования случайных комплексов с белками эндоплазматической сети. Далее молекулы МНС II класса через аппарат Гольджи, будучи заключенными в специальные вакуоли, поступают в цитоплазму антигенпредставляющей клетки, где происходит слияние пузырьков, содержащих молекулы МНС II класса, с фаголизосомами. После такого слияния инвариантная цепь (g-цепь) молекул МНС II класса разрушается кислыми протеазами фаголизосом, в результате чего «снимается конформационный запрет» на взаимодействие молекулы II класса с антигенной детерминантой. Затем содержимое таких фаголизосом, включающее образовавшиеся комплексы «молекула МНС II класса - антигенная детерминанта», путем экзоцитоза выводится на поверхность антигенпредставляющих клеток, где молекулы МНС II класса, ассоциированные с антигенными компонентами, фиксируются в плазматической мембране. Антигенные детерминанты в комплексе с молекулами МНС II класса распознаются Т-хелперами, которые путем выработки интерлейкина-2, активируют В-лимфоциты к превращению в плазматические клетки, интенсивно продуцирующие антитела (т.е. Т-хелперы запускают специфические гуморальные иммунные реакции).

Рис. Схема подготовки вирусных антигенов к взаимодействию с молекулами МНС I класса и последующей презентации Т-лимфоцитам. Вирусы путем пиноцитоза проникают внутрь антигенпрезентирующей клетки, после чего подергаются частичному разрушению под действием ферментов протеосом, локализованных в цитоплазме этой клетки. Образовавшиеся в результате частичного разрушения вируса пептидные антигены с помощью белков ТАР1 и ТАР2, формирующих подобие ворот в мембране эндоплазматического ретикулума, проникают в его полости, где вступают во взаимодействие с антигенраспознающим центром молекулы МНС I класса. Молекула МНС I класса до взаимодействия с антигенной детерминантой, находясь внутри ЭПС, стабилизирована белком кальнексином, который отщепляется от молекулы МНС после ее взаимодействия с антигенным пептидом. Образовавшийся в полости эндоплазматической сети комплекс: "молекула МНС I класса - антигенная детерминанта" проходит через аппарат Гольджи и в составе отшнуровывающихся от него секреторных вакуолей поступает на поверхность антигенпредставляющей клетки, где фиксируется и в последующем может вступать во взаимодействие с рецепторами определенных, комитированных на данную антигенную детерминанту, СD8 Т-клеток (Т-киллеров)
При инфицировании организма паразитами, ведущими внутриклеточный образ жизни (микобактерии, возбудители чумы, токсоплазма и др.), начальные этапы реакций протекают аналогично таковым для бактерий, ведущих внеклеточное паразитирование: т.е. внутриклеточные паразиты под действием лизосомальных ферментов подвергаются частичному перевариванию в фаголизосомах, после чего фаголизосомы сливаются с мембранными пузырьками, отшнуровавшимися от аппарата Гольджи и содержащими молекулы МНС II класса в комплексе с инвариантной цепью. Далее инвариантная цепь под действием лизосомальных ферментов расщепляется, и молекула МНС II класса взаимодействует с антигенными детерминантами, после чего такой комплекс «молекула МНС II класса - антигенная детерминанта» в составе секреторных пузырьков выводится на поверхность клетки и взаимодействует с антигенраспознающими рецепторами Т-клеток воспаления, которые активируют макрофаги к внутриклеточному уничтожению возбудителя.

Рис. Схема подготовки бактериальных антигенов к взаимодействию с молекулами МНС II класса и последующей презентации наивным Т-лимфоцитам. Бактерии, а также их токсины фагоцитируются фагоцитом, в результате чего оказываются заключенными внутрь фагосом. Затем фагосомы сливаются с лизосомами фагоцита, что приводит к образованию фаголизосом, в которых происходит частичное разрушение бактерий и их токсинов ферментами лизосом. Фаголизосомы сливаются с секреторными вакуолями, отшнуровывающимися от аппарата Гольджи и содержащими молекулы МНС II класса, стабилизированные инвариантной γ-цепью. Синтез молекул МНС II класса и γ-цепи происходит в гранулярном эндоплазматическом ретикулуме, после чего эти молекулярные комплексы попадают в аппарат Гольджи и в составе его секреторных вакуолей поступают в цитоплазму, где сливаются с фаголизосомами. Под действием ферментов фаголизосомы инвариантные γ-цепи гидролизуются, и свободные молекулы МНС II класса получают возможность взаимодействовать с антигенными детерминантами. Затем образовавшиеся комплексы "молекула МНС II класса - антигенная детерминанта" путем экзоцитоза транслоцируются на поверхность фагоцита, где фиксируются и могут взаимодействовать с антигенраспознающими рецепторами определенных, комитированных на данную антигенную детерминанту, СD4 Т-клеток (Т-хелперов или Т-клеток воспаления).
Несмотря на полиморфизм и полигенность генов главного комплекса гистосовместимости, каждая соматическая клетка может продуцировать сравнительно небольшое разнообразие молекул I и II классов МНС, которое, в отличие от иммуноглобулинов, не может обеспечить очень высокой специфичности взаимодействия молекул МНС с каждой конкретной антигенной детерминантой. Иными словами, разнообразие существующих антигенных детерминант во много раз превосходит сравнительно небольшое разнообразие молекул МНС. Тем не менее, имеющееся разнообразие молекул I и II классов МНС антигенпредставляющих клеток способно обеспечить связывание теоретически любых антигенных детерминант, что достигается благодаря не очень высокой специфичности взаимодействия молекул МНС с антигенными компонентами. Так, разные аллельные формы молекул МНС могут взаимодействовать с различными антигенными пептидами, а одна и та же аллельная форма молекулы МНС может взаимодействовать с несколько отличающимися, но в тоже время и имеющими определенное сходство, пептидами. Сходство пептидов, которое позволит им вступать во взаимодействие с одной и той же аллельной формой молекулы МНС определятся наличием в составе антигенных детерминант определенных гидрофобных аминокислотных остатков, образующих ковалентные связи с определенными аминокислотными остатками антигенсвязывающих доменов молекул МНС (антигенсвязывающая область молекул МНС I класса имеет вид узкой щели, располагающейся между a1 и a2-доменами тяжелой a-цепи, а молекул МНС II класса – щели, ограниченной a1 и b1-доменами a- и b-цепей соответственно). Такие гидрофобные аминокислотные остатки антигенных детерминант получили название якорных остатков; именно они во многом определяют то, с какой именно молекулой МНС сможет взаимодействовать каждая конкретная антигенная детерминанта. Причем молекулы МНС I класса связывают сравнительно короткие антигенные детерминанты, состоящие всего из 8-10 аминокислотных остатков и обязательно образуют связи с концевыми аминокислотными остатками антигенной детерминанты внутри своей антигенсвязывающей щели, тогда как молекулы МНС II класса могут взаимодействовать с более длинными антигенными пептидными фрагментами, включающими 13 и более аминокислотных остатков, и не образуют связи с концевыми аминокислотными остатками антигенных детерминант. При фиксации антигенной детерминанты в антигенсвязывающем участке молекул МНС I и II классов, как было отмечено выше, определенные гидрофобные аминокислотные остатки антигенного пептида ковалентно присоединяются к определенным аминокислотным остаткам антигенсвязывающего центра молекул МНС. В результате такого взаимодействия антигенный пептидный фрагмент может определенным образом изгибаться в местах образования ковалентных связей с антигенсвязывающим центром, принимая определенную конформацию. Считают, что антигенраспознающие рецепторы Т-лимфоцитов специфически взаимодействуют с определенными антигенными детерминантами, фиксированными в антигенсвязывающих центрах молекул МНС, и специфичность такого взаимодействия во многом определяется характером изгибов антигенной детерминанты (т.е. зависит от ее конформации, приобретенной в антигенсвязывающем центре молекулы МНС).

Рис. Специфика взаимодействия антигенных пептидов с молекулами МНС I класса. С каждой аллельной формой молекул МНС I класса взаимодействует определенное число близких, хотя и неидентичных пептидов (панель 1 или 2; представлены пептиды, взаимодействующие с двумя отличающимися аллельными формами молекул МНС I класса). Взаимодействие таких пептидов происходит через относительно инвариантные гидрофобные аминокислотные остатки, получившие название якорных аминокислотных остатков, которые образуют ковалентную связь с реактивными группами антигенсвязывающего участка молекул МНС I класса. Поскольку расстояние между реактивными группами антигенраспознающего участка может быть короче длины антигенного пептида между его якорными аминокислотными остатками, то возможна разная форма изгиба у взаимодействующего пептида. Возникающая форма изгиба в линейной последовательности аминокислотных остатков антигенного пептида собственно и распознается антигенраспознающим рецептором Т-лимфоцитов
Антигенраспознающие рецепторы Т-лимфоцитов, называемые также Т-клеточными рецепторами, располагаются на поверхности зрелых Т-лимфоцитов, фиксированы в их мембране и не способны отсоединяться и поступать в межклеточные пространства. На поверхности зрелого Т-лимфоцита насчитывается около 3·104 антигенраспознающих рецепторов.
Антигенраспознающий рецептор Т-лимфоцитов представляет собой гетеродимер, состоящий из двух цепей – a и b-цепей, ковалентно связанных между собой цистеиновым мостиком. В каждой цепи выделяют один вариабельный (V-домен, расположен на NH-конце цепи) и один константный (С-домен, расположен на СООН-конце цепи) домены. Кроме того в составе каждой цепи имеются
ü участок, входящий в состав шарнирного домена Т-клеточного рецептора (именно в этом шарнирном домене и осуществляется ковалентное взаимодействие между a и b-цепями через посредство цистеина),
ü участок, образующий гидрофобную трансмембранную часть рецептора,
ü участок, входящий в состав сравнительно короткого цитоплазматического хвоста молекулы рецептора.
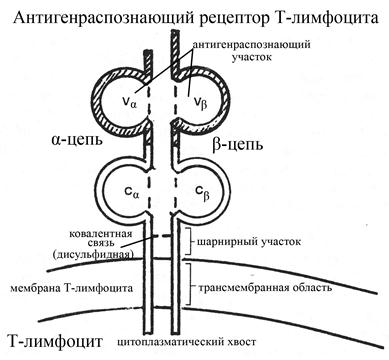
Рис. Структура антигенраспознающего рецептора Т-лимфоцитов
Сходство Т-клеточных рецепторов с молекулами антител заключается в наличии в a- и b цепях Т-клеточного рецептора двух типов доменов – вариабельного и константного, а также построении антигенсвязывющего участка Т-клеточного рецептора вариабельными доменами a- и b его цепей. Отличие же Т-клеточного рецептора от иммуноглобулинов состоит в его одновалентности (Т-клеточный рецептор имеет только один антигенсвязывающий центр, тогда как мономерные формы иммуноглобулинов – по два антигенсвязывающих центра), а также в том, что Т-клеточный рецептор не секретируется во внеклеточное пространство.
– Конец работы –
Эта тема принадлежит разделу:
Определение иммунологии, основные ее понятия
МОРФО ФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА ИММУННОЙ СИСТЕМЫ Общая морфо функциональная характеристика иммунной... МЕХАНИЗМЫ НЕСПЕЦИФИЧЕСКОГО ИММУНИТЕТА... Понятие о неспецифическом иммунитете...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Механизм распознавания антигенов Т-лимфоцитами, структурная организация антигенраспознающих рецепторов Т-лимфоцитов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?






Новости и инфо для студентов