Влияние давления и состава смеси на скорость реакции
Существует классификация газовых реакций в зависимости oт вида молекул, вступающих в реакцию: мономолекулярные реакции, в которых реагирует один вид молекул, давая при этом одну или несколько новых молекул; бимолекулярные реакции, в которых взаимно реагируют две молекулы, давая одну или несколько новых молекул.
Изменение скорости реакции в зависимости от давления и состава гомогенной смеси можно установить, используя уравнение состояния газа
 ,
,
где Р – давление смеси, Н/м2; п — количество смеси, моль; R — универсальная газовая постоянная, Дж/(моль-К). Для любого компонента газовой смеси
 ,
,
из (54) следует
 ;
;
с учетом (43)
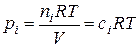 .
.
Приравнивая два последних выражения, получим
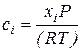 . (70)
. (70)
Скорость реакции выразим через изменения концентрации одного из компонентов продуктов реакции 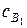 . С учетом выражений (61), (66), (69) получим:
. С учетом выражений (61), (66), (69) получим:
- для мономолекулярной реакции
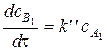 , (71)
, (71)
- для бимолекулярной реакции
 . (72)
. (72)
С учетом (70) выражения (71) и (72) примут вид
 ; (73)
; (73)
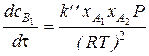 . (74)
. (74)
Таким образом, при постоянной температуре скорость реакции пропорциональна давлению смеси для мономолекулярной реакции и квадрату давления для бимолекулярной реакции. В общем виде
 ~Рн , (75)
~Рн , (75)
где н – порядок реакции.
Если продукты реакции выразить в относительных концентрациях (см. (47)), то выражения (73) и (74) примут вид:
 ; (76)
; (76)
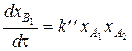 , (77)
, (77)
т. е. скорость мономолекулярной реакции, выраженная через относительные молярные концентрации компонентов, не зависит от давления, а для других реакций пропорциональна давлению в степени на единицу меньше, чем порядок реакции:
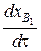 ~Рн-1 . (78)
~Рн-1 . (78)