рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Углеводы: моно-, ди- и полисахариды
Реферат Курсовая Конспект
Углеводы: моно-, ди- и полисахариды
Углеводы: моно-, ди- и полисахариды - раздел Философия, БиоОРГАНИЧЕСКая ХИМИя Вопрос 1. Какие Соединения Называются Углеводами? ...
Вопрос 1. Какие соединения называются углеводами?
Ответ. Углеводы – класс природных органических веществ, являющихся гетерофункциональными соединениями, содержащими одновременно карбонильную и гидроксильные функциональные группы (т.е. это многоатомные альдегидо- или кето-спирты или продукты их конденсации). Термин «углеводы» воз-ник в середине XIX века в связи с тем, что в молекулах многих углеводов соотношение атомов водорода и кислорода такое же, как и в молекулах воды, т.е. на два атома водорода приходился один атом кислорода, и молекулу углевода можно представить как состоящую из углерода (угля) и воды. Например, для глюкозы (С6Н12О6) формула может иметь вид С6(Н2О)6, формулу сахарозы (С12Н22О11) можно записать как С12(Н2О)11, а в общем виде – Сn(Н2О)m. Позже стали известны природные углеводы, которые не отвечают приведённой общей формуле (Сn(Н2О)m), тем не менее, термин «углеводы» используется и в настоящее время, наряду с термином «сахариды» или просто «сахара».
Вопрос 2. Какие функции выполняют углеводы?
Ответ.Углеводы образуются в растениях в результате фотосинтеза из углекислого газа и воды. Животные организмы не способны синтезировать углеводы, и получают их с растительной пищей. Таким образом, углеводы входят в состав всех живых организмов и являются одними из самых распространённых органических веществ на Земле. Функции углеводов:
– структурная и опорная функции (целлюлоза является основным структурным компонентом клеточных стенок растений, хитин выполняет аналогичную функцию у грибов, а также обеспечивает жёсткость экзоскелета членистоногих);
– защитная роль (у некоторых растений есть защитные образования: шипы, колючки и др., состоящие из клеточных стенок мёртвых клеток;
– энергетическая функция (при окислении 1 г углеводов выделяются 4,1 ккал энергии);
– пластическая функция (входят в состав сложных молекул, например, рибоза и дезоксирибоза участвуют в построении АТФ, ДНК и РНК);
– запасающая функция (углеводы выступают в качестве запасных питательных веществ: гликоген у животных, крахмал и инулин – у растений);
– осмотическая функция (участвуют в регуляции осмотического давления в организме, в т.ч. в крови);
– рецепторная функция (входят в состав воспринимающей части многих клеточных рецепторов).
Многие углеводы и их производные находят применение в фармации и медицине. Углеводы служат исходными веществами для промышленного производства бумаги, искусственных волокон, взрывчатых веществ, этилового спирта и т.д.
Вопрос 3. Как классифицируются углеводы?
 Ответ. Углеводы подразделяются на два класса: простые и сложные. Простые углеводы (моносахариды, монозы) не гидролизуются с образованием более простых углеводов. Примерами простых углеводов могут служить: глюкоза (С6Н12О6), рибоза (С5Н10О5), фруктоза (С6Н12О6).
Ответ. Углеводы подразделяются на два класса: простые и сложные. Простые углеводы (моносахариды, монозы) не гидролизуются с образованием более простых углеводов. Примерами простых углеводов могут служить: глюкоза (С6Н12О6), рибоза (С5Н10О5), фруктоза (С6Н12О6).
 |
Простые углеводы, содержащие кетогруппу, называются кетозами, альдегидную группу – альдозами. В зависимости от числа атомов углерода монозы делят на триозы (три атома углерода), тетрозы (четыре атома), пентозы (пять атомов), гексозы (шесть атомов) и гептозы (семь атомов).
Например, глюкоза содержит в молекуле альдегидную группу и шесть атомов углерода, её называют альдогексозой; фруктоза содержит карбонильную группу (является многоатомным кетоспиртом) и шесть атомов углерода, её называют кетогексозой. Рибоза является альдопентозой. Природные монозы, как правило, содержат неразветвлённые цепи атомов углерода.
|
|
|
Углеводы, гидролизующиеся с образованием большого количества (до нескольких тысяч) молекул простых углеводов, называются полисахаридами. Полисахариды являются высокомолекулярными соединениями. К ним относятся, например, крахмал и целлюлоза (клетчатка). Сложные углеводы можно рассматривать, как продукты поликонденсации моносахаридов.
Если полисахариды построены из остатков одного моносахарида, то их называют гомополисахаридами; если из остатков разных моносахаридов, то – гетерополисахаридами.
Среди гомополисахаридов наиболее биологически важными являются крахмал, гликоген, целлюлоза, среди гетерополисахаридов – альгиновые кислоты, агар (содержащиеся в водорослях); полисахариды соединительной ткани (хондроитинсульфаты, гиалуроновая кислота, гепарин).
Молекулы углеводов входят в состав смешанных биополимеров, например углевод-белковых биополимеров (гликопротеины, протеогликаны) или углевод-липидных (гликолипиды).
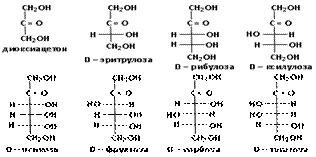
Вопрос 4. Являются ли моносахариды оптически активными соединениями? Как изобразить энантиомеры моносахаридов?
Ответ. Молекулы моносахаридов (кроме диоксиацетона) содержат центры хиральности (асимметрические атомы углерода), что является причиной существования стереоизомеров. Например, в альдогексозе имеются четыре асимметрических атома углерода и ей соответствуют 16 стереоизомеров (24 = 16), образующих 8 пар. В альдопентозе три асимметрических атома углерода и ей соответствуют 8 стереоизомеров (23 = 8), образующих 4 пары.
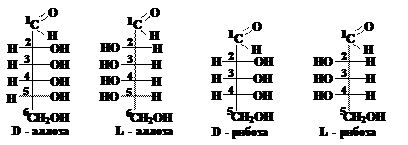 Члены одной пары являются антиподами или энантиомерами (их молекулы относятся друг к другу как предмет к своему зеркальному изображению). Энантиомеры имеют одно и то же название, но один из них относится к D-ряду, а другой – к L-ряду. Энантиомеры можно изобразить в виде незамкнутых проекционных формул Фишера, например:
Члены одной пары являются антиподами или энантиомерами (их молекулы относятся друг к другу как предмет к своему зеркальному изображению). Энантиомеры имеют одно и то же название, но один из них относится к D-ряду, а другой – к L-ряду. Энантиомеры можно изобразить в виде незамкнутых проекционных формул Фишера, например:
В формулах Фишера углеродная цепь записывается вертикально и нумеруется с того конца, к которому ближе альдегидная или кетогруппа, т.е. с верхнего углеродного атома. Асимметричные углеродные атомы символом «С» не обозначаются, подразумевается, что они находятся на пересечении вертикальных и горизонтальных линий.
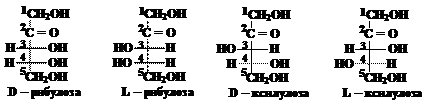 Молекула кетопентозы содержит 2 асимметрических атома углерода (третий и четвёртый) и образует 2 пары энантиомеров:
Молекула кетопентозы содержит 2 асимметрических атома углерода (третий и четвёртый) и образует 2 пары энантиомеров:

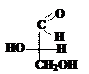 Принадлежность изомера к D- или L-ряду определяется сравнением конфигурации наиболее удалённого от карбонильной группы асимметрического атома углерода с конфигурацией изомеров глицеринового альдегида, который принят в качестве стандарта. Глицериновый альдегид содержит в молекуле один асимметрический атом углерода и имеет два энантиомера:
Принадлежность изомера к D- или L-ряду определяется сравнением конфигурации наиболее удалённого от карбонильной группы асимметрического атома углерода с конфигурацией изомеров глицеринового альдегида, который принят в качестве стандарта. Глицериновый альдегид содержит в молекуле один асимметрический атом углерода и имеет два энантиомера:
| |||
| |||
Рассмотрим в качестве примера изомеры фруктозы:
 | |||
|
В обеих формулах содержится по три асимметрических (хиральных) атома углерода. Это атомы 3, 4 и 5. Наиболее удалены от кетогруппы (С=О) хиральные атомы под номером 5. В формуле (1) конфигурация пятого атома углерода соответствует конфигурации хирального атома в молекуле D-глицеринового альдегида (ОН группа расположена справа, атом водорода – слева). Таким образом, первый изомер относится к D-ряду, это D-фруктоза. Конфигурация пятого атома углерода в формуле (2) соответствует конфигурации L-глицеринового альдегида, т.е. это L-фруктоза. Подавляющее большинство природных моносахаридов принадлежит к D-ряду.
Вопрос 5. Встречаются ли моносахариды в природе в свободном виде?
Ответ. Самым распространённым природным моносахаридом является D-глюкоза – виноградный сахар или декстроза от лат. dextrus – правый, т.к. обычная природная D-глюкоза имеет удельное вращение + 52,5о, т.е. вращает плоскость поляризации плоскополяризованного света на 52,5о вправо.
В свободном виде содержится в крови, являясь основным энергетическим субстратом для мозга. Постоянный уровень глюкозы поддерживается с помощью гормона инсулина, уменьшающего концентрацию глюкозы в крови, а также глюкагона, адреналина и других гормонов, увеличивающих её концентрацию. При сахарном диабете инсулин вырабатывается поджелудочной железой в недостаточном количестве, что приводит к увеличению её концентрация в крови.
Интересно, что L-глюкоза, являясь энантиомером обычной природной D-глюкозы, также является сладкой, но не усваивается организмом, поэтому она может быть использована как заменитель сахара.
В свободном виде глюкоза содержится также в зелёных частях растений, в различных фруктах и мёде. Входит в состав крахмала, гликогена, целлюлозы, гемицеллюлоз, декстранов, сахарозы, мальтозы и многих гликозидов.
D-фруктоза – плодовый сахар или левулёза от лат. laevus – левый, т.к. водные растворы D-фруктозы имеют удельное вращение - 92,4o.
Фруктоза содержится в зелёных частях растений, в нектаре цветов, в плодах, в мёде. Входит в состав сахарозы, а также многих полисахаридов.
D-галактоза. В свободном кристаллическом виде выделяется на плодах плюща. Встречается в качестве составной части некоторых дисахаридов (лактоза) и полисахаридов (хондроитин, агар-агар, слизи, гемицеллюлозы)
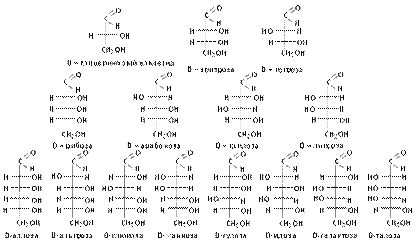
Вопрос 6. Как написать формулу L-изомера галактозы, если известна формула D-изомера?
Ответ.Для того, чтобы написать формулуэнантиомера, необходимо изобразить в зеркальном отражении заместители у всех асимметрических атомов углерода. Запишем формулу D-галактозы, выбрав из схемы, приведённой ниже и поменяем расположение заместителей (–Н и –ОН) у 2, 3, 4 и 5 атомов углерода:
 | |||
 |
В результате получаем формулу энантиомера D-галактозы
 :
:
 |  | ||
Название энантиомера: L-галактоза.
Вопрос 7. В чём состоит различие между диастеромерами, эпимерами и энантиомерами?
Ответ.Стереоизомеры углеводов, отличающиеся конфигурацией одного или нескольких асимметрических атомов углерода, называются диастереомерами, например: D-аллоза и D-манноза; D-фруктоза и L-тагатоза и т.д.
Эпимеры и энантиомеры – частные случаи диастереомеров.
Диастереомеры, относящиеся друг к другу как предмет к своему зеркальному изображению, называются энантиомерами. Энантиомеры имеют одинаковые физические и химические свойства, отличаются эти изомеры только направлением вращения плоскости поляризации плоскополяризованного света. Различается также биологическая активность энантиомеров.
Если диастереомеры различаются конфигурацией только одного асимметрического атома углерода, то их называют эпимерами. Если различается конфигурация второго атома углерода, то такие диастереомеры называют просто эпимерами; если других атомов углерода, то к названию добавляется номер этого атома.
Например, D-рибоза и D-арабиноза отличаются конфигурацией только второго атома углерода и являются эпимерами.
D-аллоза и D-глюкоза отличаются конфигурацией только третьего атома углерода и являются 3-эпимерами, а D-аллоза и D-гулоза – 4-эпимерами.
Эпимеры имеют различные физические и оптические свойства, а также биологическую активность.
Вопрос 8. Как определить, являются ли диастереомерами D-аллоза и L-идоза?
Ответ.Дляэтого надо написать формулы этих альдоз. Формула D-аллозы приведена на схеме (см. вопрос 6). L-идоза являются энантомером D-идозы, т.е. их молекулы относятся друг к другу как предмет и его зеркальное изображение и, зная формулу D-идозы легко записать формулу L-идозы (см. вопрос 6):
Диастереомеры, по определению, должны отличаться конфигурацией одного или нескольких асимметрических атомов углерода. Из рассмотрения формул D-аллозы и L-идозы следует, что конфигурации второго и четвёртого атомов углерода у них одинаковы (и в молекуле D-аллозы и в молекуле L-идозы ОН группы у этих атомов расположены справа, а атомы водорода – слева).

Конфигурации третьего и пятого атомов углерода отличаются (в молекуле D-аллозы ОН группы находятся справа от углеродной цепи, а в молекуле L-идозы – слева). Таким образом, D-аллоза и L-идоза отличаются конфигурацией двух асимметрических атомов углерода: третьего и пятого, и, следовательно, являются диастереомерами.
Вопрос 9. Как определить, являются ли эпимерами D-глюкоза и D -манноза?
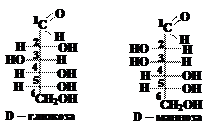 Ответ. Дляэтого надо написать формулы этих альдоз. Формула приведены на схеме (см. вопрос 6).
Ответ. Дляэтого надо написать формулы этих альдоз. Формула приведены на схеме (см. вопрос 6).
Эпимеры являются частным случаем диастереомеров и, по определению, должны отличаться конфигурацией только одного асимметрического атома углерода. Из рассмотрения формул D-глюкозы и D-маннозы следует, что у третьего атома углерода в обеих молекулах атом водорода расположен справа, а гидроксильная группа – слева; у четвёртого и пятого атомов углерода в обеих молекулах атом водорода расположен слева, а гидроксильная группа – справа; т.е. конфигурации третьего, четвёртого и пятого асимметрических атомов углерода у D-глюкозы и D-маннозы одинаковы.
Конфигурация второго атома углерода отличается (в молекуле D-глюкозы ОН группа находится справа от углеродной цепи, а в молекуле D-маннозы – слева). Таким образом, D-глюкоза и D-манноза отличаются конфигурацией только одного (второго) асимметрического атома углерода и, следовательно, являются эпимерами.
Вопрос 10. Как образуются циклические формы моносахаридов?
Ответ.Циклические формы моносахаридов образуются в результате внутримолекулярного взаимодействия между карбоксильной и гидроксильной группами. Эти формы термодинамически более устойчивы, чем открытые формы молекул углеводов. Обычно возникают пятичленные (фуранозные) и шестичленные (пиранозные) циклы. В пространстве оказываются сближенными альдегидные (или кетонные) группы и гидроксильная группа при четвёртом или пятом (для альдоз) и пятом и шестом (для кетоз) атоме углерода. За счёт их взаимодействия и происходит замыкание циклов в молекулах моносахаридов.
Шестичленный пиранозный цикл образуется при взаимодействии альдегидной группы с пятым атомом альдопентоз или альдогексоз; а также при взаимодействии кетогруппы с шестым атомом кетогексоз.

Пятичленный фуранозный цикл образуется при взаимодействии альдегидной группы с четвёртым атомом альдотетроз, альдопентоз и альдогексоз; а также при взаимодействии кетогруппы с пятым атомом кетопентоз и кетогексоз.
 |
В результате образования цикла в молекуле альдогексозы у первого атома углерода вместо альдегидной группы появляется гидроксильная группа (у кетогексоз у второго атома углерода). Эта гидроксильная группа получила название гликозидной (полуацетальной) гидроксильной группы (гликозидный гидроксил). В названиях циклических форм к обозначению углевода добавляется окончание «пираноза» для шестичленного цикла или «фураноза» для пятичленного цикла.
В циклической молекуле моносахарида увеличивается число асимметрических атомов углерода, т.к. асимметрическим становится атом углерода, который ранее входил в состав альдегидной или кетонной группы. В случае галактозы это первый, а в случае фруктозы – второй атом углерода. Этот атом получил название аномерного углерода. Появление дополнительного асимметрического атома приводит к увеличению числа оптических изомеров, соответствующих циклической форме, в два раза по сравнению с открытой формой. Так, для альдогексозы это уже не 16, а 32 изомера. Каждому изомеру открытой формы отвечают два изомера циклической формы (аномеры).
У α-аномера конфигурация аномерного центра одинакова с конфигурацией асимметрического атома углерода, определяющего принадлежность к D- или L-ряду, а у β-аномера она противоположна. В проекционных формулах Фишера у моносахаридов D-ряда в α-аномере гликозидная гидроксильная группа находится справа, а в β-аномере – слева от углеродной цепи; для L-изомеров наоборот, в α-аномере гликозидная гидроксильная группа находится слева, а в β-аномере – справа от углеродной цепи. Аномеры являются диастереомерами и отличаются по своим свойствам (например, по температурам плавления). Аномеры можно рассматривать как частный случай эпимеров.
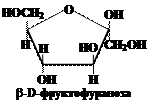
Вопрос 11. Как изображаются циклические формы моносахаридов в виде перспективных формул Хеуорса?

 Ответ.В системе Хеуорса циклы изображают в виде плоских пяти- или шестиугльников, расположенных перпендикулярно плоскости рисунка, поэтому линии, соответствующие передней части кольца выделяют более жирным шрифтом. Атом кислорода располагается в пиранозном цикле в дальнем правом углу, в фуранозном – также в дальнем правом углу или в середине задней части кольца. Гидроксильные группы и атомы водорода располагают перпендикулярно плоскости цикла. Символы атомов углерода в циклах обычно не пишутся.
Ответ.В системе Хеуорса циклы изображают в виде плоских пяти- или шестиугльников, расположенных перпендикулярно плоскости рисунка, поэтому линии, соответствующие передней части кольца выделяют более жирным шрифтом. Атом кислорода располагается в пиранозном цикле в дальнем правом углу, в фуранозном – также в дальнем правом углу или в середине задней части кольца. Гидроксильные группы и атомы водорода располагают перпендикулярно плоскости цикла. Символы атомов углерода в циклах обычно не пишутся.
 |
 Чтобы написать формулу Хеуорса вначале изображают формулу Фишера и поворачивают её на 90о вправо (по часовой стрелке:
Чтобы написать формулу Хеуорса вначале изображают формулу Фишера и поворачивают её на 90о вправо (по часовой стрелке:
 Поворачивают на 90о атом углерода, связанный с гидроксильной группой, вступающей в реакцию циклизации. При построении маннофуранозы это будет четвёртый атом углерода, при построении маннопиранозы – пятый. В результате поворота группа –ОН должна расположиться в одну линию с основной углеродной цепью. Поэтому для D-изомера группа –СН2ОН окажется вверху, а для L-изомера – внизу:
Поворачивают на 90о атом углерода, связанный с гидроксильной группой, вступающей в реакцию циклизации. При построении маннофуранозы это будет четвёртый атом углерода, при построении маннопиранозы – пятый. В результате поворота группа –ОН должна расположиться в одну линию с основной углеродной цепью. Поэтому для D-изомера группа –СН2ОН окажется вверху, а для L-изомера – внизу:
Далее замыкают цепь и получают проекцию Фишера:

В названии циклической формы указывается: тип аномера (a или b), затем принадлежность к стереохимическому ряду: D- или L-; затем название моносахарида, производным которого является данная циклическая форма, без окончания «–за», то есть оставляем глюко-, манно-, фрукто- и т.д., в заключение указывается тип циклической формы (пираноза или фураноза).
У альдогексоз D-ряда в пиранозной форме (и у альдопентоз и кетогексоз D-ряда в фуранозной форме) группа СН2ОН всегда располагается над плоскостью цикла, что служит формальным признаком D-ряда. Для L-ряда эта группа располагается под плоскостью цикла. Гликозидная группа –ОН у a-аномеров альдоз D-ряда оказывается под плоскостью, а у b-аномеров – над плоскостью цикла. Для соединений L-ряда гликозидный гидроксил у a-аномеров L-ряда оказывается над плоскостью, а у b-аномеров – под плоскостью цикла.
Следуя приведённым выше правилам, можно написать формулы Хеуорса для фуранозных и пиранозных форм кетоз, например для фруктозы:
 |
 |
Вопрос 12. В каких формах (открытых или циклических) преимущественно находятся моносахариды в твёрдом состоянии и в растворе?
Ответ.В твёрдом состоянии моносахариды находятся в циклической форме (преимущественно пиранозной). В растворах устанавливается равновесие между открытой формой и двумя парами циклических аномеров (цикло-оксо-таутомерное равновесие или цикло-цепная таутомерия). Различные формы молекул, находящихся в состоянии такого равновесия называются таутомерами. В смесях таутомеров преобладают пиранозные формы. Открытые формы и фуранозные циклы содержатся в малых количествах. Преобладание a- или b-аномера зависит от природы монозы, растворителя, концентрации и других внешних условий.
Таутомерные формы углеводов могут переходить друг в друга, что приводит к пополнению количества той или иной формы по мере её расходования в каком-либо процессе. Равновесие между всеми формами является, таким образом, динамическим. Так, если какой-либо аномер глюкозы растворить в воде, он постепенно превращается в другой аномер, пока не образуется равновесная смесь двух аномеров, в которой также содержится очень небольшое количество открытой формы. Этот переход сопровождается изменением оптического вращения раствора, т.к. для каждого таутомера характерен свой угол вращения плоскости поляризации плоскополяризованного света. Такое явление называют мутаротацией моносахаридов.
Вопрос 13. Напишите a-фуранозную и b-пиранозную формы L-арабинозы. Изобразите их аномеры в виде проекций Фишера.
Ответ. За исходное соединение необходимо взять D-арабинозу. Записываем её формулу и строим формулу её энантиомера (см. вопрос 6).
L-арабиноза – альдопентоза. Её фуранозная форма образуется за счет взаимодействия альдегидной группы с гидроксилом четвертого углеродного атома; а пиранозная форма – за счет взаимодействия альдегидной группы с гидроксилом пятого атома углерода. При циклизации водород гидроксильной группы (С5 или С4) присоединяется к кислороду альдегидной группы за счет разрыва p-связи С–О, образуя полуацетальный, или гликозидный, гидроксил (заключен в рамку). Кислород гидроксильной группы у атома С4 или С5 после отщепления от него водорода соединяется с углеродом альдегидной группы у атома С1. Возникает кислородный мостик, связывающий атомы С1–С4 и замыкающий пятичленный цикл, или С1–С5 и замыкающий шестичленный цикл.


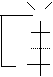


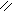 О О НО Н Н ОН
О О НО Н Н ОН

 С – Н 1С – Н C С
С – Н 1С – Н C С
 НО Н Н 2 ОН H ОН H ОН
НО Н Н 2 ОН H ОН H ОН
 Н ОН НО 3 Н HO Н HO Н
Н ОН НО 3 Н HO Н HO Н
 Н ОН НО 4 Н О Н О Н
Н ОН НО 4 Н О Н О Н
СН2ОН 5СН2ОН СН2ОН СН2ОН
D-арабиноза L-арабиноза a-L-арабинофураноза b-L-арабинофураноза
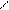


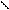



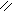 О О НО Н Н ОН
О О НО Н Н ОН











 С – Н 1С – Н C С
С – Н 1С – Н C С
 НО Н Н 2 ОН H ОН H ОН
НО Н Н 2 ОН H ОН H ОН
 Н ОН НО 3 Н HO Н HO Н
Н ОН НО 3 Н HO Н HO Н


 Н ОН НО 4 Н НО Н НО Н
Н ОН НО 4 Н НО Н НО Н



 СН2ОН 5СН2ОН О СН2 О СН2
СН2ОН 5СН2ОН О СН2 О СН2
D-арабиноза L-арабиноза a-L-арабинопираноза b-L-арабинопираноза
В полуацетальной форме первый атом углерода превратился в асимметрический. В результате этого при замыкании цикла из одной открытой альдегидной формы (оксоформы) получаются две циклические полуацетальные формы, отличающиеся одна от другой положением полуацетального гидроксила.
Циклическая форма, у которой полуацетальный гидроксил расположен по одну сторону (в циc-положении) с гидроксилом, определяющим конфигурацию (принадлежность к D- или L-ряду) монозы, называется a-формой. Циклическая форма, у которой полуацетальный гидроксил находится в транс-положении с гидроксилом, определяющим конфигурацию, называется b-формой. a и b-Формы представляют собой диастереомеры, называющиеся аномерами.
Вопрос 14. Какие соединения получаются при восстановлении D-глюкозы и D-фруктозы?
 Ответ. При восстановлении моносахаридов образуются многоатомные спирты (полиолы), называемые альдитами. Восстановление обычно проводят водородом в присутствии металлических катализаторов (палладий, никель) или боргидридом натрия. Водород присоединяется по месту разрыва двойной связи углерод – кислород карбонильной группы. При восстановлении альдоз получается лишь один продукт (полиол), например при восстановлении D-глюкозы образуется шестиатомный спирт D-глюцит (L-сорбит):
Ответ. При восстановлении моносахаридов образуются многоатомные спирты (полиолы), называемые альдитами. Восстановление обычно проводят водородом в присутствии металлических катализаторов (палладий, никель) или боргидридом натрия. Водород присоединяется по месту разрыва двойной связи углерод – кислород карбонильной группы. При восстановлении альдоз получается лишь один продукт (полиол), например при восстановлении D-глюкозы образуется шестиатомный спирт D-глюцит (L-сорбит):
D-глюцит, как и D-глюкоза является оптически активным соединением, т.к. в его молекуле присутствует 4 асимметрических атома углерода (2, 3, 4, 5) и отсутствуют элементы симметрии.
 Восстановление глюкозы в сорбит является первой стадией химического синтеза аскорбиновой кислоты. Сорбит окисляют микробиологически, используя микроорганизм Acetobacter suboxydans; образующуюся L-сорбозу в несколько стадий превращают в аскорбиновую кислоту.
Восстановление глюкозы в сорбит является первой стадией химического синтеза аскорбиновой кислоты. Сорбит окисляют микробиологически, используя микроорганизм Acetobacter suboxydans; образующуюся L-сорбозу в несколько стадий превращают в аскорбиновую кислоту.
При восстановлении кетоз получается смесь двух полиолов, т.к. атом углерода, входивший в состав кетогруппы, после восстановления становится асимметрическим и для него возможно двоякое расположение ОН группы и атома водорода в пространстве (как слева, так и справа от углеродной цепи). Например, для D-фруктозы имеем:
 |
D-глюцит и D-маннит обладают оптической активностью.
Многоатомные спирты, получающиеся при восстановлении моносахаридов, - кристаллические вещества, хорошо растворимые в воде; обладают сладким вкусом и могут использоваться, как заменители сахара при сахарном диабете (ксилит, сорбит).
Вопрос 15. При восстановлении каких альдогексоз образуются оптически неактивные шестиатомные спирты?
 Ответ. При восстановлении D-галактозы и D-аллозы получаются шестиатомные спирты дульцит и аллит соответственно. Молекулы этих спиртов имеют плоскость симметрии, проходящую между третьим и четвёртым атомати углерода, следовательно, эти полиолы оптической активностью не обладают.
Ответ. При восстановлении D-галактозы и D-аллозы получаются шестиатомные спирты дульцит и аллит соответственно. Молекулы этих спиртов имеют плоскость симметрии, проходящую между третьим и четвёртым атомати углерода, следовательно, эти полиолы оптической активностью не обладают.
Вопрос 16. Какие соединения могут получаться при окислении L-галактозы? Будут ли эти соединения оптически активны?
Ответ.Реакции окисления используются при биохимических анализах (например, анализ крови и мочи на сахар). Состав и строение продуктов окисления моносахаридов зависит от природы монозы и условий окисления (прежде всего от силы окислителя). Альдозы окисляются легче кетоз.
Под действием мягких окислителей (аммиачный раствор оксида серебра, гидроксид меди, бромная вода) альдозы превращаются в альдоновые кислоты (альдегидная группа окисляется до кислотной карбонильной группы).
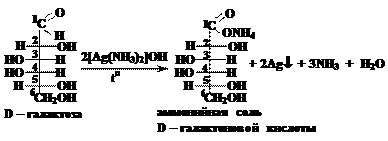 А) реакция «серебряного зеркала» (реакция Толленса):
А) реакция «серебряного зеркала» (реакция Толленса):
Внешний признак протекания реакции – образование на стенках пробирки слоя металлического серебра.
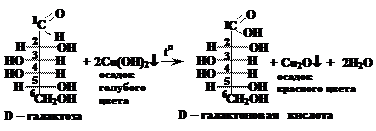 Б) реакция с гидроксидом меди (II):
Б) реакция с гидроксидом меди (II):
Внешний признак протекания реакции – превращение голубого осадка гидроксида меди (II) в красный осадок оксида меди (I).
В) окисление бромной водой (внешний признак протекания реакции – обесцвечивание раствора брома):

 С помощью сильного окислителя – разбавленной азотной кислоты – концевые группы альдоз (альдегидная и первичная спиртовая) одновременно окисляются в карбоксильные группы, образуя альдаровые (сахарные) кислоты, например:
С помощью сильного окислителя – разбавленной азотной кислоты – концевые группы альдоз (альдегидная и первичная спиртовая) одновременно окисляются в карбоксильные группы, образуя альдаровые (сахарные) кислоты, например:
Эта реакция может быть использована для обнаружения галактозы, т.к. слизевая кислота трудно растворяется в воде. Следует обратить внимание на тот факт, что, хотя в молекуле слизевой кислоты имеется четыре асимметрических атома углерода (2, 3, 4, 5), она не проявляет оптической активности, т.к. обладает плоскостью симметрии.
 В организме при участии ферментов может окислиться первичная спиртовая группа, в то время, как альдегидная группа в результате остаётся не окисленной. Продукты таких реакций называют уроновыми кислотами:
В организме при участии ферментов может окислиться первичная спиртовая группа, в то время, как альдегидная группа в результате остаётся не окисленной. Продукты таких реакций называют уроновыми кислотами:
В организме уроновые кислоты выполняют очень важную функцию: они образуют с лекарственными веществами и продуктами их превращений (метаболитами), токсичными веществами водорастворимые гликозиды и выводят их из организма с мочой, отсюда происходит название уроновых кислот (лат. urina – моча). D-глюкуроновая и L-идуроновая кислоты и их производные являются структурными элементами различных полисахаридов (пектиновые вещества, гепарин, гиалуроновая кислота, хондроитин, гепарин и т.д.). В ходе метаболизма уроновых кислот синтезируется аскорбиновая кислота (у человека не синтезируется).
Вопрос 17. Какие соединения могут получаться при окислении D-фруктозы? Будут ли эти соединения оптически активны?
Ответ.Окисление кетоз происходит под действием сильных окислителей и сопровождается деструкцией углеродного скелета. Разрыв связи может происходить двумя способами: между первым и вторым, а также вторым и третьим атомами углерода. При этом все концевые атомы углерода окисляются с образованием карбоксильных групп.
Так, при окислении D-фруктозы образуется четыре продукта реакции. При разрыве связи между первым и вторым атомами углерода образуются муравьиная и D-арабинаровая кислоты. При разрыве связи между вторым и третьим атомами углерода образуются щавелевая и мезовинная кислоты.
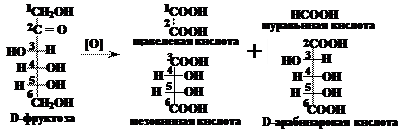 |
Щавелевая и муравьиная кислоты оптически не активны, т.к. в их молекулах отсутствуют асимметрические атомы углерода. Мезовинная кислота содержит два асимметрических атома кислорода, но имеет и плоскость симметрии, поэтому тоже не является оптически активным соединениям. D-Арабинаровая кислота полностью соответствует всем требованиям, предъявляемым к оптически активным соединениям: в молекуле этой кислоты присутствует три асимметрических атома углерода и отсутствуют элементы симметрии.
Вопрос 18. Какие соединения называются гликозидами?
|
|
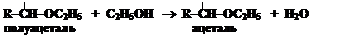 |
Моносахариды также образуют ацетали (кетали), которые и называются гликозидами:
 |
Гликозидами называют не только ацетали углеводов, образующиеся при взаимодействии со спиртами. К гликозидам относят продукты, образующиеся при взаимодействии полуацетального гидроксила с другими соединениями. Связь, которую образует полуацетальный гидроксил, также называют гликозидной.
Гликозиды могут классифицироваться в зависимости от того через какой атом агликон связан с сахарной частью гликозида: С-гликозиды, О-гликозиды, N-гликозиды, S-гликозиды.
В зависимости от размера цикла гликозиды подразделяются на пиранозиды и фуранозиды.
Неуглеводная часть гликозида называется агликоном (можно перевести как «несахар»). В приведённом примере это метоксигруппа – остаток метилового спирта (выделено курсивом). Названия гликозидов строятся следующим образом: агликон + гликозид. Окончание углевода -оза меняется на -озид. В самом начале названия указывают атом, через который агликон присоединяется к углеводной части.
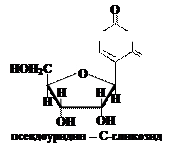
 Примером С-гликозида может служить псевдоуридин, примером S-гликозида – синигрин, содержащийся в горчице. Нуклеозиды – N-гликозиды рибозы и дезоксирибозы с нуклеиновыми основаниями, являются компонентами нуклеотидов, ДНК и РНК.
Примером С-гликозида может служить псевдоуридин, примером S-гликозида – синигрин, содержащийся в горчице. Нуклеозиды – N-гликозиды рибозы и дезоксирибозы с нуклеиновыми основаниями, являются компонентами нуклеотидов, ДНК и РНК.
 |
Вопрос 19. Как образуются сложные эфиры моносахаридов?
 Ответ.Сложные эфиры можно получить, действуя на моносахариды ангидридами органических кислот. Например, при взаимодействии с уксусным ангидридом получаются ацетильные производные моносахаридов.
Ответ.Сложные эфиры можно получить, действуя на моносахариды ангидридами органических кислот. Например, при взаимодействии с уксусным ангидридом получаются ацетильные производные моносахаридов.
Сложные эфиры гидролизуются как в кислой, так и щелочной средах.
Большое значение имеют эфиры фосфорной кислоты – фосфаты, содержащиеся во всех растительных и животных организмах. К ним, прежде всего, относятся фосфаты D-глюкозы: 1-фосфат D-глюкозы получается при гидролизе гликогена с помощью фермента фосфорилазы; 6-фосфат глюкозы образуется на первой стадии гликолиза (катаболизма глюкозы в организме).
 | |||
 | |||
Далее 6-фосфат глюкозы изомеризуется в 6-фосфат D-фруктозы, который фосфорилируется в свою очередь с помощью АТФ до 1,6-фосфата D-фруктозы.
Фосфаты D-рибозы и 2-дезокси-D-рибозы служат структурными элементами нуклеиновых кислот и ряда коферментов.
Эфиры серной кислоты – сульфаты – входят в состав полисахаридов соединительной ткани.
Вопрос 20. Напишите структурную формулу дисахарида, образованного двумя остатками b-D-галактозы, которые связаны между собой 1,4-гликозидной связью. Напишите структурную формулу продукта взаимодействия этого дисахарида с метиловым спиртом в присутствии хлороводорода. Могут ли эти соединения вступать в peaкцию «серебряного зеркала»? Напишите уравнения необходимых реакций.
Ответ.Молекулы b-D-галактозы могут образовывать между собой связи с участием 1-го и 4-го углеродных атомов:
 | |||
 | |||
 Звездочкой обозначен гликозидный гидроксил, который может замещаться на группу –ОСН3 при реакции с метанолом:
Звездочкой обозначен гликозидный гидроксил, который может замещаться на группу –ОСН3 при реакции с метанолом:
Благодаря наличию гликозидного гидроксила дисахарид может в водном растворе превращаться в линейную форму с альдегидной группой, поэтому он дает реакцию серебряного зеркала (уравнение приведено в упрощенном виде):
С12Н22О11 + Аg2О 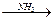 С12Н22О12 + 2Ag¯
С12Н22О12 + 2Ag¯
Монометиловый эфир дисахарида b-D-галактозы не содержит гликозидного гидроксила, не может существовать в линейной форме и не вступает в реакцию серебряного зеркала.
Вопрос 21. Каково строение молекулы сахарозы?
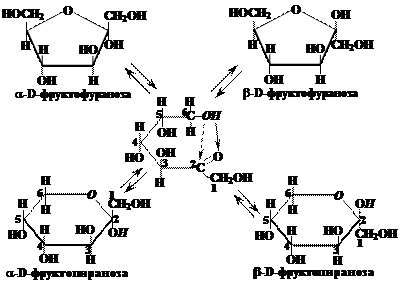
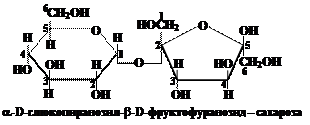 Ответ.При гидролизе молекула сахарозы расщепляется на молекулу α-D-глюкопиранозы и молекулу β-D-фруктофуранозы, таким образом, она является дисахаридом, т.е. состоит из двух остатков молекул моносахаридов:
Ответ.При гидролизе молекула сахарозы расщепляется на молекулу α-D-глюкопиранозы и молекулу β-D-фруктофуранозы, таким образом, она является дисахаридом, т.е. состоит из двух остатков молекул моносахаридов:
Эти остатки связаны гликозидной связью между гидроксильными группами при аномерных атомах углерода (1-й атом α-D-глюкопиранозы и 2-й атом β-D-фруктофуранозы).
В молекуле сахарозы отсутствуют свободные ОН-группы у 1-го атома углерода в остатке α-D-глюкозы и у 2-го атома углерода в остатке β-D-фруктозы (полуацетальные или гидроксильные гидроксилы). Поэтому молекула сахарозы не может переходить в открытую (альдегидную) форму и давать реакцию серебряного зеркала, а также окисляться гидроксидом меди, т.е. является не восстанавливающим серебро и медь углеводом.
Источниками сахарозы служат: сахарный тростник, сахарная свекла, соки растений и плодов.
Вопрос 22. Является ли сахароза самым сладким веществом?
Ответ. Именно сладкий вкус углеводов делает нашу жизнь ярче и вкуснее. Однако самым сладким веществом является не сахароза и даже вообще не углевод. Более сладким углеводом, чем сахароза, является фруктоза. Если принять относительную сладость сахарозы за 100, то сладость фруктозы составит 173, глюкозы 74, мальтозы и галактозы 32, а лактозы всего 16.
Однако, моносахариды могут быть и безвкусными и даже горькими, а вещества неуглеводной природы могут иметь сладкий вкус. Например, соединения бериллия и свинца могут быть сладкими. Ацетат свинца называется ―свинцовым сахаром, хотя использовать его как сахар совсем не рекомендуется ввиду высокой токсичности соединений свинца.
Также сладким вкусом обладают многие органические вещества, не имеющие ничего общего с сахарами, например, сахарин, сладость которого превышает сладость сахарозы примерно в 500 раз. 4-Этоксифенилмочевина (дульцин) в 200 раз слаще сахарозы и использовалась как подсластитель, пока не была обнаружена её вредность для организма.
Ацесульфам и аспартам (метиловый эфир дипептида L-аспартил-L-фенилаланина) в 200 раз слаще сахарозы. Метилфенхиловый эфир L-аспартиламиномалоновой кислоты в 33000 раз слаще сахарозы, а сукроновая кислота в 200000 раз.
Некоторые белки обладают удивительно сильным сладким вкусом. Например, белок монеллин из тропического растения Dioscoreophyllum cumminsii в 3000 раз слаще сахарозы, белок тауматин из тропического растения Thaumacoccus daniellii слаще сахара в 750-1000 раз, а его комплекс с ионами алюминия – талин – уже в 35000 раз слаще сахарозы. Белок миракулин из Synsepalum dulcificum не обладает сладким вкусом, но способен изменять вкус кислых продуктов на сладкий.
Вопрос 23. Какие олигосахариды наиболее распространены в природе?
Ответ. Сахароза (тростниковый сахар, свекловичный сахар) чрезвычайно распространена в растениях. Невосстанавливающий дисахарид.
Мальтоза (солодовый сахар) состоит из двух остатков a-D-глюкопиранозы, связанных a-1,4 -гликозидной связью. Мальтоза образуется при гидролизе крахмала под действием фермента амилазы; если долго жевать хлеб можно почувствовать сладковатый вкус мальтозы, образующейся из крахмала хлеба под действием амилазы слюны. Восстанавливающий дисахарид.
Целлобиоза состоит из двух остатков b-D-глюкопиранозы, связанных b-1,4-гликозидной связью. Является структурной единицей клетчатки (целлюлозы). В свободном виде содержится в соке некоторых деревьев. Восстанавливающий дисахарид.
Лактоза (молочный сахар) состоит из остатков b-D- галактопиранозы и a-D-глюкопиранозы, связанных b-1,4- гликозидной связью. Лактоза содержится только в молоке млекопитающих и является восстанавливающим дисахаридом.
В организме гидролиз лактозы происходит под действием фермента лактазы. При недостаточности выработки лактазы наблюдается лактазный дефицит и неспособность переваривать лактозу. Поэтому при потреблении молока людьми с лактазным дефицитом, лактоза не переваривается, а начинает сбраживаться кишечной микрофлорой с различными неприятными последствиями (метеоризм, диарея). У большинства людей и млекопитающих ген лактазы выключается по мере взросления. Это объясняется тем, что млекопитающие потребляют молоко только в младенчестве, и в дальнейшем нет смысла тратить энергию и аминокислоты на синтез лактазы. Однако, в результате мутации в одном из регуляторных генов, чей продукт выключал ген лактазы, этот фермент (лактаза) стал синтезироваться на протяжении всей жизни. Примерно 70% европейцев усваивают молоко в зрелом возрасте, тогда как в Африке, Океании и Центральной Азии только 30% населения умеют вырабатывать лактазу. Однако, народы Африки с традиционно высоким потреблением молока (тутси, туареги и др.) не имеют проблем с перевариванием лактозы.
Трегалоза (грибной сахар) состоит из двух остатков a-D- глюкопиранозы, связанных за счёт полуацетальных гидроксильных групп, поэтому трегалоза не восстанавливающий дисахарид.
Содержится в грибах и некоторых растениях. В дрожжах содержание трегалозы достигает 18% на сухое вещество.
Другие дисахариды, такие как мелибиоза, гентибиоза, тураноза, примвероза и т.д. встречаются редко.
Трисахариды встречаются редко. Трисахарид рафиноза, состоящий из галактозы, глюкозы и фруктозы, содержится в сахарной свекле. Является невосстанавливающим трисахаридом. Другие трисахариды (генцианоза, мелецитоза, маннинотриоза, целлотриоза, плантеоза) встречаются чрезвычайно редко.
Тетрасахарид стахиоза состоит из двух остатков галактозы, одного остатка глюкозы и одного остатка фруктозы. Стахиоза содержится в корнях Stachys, в семенах люпина, сои, гороха и является невосстанавливающим тетрасахаридом.
Циклические олигосахариды – циклодекстрины (декстрины Шардингера), образуются при гидролизе крахмала под действием амилазы из Bacillus macerans. Состоят из 6-10 остатков D-глюкозы, связанных a-1,4-гликозидными связями. Циклодекстрины известны тем, что проявляют каталитические свойства, например способны катализировать гидролиз сложных эфиров фенолов. Образуют цветные комплексы с йодом, причём молекулы йода лежат внутри полости циклодекстрина.
Вопрос 24. Какие углеводы называются полисахаридами?
Ответ. Полисахариды или полиозы – это высокомолекулярные углеводы. По химической природе это полигликозиды.
В молекулах полисахаридов много остатков моносахаридов связаны друг с другом гликозидными связями. При этом для связи с предыдущим остатком новый остаток предоставляет спиртовую гидроксильную группу, чаще всего при 4-м или 6-м атомах углерода. Для связи с последующим остатком предыдущий остаток предоставляет гликозидный (полуацетальный) гидроксил.
В полисахаридах растительного происхождения в основном осуществляются (1®4)- и (1®6) связи. Полисахаридные цепи могут быть разветвлёнными или неразветвлёнными (линейными).
Полисахариды гидролизуются в кислой среде и устойчивы к гидролизу в кислой среде. Полный гидролиз приводит к образованию моносахаридов или их производных, неполный – к ряду промежуточных олигосахаридов, в том числе и дисахаридов.
Вопрос 25. Чем отличаются гомополисахариды от гетерополисахаридов?
Ответ. Полисахариды делятся на две группы: гомополисахариды и гетерополисахариды.
Гомополисахариды состоят из остатков одного моносахарида, например: крахмал, целлюлоза, гликоген и др.
Крахмал – это смесь двух полисахаридов, построенных из a-D-глюкопиранозных остатков: амилозы (10-20 %) и амилопектина (80-90 %).
Цепь амилозы неразветвлённая, включает 200-1000 глюкозных остатков (молекулярная масса 160000).
 |
Молекулы амилозы свёрнуты в спираль, во внутренний канал которой могут входить подходящие по размерам молекулы (например – йода), образуя комплексы, называемые соединениями включения. Комплекс амилозы, с йодом имеет синий цвет. Это используется как качественная реакция на крахмал (йодкрахмальная проба).
Амилопектин, в отличии от амилозы, представляет собой разветвлённую спираль. В его основной цепи остатки α-D- глюкопиранозы связаны α(1®4)-гликозидными связями, а в точках разветвления – α(1®6)-гликозидными связями. Между точками разветвления располагаются 20-25 остатков α-D- глюкопиранозы. Молекулярная масса амилопектина достигает нескольких миллионов.
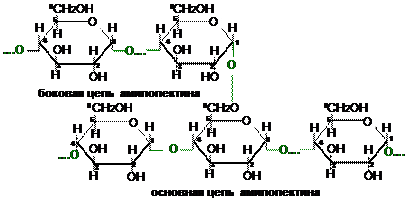
Крахмал представляет собой белое аморфное вещество. В холодной воде не растворяется, в горячей воде набухает и растворяется частично.
Крахмал образуется в растениях в процессе фотосинтеза и откладывается в клубнях, корнях, семенах. В пищеварительном тракте под действием ферментов происходит гидролиз крахмала, конечным продуктом гидролиза является α-D-глюкоза.
Гликоген – структурный и функциональный аналог растительного крахмала, содержащийся в животных организмах. По своему строению гликоген подобен амилопектину, но имеет ещё большее разветвление цепей. Между точками разветвления обычно содержатся 10-12 глюкозных звеньев, иногда даже 6. Молекулярная масса гликогена очень велика (до 100 миллионов). В организме гликоген выполняет функции резервного углевода. В нужный момент от него отщепляется в необходимых количествах глюкоза и энергетический фонд организма пополняется. В растениях роль резервного полисахарида выполняет амилопектин.
Целлюлоза или клетчатка – наиболее распространенный растительный полисахарид. Она выполняет роль опорного материала растений. В хлопке содержится почти 100 % целлюлозы, в древесине – 50-70 %.
Целлюлоза построена из остатков β-D-глюкопиранозы, которые связаны между собой β(1®4)-гликозидными связями. Цепь не имеет разветвлений, в ней содержится 2500-12000 β-D-глюкозных остатков (молекулярная масса 0,4-2 млн.).
 |
Линейное строение целлюлозы поддерживается также водородными связями, образующимися внутри углеводных цепей и между отдельными цепями. Целлюлоза не расщепляется ферментами желудочно-кишечного тракта человека и не может быть питательным веществом, но она необходима для нормального питания, т.к. способствует регулированию функции желудочно-кишечного тракта, стимулирует перистальтику толстого кишечника.
Пектиновые вещества содержатся в плодах и овощах. В присутствии органических кислот они образуют желе, что используется в пищевой промышленности. Молекулы пектиновых веществ включают пектовую – полигалактуроновую кислоту, состоящую из остатков D-галактуроновой кислоты, связанных a-(1®4)- гликозидной связью.
Некоторые пектиновые вещества оказывают противоязвенное действие и являются основой ряда препаратов, например, плантаглюцида из подорожника.

Гетерополисахариды состоят из остатков разных моносахаридов. Гетерополисахариды в организме связаны с белками и образуют сложные надмолекулярные комплексы. Примерами гетерополисахаридов могут служить гиалуроновая кислота и гепарин.
Гиалуроновая кислота состоит из остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, связанных β-(1®3)-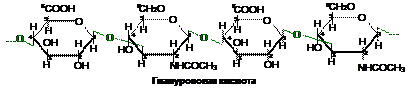 гликозидной связью.
гликозидной связью.
Гиалуроновая кислота обладает большой молекулярной массой и большой вязкостью и обеспечивает непроницаемость соединительной ткани для патогенных микроорганизмов. Гиалуроновая кислота обычно находится не в свободном виде, а в связи с полипептидными цепями. Смешанные биополимеры составляют основу клеток и жидкостей животных организмов.
В состав полимерных молекул гепарина входят остатки D-глюкозамина и двух уроновых кислот – D-глюкуроновой и L-идуроновой. В количественном отношении преобладает L-идуроновая кислота. Аминогруппа у большинства глюкозаминных остатков сульфатирована (содержит SО3Н-группу), а у некоторых из них – ацетилирована (связана с СН3СО-группой). Кроме того, группы SО3Н содержатся у ряда остатков L-идуриновой кислоты. Гепарин и его производное – гепаритин сульфат – в организме связаны с белком, гепарин препятствует свёртыванию крови, гепаритин сульфат входит в состав стенок кровеносных сосудов.
– Конец работы –
Эта тема принадлежит разделу:
БиоОРГАНИЧЕСКая ХИМИя
ТАМБОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ... ИМ Г Р ДЕРЖАВИНА... Романцова С В Панасенко А И...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Углеводы: моно-, ди- и полисахариды
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов