Закон Шарля
Якщо об’єм і маса газу залишаються незмінними, то в будь-якому стані тиск газу пропорційний його абсолютній температурі:
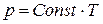 , (1.6)
, (1.6)
тобто в будь-якому стані  .
.
1.4.4. Об’єднаний газовий закон Менделеєва–Клапейрона
Клапейрон (1840 р.) об’єднав окремі закони для ідеальних газів і отримав таку залежність:
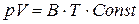 , (1.7)
, (1.7)
тобто встановив, що добуток тиску газу на об’єм в будь-якому стані пропорційний його температурі. Стала В – різна для різних газів. Менделеєв (1875 р.) показав, що це пов’язано з неодинаковістю молекул різних газів і визначив, що добуток 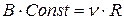 , де
, де 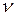 – число молей газу (
– число молей газу ( , де М – маса газу, кг;
, де М – маса газу, кг;  – молекулярна маса, кг/кмоль), а
– молекулярна маса, кг/кмоль), а 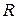 – універсальна газова стала (
– універсальна газова стала (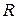 = 8,31 Дж/(моль.К)). Після цих визначень об’єднаний газовий закон буде виражати таке рівняння:
= 8,31 Дж/(моль.К)). Після цих визначень об’єднаний газовий закон буде виражати таке рівняння:
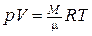 . (1.8)
. (1.8)
Його називають рівнянням (або об’єднаним газовим законом) Менделеєва – Клапейрона.
Як видно з рівняння (1.8), кількість газу (масу газу) можна виражати як в кілограмах, кілограм-молекулах, так і в одиницях pV. Остання частіше використовується у вакуумній техніці.
Дійсно, при Т = Const, матимемо
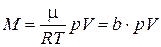 , (1.9)
, (1.9)
де b - коефіцієнт пропорційності.