рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Вид работы: Конспекты Лекций
- /
- Конспект лекций по курсу: Мониторинг окружающей среды
Реферат Курсовая Конспект
Конспект лекций по курсу: Мониторинг окружающей среды
Конспект лекций по курсу: Мониторинг окружающей среды - Конспект Лекций, раздел Философия, Кафедра Прикладной Экологии И Охраны Окружающей Среды...
Кафедра прикладной экологии и охраны окружающей среды
Конспект лекций по курсу: «Мониторинг окружающей среды»
Доц. Прилипко Ю.С.
ВСТУПЛЕНИЕ.
ХАРАКТЕРИСТИКА ОБЪЕКТОВ ПРИРОДНОЙ СРЕДЫ.
Контроль за состоянием природной среды - одно из важнейших звеньев в решении многих экологических проблем, в частности охраны водного бассейна,… Для обеспечения надлежащего качества экологического контроля (мониторинга)… Химический состав объектов окружающей среды и наличие в водах, грунте и в воздухе веществ-загрязнителей, токсикантов…Подразделения вод согласно минерализации
| Воды | Минерализация Σi г/кг |
| Пресные Солоноватые Морские Рассолы (рапы) | ≤ 1,0 1 - 25 25 – 50 > 50 |
Качественный состав матрицы природных вод можно характеризовать соотношением шести главных ионов, которые могут присутствовать в количестве 12,5 % - экв. Такими ионами являются: Na+, Mg2+, Ca2+, Cl-, SO42- и HCO3 + CO32-. По преобладающему содержанию ионов природные воды делятся на 3 класса: гидрокарбонатные и карбонатные (HCO3 + CO32-), сульфатные (SO42-) и хлоридные (Cl-). В свою очередь, каждый класс по преобладающему наличию катионов делится на 3 группы: кальциевую, магниевую и натриевую. Так, поверхностные воды Украины являются в основном гидрокарбонатно-кальциевыми, морские воды – хлоридонатриевые, а некоторые колодезные воды – сульфатно-магниевые («гирка вода») и т.д.
Особое внимание на качественный и количественный состав матрицы (главных ионов) природных вод необходимо обращать при их концентрировании и при определении некоторых химических ингредиентов, в частности, микрокомпонентов. Например, при выпаривании гидрокарбонатно-кальциевых вод может образоваться осадок Са СО3, на котором способны адсорбироваться много органических соединений и ионов металлов. При определении органического углерода в хлоридных водах окислением бихроматом необходимо создать условия для предотвращения окисления хлорид - ионов; при фотометрическом определении ионов аммония реактивом Неслера в сульфатно-натриевых водах необходимо предотвратить образование малорастворимого гидроксида Mg и т.д.
Химические ингредиенты природных вод делятся на 5 основных групп:
1. Растворенные газы – О2, СО2, Н2S, СН4 и т. д.
2. Главные ионы (солевые компоненты) – НСО3, СО32-, Cl-, SO42-, Na+, + K+, Mg2+, Ca2+.
3. Биогенные элементы – NH4+, NO2-,NO-3, азот органический (Nорг), орто и натрофосфаты, фосфор органический (Рорг), ортосиликаты, Fe (II, III).
4. Микроэлементы – Mn, Cn, Zn, CO, MO (биометаллы), Ni, Cr, Cd, Pb, Hg, F и др. компоненты (неорганические промышленные загрязнители)
5. Органические вещества – углерод органический (Сорг), белки, амины, аминокислоты, карбонаты и оксикарбонатовые кислоты, сложные эфиры, углеводы, жиры, карбонильные соединения природного и антропогенного происхождения.
Эти ингредиенты могут содержаться в природных водах в виде взвесей, коллоидных и растворенных форм. В свою очередь, растворенные ингредиенты могут быть в виде молекул (О2, СО2, Н2S, спирты, альдегиды и т.п.) и ионов (NO-3 НСО3-, SO42- некомплексованные и комплексные ионы металлов и т.д.)
Различные фазовые и молекулярно- и ионодисперсные состояния химических ингредиентов в природных водах следует учитывать при выполнении аналитических операций, особенно при отборе пробы и ее подготовке к анализу.
Наличие значительного количества химических ингредиентов обусловливает определенные физические, физико-химические, биологические и органолептические свойства природных вод. Эти свойства также являются показателями качества воды. Среди них важнейшими являются заданная плотность (густота) воды, ее прозрачность, цветность, вкус, запах, рН, окислительно-восстановительный потенциал (Eh), электропроводность и пятисуточное биохимическое употребление кислорода (БУКs).
Исходя из физико-географических условий формирования химического состава природных вод их можно разделить на поверхностные воды суши (речки, озера, водохранилища, пруды), подземные воды (артезианские и минеральные), морские и океанские воды и атмосферные осадки.
Состав поверхностых вод суши
Растворенные газы, рН, Eh . Из растворенных газов наиболее характерными являются кислород и диоксид углерода, содержание которых в большей степени зависит от температуры воды, ее прозрачности и глубины, с которой отбиралась проба. На рис. 1 показано влияние температуры (t) на растворимость кислорода в дистиллированной воде (кривая 1). Эта зависимость описывается формулой.
О2 (мг/л) = 4,505 × 10-3 × t2 – 3,716 × 10-1 × t + 14,650 (1)
Минерализация природных вод также влияет на растворимость кислорода, уменьшая ее на 0,04 – 0,08 мг/л на каждые 1000 мг солей в зависимости от температуры. Это влияние хорошо заметно при минерализации свыше 1 г/л и уменьшается при увеличении температуры воды (рис. 1, кривые 2 – 4)
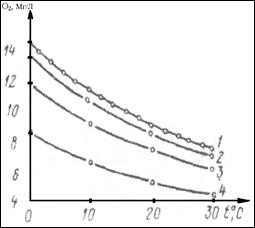
Рис. 1. Зависимость растворимости О2 от минерализации при разных t при Р = 760 мм рт.ст. и РО2 = 0,209 атм.; 1 – 0 (дист. вода), 2 – 10 г/л; 3 – 35 г/л; 4 – 70 г/л
Концентрация О2 в поверхностных водах суши может изменяться практически от 0 до 14-15 мг/л и зависит от влияния других групп противоположно направленных процессов. К первой группе процессов, которые обогащают воду кислородом, принадлежат абсорбции О2 из атмосферы и его выделения водными растениям при фотосинтезе. Последний в значительной степени зависит от температуры и интенсивности освещения природного водного объекта. К другой группе процессов, которые уменьшают содержание кислорода в воде, принадлежат биохимические окисления органических веществ и химическое окисление восстановителей (Fe2+, Mn2+, NO-2, Н2S и др.) Вследствие этого в незагрязненных водах концентрация растворенного О2 в летний период выше, чем зимой, и также выше в поверхностных слоях по сравнению с придонными. Глубинная стратификация также зависит от интенсивности перемешивания водных масс. Для маленьких и быстрых речек глубина стратификации меньше, чем для больших рек или озер, водохранилищ, прудов, особенно в штилевую погоду. Поскольку основным поставщиком О2 в поверхностные воды является фотосинтез водными растениями, то наибольшее насыщение воды кислородом наблюдается ~ в 14-15 часов, а наименьшее - ~ в 4-6 часов утра. Колебание содержания О2 на протяжении суток может достигать 2-3 мг/л и более. Поэтому для характеристики кислородного режима определенного водного объекта необходимо провести серийный анализ, отбирая пробы воды с различных глубин, в разных точках акватории и в разное время суток и анализировать немедленно после отбора пробы.
Диоксид углеродасодержится во всех водах в основном в свободном состоянии в виде молекулы СО2. Лишь часть этих молекул (~ 1 %) взаимодействуют с водой с образованием слабой угольной кислоты Н2СО3, и поэтому под растворенным СО2 подразумевают сумму СО2 + Н2СО3.
Основным источником поступления СО2 в поверхностные воды является биохимическое окисление органических соединений и в меньшей степени дыхание водных организмов. Снижение его содержания происходит при интенсивном фотосинтезе.
В результате этого в незагрязненных поверхностных водах концентрация растворенных О2 и СО2 изменяются антибатно (рис.2). Однако, эта зависимость нарушается при загрязнении воды органическими соединениями, особенно токсичными для водных организмов и неорганическими восстановителями, что приводят к значительному уменьшению концентрации О2 (черные точки рис. 2)
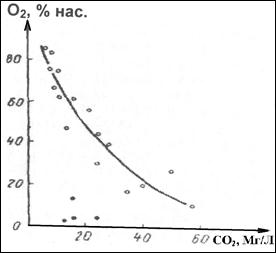
Рис. 2. Взаимосвязь между содержанием растворённых в воде кислорода и диоксида углерода
СО2 растрачивается также на растворение карбонатов:
↓CaCO3 + CO2 + H2O↔Ca2- + 2HCO-3 (2)
Равновесную концентрацию свободного СО2, моль/л, которая отвечает этой реакции, можно рассчитать по формуле, которая выводится совместным решением уравнений констант диссоциаций угольной кислоты и констант равновесия растворения CaCO3:
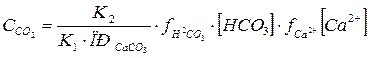 (3)
(3)
где К1 и К2 – последовательные константы диссоциации угольной кислоты (К1 = 4,5 × 10-7; К2 = 4,8 × 10-11); ПРСаСО3 = 4,8 × 10-9 (произведение растворимости СаСО3)
[HCO-3]и [Са2+] – концентрация этих ионов, моль/л;
 и
и 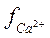 - их коэффициенты активности, которые зависят от ионной силы (минерализации воды). Если в природной воде возникает концентрация СО2 выше, чем она может в соответствии с уравнением (3), то такая вода содержит так называемый «агрессивный СО2» и способна разрушить бетонные гидросооружения вследствие протекания реакции (2).
- их коэффициенты активности, которые зависят от ионной силы (минерализации воды). Если в природной воде возникает концентрация СО2 выше, чем она может в соответствии с уравнением (3), то такая вода содержит так называемый «агрессивный СО2» и способна разрушить бетонные гидросооружения вследствие протекания реакции (2).
Сероводородв природных водах или отсутствует, или нагромождается в незначительных количествах в придонных слоях, особенно зимой. Присутствие сероводорода является признаком загрязнения воды органическими веществами. Для водных объектов санитарно-бытового и рыбохозяйственного назначения присутствие сероводорода и сульфидов недопустимо.
Концентрация ионов водородав природных водах зависит в основном от содержания продуктов диссоциации угольной кислоты, от наличия слабых органических кислот и солей тяжелых металлов, которые гидролизуются. Наиболее значительно на величину рН незагрязненных поверхностных вод суши влияет концентрация угольной кислоты. Поэтому в условиях интенсивного фотосинтеза в летнее время рН воды всегда является выше, чем в условиях преимущества деструктивных процессов, что приводят до нагромождения СО2 в холодное время года. По этой же причине рН поверхностных слоёв воды является в основном выше, чем придонных. В целом для поверхностных вод суши наиболее характерным является смена концентраций водных ионов в интервале рН 6,8 – 8,5 хотя в некоторых случаях, например, в болотных водах, рН может увеличиваться до 4,5-5.
Природные воды содержат много неорганических и органических ингредиентов, которые способны находится в различных состояниях окисления. Совокупность таких ингредиентов создает определенное окислительно-восстановительное состояние воды, которое характеризуется окислительно-восстановительным потенциалом Еh.Основными ингредиентами, которые влияют на Еh, являются растворенный кислород, соединения железа, марганца и серы, а также некоторые органические вещества. При высоком содержании О2, т.е. в условиях интенсивного фотосинтеза, Еh может достичь величин порядка + 700 мВ. Наоборот, в условиях биохимического окисления органических соединений, в результате чего в воде накапливается СО2 или образуется Н2S, окислительно-восстановительный потенциал может снизиться до – 100 мВ и ниже. В незагрязненных поверхностных водах значение Еh. и рН изменяется, как правило, параллельно, что влияет на состояние и реакционную способность многих ингредиентов. Так, при повышении Еh. и рН воды неорганический азот связывается преимущественно в ионы NO3, сера в SO4-, а марганец и железо образуют твердые соединения MnO2 и Fe(OH)3 или комплексы с неорганическими лигандами. Наоборот, при снижении Еh и рН воды неорганический азот переходит в ионы NH+4 , сера – в HS- , а доминирующими формами марганца и железа становятся ионы Mn2+ и Fe2+ и их комплексы с неорганическими и органическими лигандами.
Главные ионы (солевые компоненты). Хлориды, сульфаты и гидрокарбонаты натрия (калия),Mg и Са поступают в поверхностные воды суши, в основном вследствие растворения в воде различных горных пород, минералов, солей и т.д. Например, Са содержится в природе в основном в виде карбоната во многих минералах (кальцит, мрамор, мел, доломит), далее в виде сульфата (гипс, ангидрид) и, наконец, в породах вулканического происхождения (гранит, базальт), которые на 100 кг породы содержат ~ 4 кг химически связанного Са. Сульфаты Са относительно хорошо растворимы в воде и вместе с сульфатами Мg создают постоянную жесткость воды. Все другие минералы кальция плохо растворимы. Наличие же в природных водах значительного содержания ионов Са2+ и Мg2+ обусловлено образованием в присутствии СО2 хорошо растворимых гидрокарбонатов (см. реакцию № 2).
Наиболее распространённые интервалы концентраций главных ионов следующие (мг/л):
Мg2+ - 0,5 ÷ 50;
Na+ + K+ - 1 ÷ 75;
Ca2+ = 10 ÷ 120
Cl- - 5 ÷ 80;
SO4 – 2 ÷ 120
HCO3- - 10 ÷ 250
Как видим, в поверхностных водах суши доминируют ионы HCO3- и Ca2+, что отвечает гидрокарбонатно-кальциевым водам.
В результате электростатического взаимодействия между катионами и анионами, особенно при повышенных концентрациях, образуются ионные пары, наиболее характерные для карбонатов, гидрокарбонатов и сульфатов Са и Мg. Часть таких ионных пар (ассоциатов) незначительна и для Са, например, изменяется в интервалах:
СаСО30 – 1 ÷ 4 %;
СаНСО3+ - 3 ÷ 5 %;
СаSO40 – 2 ÷ 10 %.
Эти ассоциаты не являются стойкими и поэтому их образование не влияет на результаты аналитического определения главных ионов.
Концентрация главных ионов изменяется в поверхностных водах суши в основном под действием гидрологического фактора – при увеличении водного стока весной их концентрация уменьшается в результате разбавления, а в летне-осенний и зимний периоды, наоборот, увеличивается. Так минерализация воды в верхнем Днепре на протяжении многих лет изменяется в таких пределах (мг/л): весной – 100 – 250, летом – 200 – 340, осенью – 290 – 350 и зимой – 350 – 400.
Изменение рН воды практически не влияет на концентрацию главных ионов, кроме компонентов карбонатной системы
Н2О ОН- ОН-
СО2 ↔ Н2СО3 ↔ НСО-3 ↔ СО32‑ (4)
Н+ Н+
Состояние этого равновесия при различных значениях рН воды можно определить с использованием констант диссоциации угольной кислоты
(рис. 3)
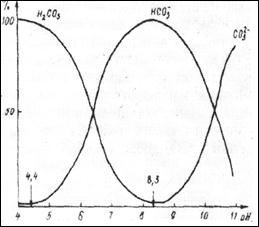
Рис. 3. Состояние равновесия ионов карбонатной системы от рН воды
Из рисунка видно, что для поверхностных вод суши (рН = 6,8 – 8,5) наиболее характерным является образование гидрокарбонатионов. При загрязнении воды кислотами или в результате интенсивных деструктивных процессов может образоваться значительное количество Н2СО3 (СО2), и при этом рН воды уменьшается. При повышении рН до 9 – 11, что имеет место в зонах интенсивного фотосинтеза, или при загрязнении воды соединениями основного характера образуется значительное количество ионов СО32-. Это может привести к уменьшению концентрации ионов Са2+ вследствие выделения в осадок Са СО3.
Биогенные элементы. К биогенным элементам принадлежат Р, N2, Si и Fe в разных соединениях. Они имеют огромное значение для развития живых существ, и их роль в природных водах подобна роли минеральных удобрений в развитии сельскохозяйственных культур.
Азот содержится в природных водах в виде разных неорганических и органических соединений. В органических соединениях N входит главным образом в ионы NH4+, NO2- и NO3-. В органических соединениях N входит главным образом в состав белков и продуктов их разложения – аминокислот, аминов и т.д. («органический азот» Nорг). Неорганические соединения азота («неорганический азот» Nнеорг) усваивается водными растениями в процессе фотосинтеза. Поэтому при интенсивной вегетации концентрация Nнеорг может уменьшатся практически к 0. Напротив, эти соединения появляются в водах при биохимическом разложении азотосодержащих органических соединений. Обратный переход одних соединений азота в другие с перемещением электронов является сложным химическим и биохимическим процессом, какой в общем виде можно отобразить схемой
Растения → животные → продукты разложения (Nорг) → NH4+ → NO2- → NO3- → растения.
Эти процессы являются очень лабильными и многофакторными, поэтому концентрации отдельных форм азота в природных водах изменяются в широких пределах (см. данные) Мг/л.
Таблица 2
Характерные интервалы концентрации биогенных элементов в поверхностных водах суши (в скобках ПДК, мг/л)
| Feобщ | 0,1 – 2 | |
| Siобщ | 1 – 10 | |
| Рорг | 0,01 – 0,2 | (не установл.) |
| Рнеорг | 0,01 – 5 | (не установл.) |
| Nорг | 0,2 – 2 | (не установл.) |
| NO3- | 0 – 2 | (10,0) |
| NO2- | 0 – 0,5 | (1,0) |
| NH4+ + NH3 | 0,02 – 1,5 | (NH4+ - 2,0; NH3 – 0,08) |
Наименее стойкой формой азота в условиях природных вод являются ионы NO2-, которые в зависимости от рН, Еh, концентрации О2 и активности водных бактерий, легко окисляются в NO3- или восстанавливаются в NН4+. Увеличение концентрации NO2- и особенно NН4+ является одним из признаков загрязнения природных вод.
Неорганические формы азота при больших концентрациях проявляют токсичные действия. При этом особую токсичность проявляет аммиак NH3, ПДК которого является наиболее низкой среди всех форм неорганического азота.
Соотношение между содержанием NH3 и значительно менее токсичными ионами NН4+ зависит от рН и температуры воды (табл. 3). Из таблицы видно, что при повышении общей концентрации аммонийного азота скопление значительного количества особенно токсичных для рыб NH3 можно ожидать при рН ≥ 9 и при высоких t.
Таблица 3
Зависимость содержания NH3 от рН воды при разных температурах
| t 0C | pН | ||
| 8,5 | |||
| 0,05 | 13,4 | 83,1 | |
| 0,02 | 6,7 | 70,1 | |
| 0,01 | 3,3 | 51,7 |
Источниками поступления соединений азота в природные воды являются минеральные удобрения и дожди, которые смывают их с почвы.
В дождевой воде содержатся также продукты окисления азота электрическими разрядами в атмосфере и промышленные азотосодержащие газовые выбросы. Значительное количество соединений азота попадает также в природные воды с коммунально-бытовыми стоками.
Уменьшению концентрации неорганических соединений азота в природных водах способствует процесс денитрификации, который происходит при недостатке О2 и при наличии безазотистых органических соединений типа клетчатки, крахмала и т.д. На их окисление расходуется О2 нитратов и при этом азот выделяется в свободном состоянии.
4NO3- + 5C + 2H2О → 2↑N2 + ↑CO2 + 4 HCO3- (5)
Фосфор содержится в природных водах также в виде неорганических и органических (Рорг.) соединений. Концентрации этих соединений практически одинаковы, хотя их уровень значительно ниже, чем концентраций соединений азота (Табл. 2).
В отличие от азота, который содержится в водах в степенях окисления – 3, +3 и +5, фосфор проявляет степень окисления только + 5, т.е. неорганические соединения Р можно рассматривать как производные ортофосфорной кислоты или продуктов её конденсации. Поступают соединения Р в природные воды в процессе жизнедеятельности гидробионтов и при минерализации их остатков. Концентрация Р уменьшается вследствие употребления его соединений водными растениями. Эти процессы можно отобразить схемой

Важным антропогенным источником поступления неорганического Р (ортофосфатов, полифосфатов) в поверхностные воды суши являются смывание фосфорсодержащих удобрений дождём с с/х угодий, а также сточные воды прачечных комбинатов, что содержат соединения Р в составе моющих средств.
В зависимости от рН природной воды, ортофосфаты содержатся в ней в основном в форме ионов H2PO4- и HPO42- , часть которых при изменении рН от 5 до 10 изменяется от 97,9 % до 0,05 % и от 1,9 % до 99,6 %, соответственно. Однако такая смена соотношения между различными формами Рнеорг. не влияет на результаты его определения наиболее распространённым фотометрическим методом в виде фосфорномолибденовой гетерополикислоты. Это обусловлено тем, что анализ выполняют в очень кислой среде, в которой в результате сдвига равновесия диссоциации ортофосфаты переходят в молекулы Н3РО4.
Кремний является постоянным компонентом природных вод, что связано с его присутствием в составе разнообразных минералов, с которыми контактируют воды. В поверхностных водах суши Si содержится в основном в виде мономерной малодиссоциирующей ортокремниевой кислоты H2SiO3 и поликремниевых кислот, а также в коллоидном состоянии X × SiO2 × УН2О, который часто является доминирующим. Содержание соединений кремния в поверхностных водах суши (табл. 2) ~ соответствует растворимости мономерной ортокремниевой кислоты, которая составляет ~ 6 мг/л. Значительное уменьшение концентрации соединений кремния, особенно в вегетационный период, свидетельствует о его интенсивном употреблении водными организмами. Многие из них строят свой скелет из кремния. Кроме того, кремниевая кислота как наиболее слабая может вытесняться из воды более сильной угольной кислотой.
Определение Si, аналогично Р, базируется на реакциях образования гетерополикислот. Поэтому Si, содержание которого в природных водах значительно превышает содержание Р, может мешать определению последнего.
Железо в виде растительных соединений, коллоидов и суспензий поступает в поверхностные воды суши вследствие химического выветривания горных пород, которое сопровождается их механическим разложением и растворением. Значительные количества соединений железа поступают также с подземными стоками и с сточными водами предприятий металлургической и металлообрабатывающей промышленности. С другой стороны, в природных водах происходят биологические и физико-химические процессы, которые сопровождаются употреблением водными растениями соединений железа и его осаждения в виде, в основном, гидроксида Fe(OH)3.
В состав неорганических и органических соединений природных вод Fe может входить при степенях окисления + 2 или + 3. Соединения Fe (+ 2) образуются при низких значениях рН и Еh, когда доминируют процессы деструкции органических соединений и вода обедняется на содержание растворённого О2. Такие условия возникают в природных слоях воды, особенно зимой во время замерзания. Fe (+ 2) в таких условиях содержится в форме Fe2+, [FeOH]+, [FeCO3]0 и комплексных соединений с органическими веществами. Соотношение этих форм зависит от рН воды и концентрации неорганических и органических лигандов.
Fe (+ 2) необходимое в организме человека для синтеза гемоглобина (суточная потребность 5 – 20 мг) и токсичное действие его не выявлено. Однако при содержании ионов Fe2+ > 0,5 мг/л вода приобретает своеобразный металлический вкус, поэтому его присутствие в водах является нежелательным.
При повышении рН и Еh железо (+ 2) окисляется растворённым в воде кислородом до Fe (+ 3), поэтому более характерной для поверхностных вод суши с рН ≥ 6 и Еh > 200 – 300 мВ является наличие соединений Fe (+ 3). В соответствии с расчётами с использованием ПР Fe(OH)3 и констант стойкости растворённых гидрокомплексов состава [FeOH]2+, [Fe2(OH)2]4+, [Fe(ОН)3]0 практически все Fe при этих условиях должно быть связано в гидрокомплекс [Fe(ОН)3]0 и его концентрация не может превышать 0,017 мг/л. Однако по данным табл. 2 выплывает, что для поверхностных вод суши характерной является более высокая концентрация железа, которая может достичь 2 мг/л и даже больше, особенно в летний период. Это свидетельствует о связывании ионов Fe (+ 3) в хорошо растворимые комплексы в органическими лигандами. Данные табл. 4 свидетельствуют о том, что в водах Fe3+ бывает в форме комплексов с лигандами молекулярной массы около 10 тыс.
Таблица 4
Средняя степень связывания Fe (+ 3) в комплексные соединения в природных водах
Связывание ионов Fe (+ 3) в стойкие комплексы с органическими лигадами часто… В данных на табл. 2 видно, что только общее содержание Fe и NH3 могут превысить ПДК.Содержание микроэлементов в поверхностных водах суши и биометаллах
| Объекты | Микроэлементы | Содержание, м кг/л | ПДК |
| Промышленные загрязнения | Cd | ≤ 0,0001 | (0,01) |
| Pb | 0,0001 – 0,005 | (0,1) | |
| Cr | 0,0001 – 0,005 | (0,1) | |
| Ni | 0,0005 – 0,01 | (0,1) | |
| Биометаллы | CO | 0,0001 – 0,01 | (0,1) |
| Mo | 0,0005 – 0,01 | (0,5) | |
| Cu | 0,002 – 0,05 | (0,1) | |
| Zn | 0,003 – 0,10 | (1,0) | |
| Mn | 0,002 – 1,0 | (1,0) |
Другие микроэлементы: Cd, Pb, Hg, Cr и т.д. являются антропогенными загрязнителями и проявляют сильные токсичные свойства. Например, ионы Pb2+, которые поступают в воду в результате геологических процессов, а также с выхлопными газами автомобилей и свинецсодержащих трубопроводов и аппаратуры, особенно при длительном контакте с водами являются особенно токсичными для кроветворных энзимов и нарушают деятельность нервной системы. Аналогично Hg2+ свинец нарушает работу желудка и лёгких, накапливается в костях, центральной нервной системе и волосе. При содержании Pb в крови уже 0,4 мг/л выявляются симптомы отравления. Особенно опасными для жизни являются микроконцентрации радионуклидов Sr, Ce, Pl и др. радиоактивных элементов. Необходимо отметить, что биометаллы при превышении ПДК также являются токсичными для водных организмов и др. живых существ.
В природных водах значительная часть микроэлементов входит в состав взвесей и коллоидов, в результате чего при увеличении мутности воды их количество в взвесях и коллоидах увеличивается и может достичь 100 %. При этом в состав взвесей входят преимущественно катионы металлов, которые способны образовывать малорастворимые оксиды, например, MnO2, а также гидроксиды, например свинца, Co, Ni, Cu и др. Амфотерные элементы, которые в природных водах содержатся в виде анионов, например МоО42-, и анионы неметаллов адсорбируются на взвесях хуже. При повышении рН воды сорбция микроэлементов увеличивается, однако взвеси разной химической природы и степени дисперсности выявляют неодинаковые сорбционные особенности относительно разных элементов.
По химическому составу растворенные формы микроэлементов в водах могут быть достаточно разнообразными. Так, в зависимости от рН воды и концентрации неорганических и органических лигандов в растворе могут быть незакомплексованные ионы металлов, гидроксокомплексы, карбонатные, сульфатные и хлоридные комплексы, а также координационные соединения ионов металлов со многими органичными лигандами. Некоторые из доминирующих форм, содержание которых может превышать > 1 % являются расчетными с использованием констант стойкости комплексных соединений и отвечают наиболее характерным для природных вод концентрациям лигандов.
В водах для большинства ионов металлов – микроэлементов, кроме ионов Mn, наиболее характерным является комплекс с органическими лигандами. В этом аспекте особенно выделяется Hg, которая практически полностью, более чем на 99 % связана в сульфатные и гуматные комплексы. Значительная часть металлов связывается в карбонатные и гидрокарбонатные комплексы. Вхождение металлов в состав назакомплексованных катионов и гидрокомплексов является менее характерным.
Для марганца, в отличие от других металлов, наиболее распространёнными формами в поверхностных водах суши являются аква-ионы Mn2+ и комплексы состава [MnCO3]0 и [Mn(ФК)n]z-, причем соотношение между этими формами зависит от рН воды. И действительно, в зимне-весенний период, когда интенсивность фотосинтеза незначительная в воде увеличивается содержание СО2, что приводит к снижению её рН, соответственно доминирующей формой являются ионы Mn2+ и их концентрация может даже превысить ПДК. Наоборот, в тёплое время года в условиях интенсивного фотосинтеза рН воды увеличивается и при этом ионы Mn2+ окисляются растворённым в воде О2, что приводит к осаждению MnO2.
Комплексные соединения микроэлементов с органическими лигандами природных вод характеризуются высокими молекулярными массами (табл.6). Однако распределение ионов металлов между комплексами с лигандами различной молекулярной массы неодинаковы. Так например, для ионов Hg (II) характерным является образование комплексов с молекулярной массой < 10 тыс., для ионов Pb > 10 тыс, а комплексы других микроэлементов имеют наиболее характерные молекулярные массы от 1 до 100 тыс.
Комплексные соединения ионов металлов с органическими лигандами природных вод являются достаточно стойкими и характеризуются константами стойкости в пределах 104 - 1012. Крепкое связывание ионов металлов в комплексы с органическими веществами – лигандами природного происхождения часто мешает их количественному определению. Поэтому для получения надёжных результатов при определении валового содержания ионов металлов в водах органические соединения необходимо заблаговременно уничтожить. Однако отдельные формы микроэлементов можно определить специальными методами без непосредственного уничтожения органических соединений.
Таблица 6
Молекулярные массы комплексных соединений микроэлементов
В то же время токсичность металлоорганических соединений, например триметилхлорида олова, диэтилхлорида свинца и т.д., значительно выше, за… Органические вещества. Кроме неорганических веществ, растворены и… Много органических соединений различных классов поступают в природные воды со сточными водами предприятий…Характерные интервалы концентраций органических соединений природного происхождения в поверхностных водах суши в мг С/л.
Третью группу показателей органических веществ природных вод составляют соединения антропогенного происхождения, содержание которых в первую очередь…СОСТАВ ПОДЗЕМНЫХ ВОД
Химический состав подземных вод формируется в особых условиях. При тесном контакте воды с разнообразными породами и минералами на протяжении… Наличие малопроницаемых водоподпорных слоев пород, которые разъединяют… Затруднительная связь подземных вод с атмосферой и поверхностью земли приводит к уменьшению до нуля содержания в водах…СОСТАВ ВОЗДУХА И АТМОСФЕРНЫХ ОСАДКОВ
Атмосферные осадки – дождь, снег, град, роса и иней – относятся к природным водам. Они оседают на поверхность Земли и могут рассматриваться как… Основной химический состав чистого воздуха, в котором содержатся молекулы… Таблица 8Химический состав чистого воздуха
Содержание этих ингредиентов в воздухе, а также паров воды, концентрация которых колеблется в очень широких пределах, формировалось на протяжении… В воздухе всегда присутствуют в малых количествах разные примеси газообразных… Наконец, в воздушном бассейне промышленных зон и больших городов, а также в воздухе цехов различных предприятий…ХИМИЧЕСКИЙ СОСТАВ ПОЧВ.
Минеральную часть почв составляют силикаты и алюмосиликаты, доминирующими компонентами которых являются соединения кремния, Al, Fe и Ca. Химический… По содержанию основных минеральных компонентов почвы делятся на несколько… Содержание неорганического фосфора (Р2О5) в почвах является достаточно постоянным. В то же время содержание сульфатной…Группы водосборной площади Днепра
Особенно важным в анализе почв является определение некоторых показателей,… Важной характеристикой почв является содержание доступных для растений биогенных элементов, таких как NH4+, NO3-,…ХИМИЧЕСКИЙ СОСТАВ ДОННЫХ ОТЛОЖЕНИЙ
Минеральной основой донных отложений рек, озер, водохранилищ и др. природных водных объектов также являются силикаты и алюмосиликаты. Их… Донные отложения вследствие их высокой сорбционной способности часто являются… Таблица 11Содержание основных компонентов и микроэлементов в донных отложениях
| Основные компоненты | Микроэлементы (мкг/кг) | ||
| N орг. | 0,01 – 0,4 | CO | 5 – 30 |
| C орг. | 0,1 – 3 | Cu | 10 – 150 |
| P2O5 | 0,01 – 0,5 | Mn | 300 – 5000 |
| Na2O | 0,5 – 2 | ||
| K2O | 0,2 – 4 | ||
| MgO | 0,1 – 2 | ||
| CaO | 0,5 – 4 | ||
| Fe2O3 | 1 – 10 | ||
| Al2O3 | 5 – 20 | ||
| SiO2 | 20 – 70 |
ОБЩАЯ СХЕМА АНАЛИЗА И ОСНОВНЫЕ ЭТАПЫ
В состав почв, природных вод и воздуха входит много химических ингредиентов, содержание которых изменяется в чрезвычайно широких пределах. Поэтому для анализа этих объектов применяют разнообразные методы. Рациональный выбор методов для определения конкретного ингредиента или группы ингредиентов обусловлен, с одной стороны, агрегатным состоянием и качественным и количественным химическим составом исследуемых объектов, а с другой стороны – аналитическими возможностями самого метода анализа. При этом необходимо учитывать некоторые особенности, которые присущи аналитической химии объектов природной среды, в частности, способам отбора и подготовки проб для анализа, а также созданию надлежащих условий для обеспечения адекватности между измеряемым аналитическим сигналом и концентрацией (содержанием) определяемого ингредиента.
Анализ любого природного объекта проводится по определённой разработанной схеме, возможный вариант которой представлен на рис.4.
Основными этапами анализа являются – выбор метода (1), отбор пробы (ІІ), подготовка пробы для анализа (ІІІ), выполнение анализа и измерения аналитического сигнала (ІV) и статистическая обработка результатов анализа (V). Однако чрезвычайно разнообразный химический состав объектов природной среды лишь в отдельных случаях позволяет провести анализ непосредственно по этим этапам, не применяя дополнительные операции, приведенные на схеме.
С приведенной схемы вытекает, что первым этапом анализа является выбор оптимального метода. Этот этап очень важный, потому что от выбранного метода анализа зависит величина пробы (для почв – навеска, г, для вод – объем, л, для воздуха – объем, м3), сложность и продолжительность анализа.
Величина пробы зависит от ожидаемого содержания определяемого ингредиента и чувствительности измеряемого аналитического сигнала. Например, для определения Са в интервалах 20 – 100 мг/л в природной воде объемным комплексопометрическим методом необходимо отобрать не менее 50 – 100 мл. пробы, тогда как для его определения методом фотометрии – лишь 0,5 мл и менее пробы воды. Уменьшение величины пробы особенно важно в случае необходимости транспортировки большого количества отобранных проб к месту анализа. Такая необходимость возникает, в частности, при исследовании гидрохимического режима водохранилищ, озёр и речек, когда десятки проб воды отбираются во время экспедиций и практически нет возможности выполнить химический анализ непосредственно на месте отбора проб. Это касается в некоторой степени и анализа почв, донных отложений и воздуха.
Селективность избранного метода влияет на продолжительность и точность анализа. Чем более селективным является избранный метод, тем меньше времени расходуется на анализ, поскольку нет необходимости в исключении компонентов, которые мешают анализу или в отделении от них определяемого ингредиента. Избежание дополнительных операций положительно влияет также на точность анализа. Например, атомно-абсорбционное определение микроэлементов, в частности Cu, Zn, Co и др. являются значительно селективнее, чем определение фотометрическим методом, а в некоторых случаях – также более точными. Кроме этого, при необходимости экстракционного концентрирования микроэлементов можно вносить экстракт непосредственно в пламя анализатора и этим самым исключить процесс реестракции, что также сокращает продолжительность анализа.
Возможность выполнения анализа непосредственно на месте отбора пробы является важной характеристикой метода. Это в частности, касается анализа природных вод, химический состав которых может изменяться в процессе транспортировки и сохранения отобранных проб вследствие протекания в них разнообразных биологических и физико-химических процессов. Например, определить концентрацию растворённого О2 и компонентов карбонатной системы, а также рН и Еh воды обязательно необходимо на месте отбора пробы с учётом её температуры, потому что эти показатели являются достаточно лабильными и их практически невозможно стабилизировать путём консервации пробы.
Анализ любого объекта включает измерения аналитического сигнала с использованием химических, физико-химических и физических методов (этап 4). Очевидно, что учёт их аналитических возможностей является существенным при выборе оптимального метода определения определённого ингредиента или группы ингредиентов.
Завершающая стадия анализа – статистическая обработка полученных результатов.
Характеристика методов анализа
Аналитический сигнал, который должен быть адекватным содержанию определяемого ингредиента в объекте анализа, измеряют химическими, физико-химическими или физическими методами.
Химические и физико-химические методы базируются на количественном измерении аналитических сигналов, которые возникают в результате химической реакции определённых компонентов с неорганическими и органическими реагентами или которые являются результатом окислительно-восстановительных процессов на электродах. Деление методов на химические и физико-химические является достаточно условным. К первой группе можно отнести методы, в которых измеряемым аналитическим сигналом является масса (гравиметрия) или объем (титрометрия), а ко второй – методы, в которых оптический или электрохимический сигнал измеряется с помощью спец. аппаратуры (оптические и электрохимические методы).
Физические методы основаны на измерениях сигналов, которые возникают вследствие возбуждения электронов в атомах или молекулах, а также ядерных превращений (эммисионная и атомно-абсорбционная спектроскопия, рентгеноспектральный анализ, радиометрические методы и т.д.). Эти методы в основном не требуют проведения химической реакции.
Если оптические методы – фотометрический, спектрофотометрический - используются без предварительного проведения химических реакций комплексообразования, окислительно-восстановительных и др., то их можно отнести к физическим методам анализа.
Деление методов измерения аналитического сигнала на 3 основные группы – химические, физико-химические и физические является разумным, поскольку они имеют разные возможности, которые следует учитывать при выборе оптимальных вариантов анализа объектов окружающей среды.
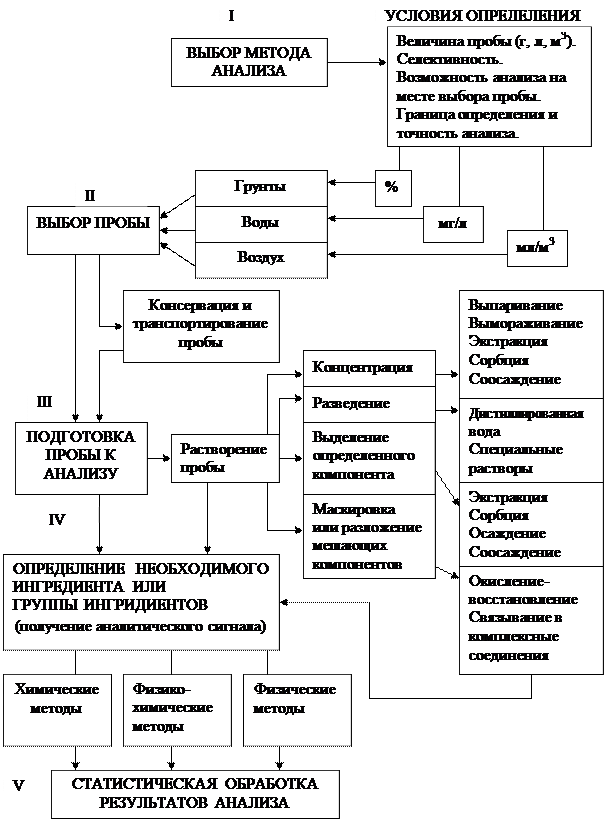
Рис. 4 Общая схема анализа объектов природной среды:
I, II, III, IV, V – основные этапы анализа
Таблица 12
Общая характеристика методов анализа объектов окружающей среды
Из таблицы видно, что наиболее точными и дешевыми являются химические методы анализа, хотя они довольно продолжительные (особенно гравиметрия) и…ОСОБЕННОСТИ АНАЛИЗА ВОЗДУХА
В воздушном бассейне находится много неорганических и органических соединений природного и антропогенного происхождения в газообразном и… Определить все вещества – загрязнители в атмосферном воздухе или в воздухе…ОТБОР ПРОБ
Концентрация токсичных веществ в атмосферном воздухе зависит не только от характера источников загрязнения, но также от метериологических условий и… В отличие от природных вод, за перемещением и смешением воздушных масс с… Способ отбора проб зависит от форм нахождения токсичных примесей в воздухе. Так, некоторые примеси могут быть в…ПОДГОТОВКА ПРОБ К АНАЛИЗУ.
При непосредственном газохроматографическом анализе подготовка пробы воздуха для анализа заключается в том, что при наличии твердых аэрозолей их… При сорбции или хемосорбции в жидкие поглощающие среды получают раствор, в… После аспирации воздуха через специальные волокнистые фильтры с целью улавливания твердых аэрозолей, в основном…ОСОБЕННОСТИ АНАЛИЗА ПОЧВ И ДОННЫХ ОТЛОЖЕНИЙ.
Химические ингредиенты, которые входят в состав почв и донных отложений с точки зрения их аналитического определения можно разделить на 3 группы. К… Отбор проб и их подготовка к анализуОСОБЕННОСТИ АНАЛИЗА ПРИРОДНОЙ ВОДЫ.
Виды проб и техника их отбора Пробы могут быть простыми и смешанными. Простые пробы получают одноразовым отбором такого объема воды, какой необходим…ОТБОР ПРОБ С ВОДНЫХ ОБЪЕКТОВ
Речки и ручейки. Пробы воды отбирают в местах наиболее быстрого течения в фарватере. Если не обусловлены какие либо особенные цели исследования, то… Водохранилища, озера, пруды. Пробы воды отбирают на стационарных точках,… Смешанную пробу в водохранилищах, озерах и прудах отбирать не рекомендуется. В стоячих водах вследствие большой…Зависимость t от n при различных Р
Результаты анализа в любых единицах выражаются следующим образом: Значение конечно вычисляют с вероятностью Р = 0,95 (95 % - ная вероятность)– Конец работы –
Используемые теги: Конспект, лекций, курсу, торинг, окружающей, среды0.087
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Конспект лекций по курсу: Мониторинг окружающей среды
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов