Связь между теплоемкостями при постоянном давлении и постоянном объеме.
Возьмем внутреннюю энергию как функцию объема и температуры:
U = f (V, T)
Запишем полный дифференциал этой функции
 (24)
(24)
и подставим его значение в выражение для первого закона термодинамики (15):
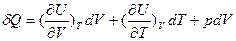 . (25)
. (25)
Предположим, что процесс происходит при постоянном объеме (dV = 0), тогда
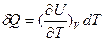 . (26)
. (26)
С другой стороны, из выражения (22):

Следовательно
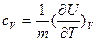
С учетом этого выражение для первого закона термодинамики (25) примет вид
 . (27)
. (27)
Если процесс идет при постоянном давлении из формулы (21) получим:

Подставляя это значение в формулу (27), получаем соотношение
 . (28)
. (28)
Преобразуем выражение (28):

Учитывая, что  при p = const, окончательно получим:
при p = const, окончательно получим:
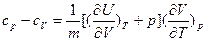 (29)
(29)
Соотношение (29) устанавливает связь между теплоемкостями cp и cV и частными производными:
 и
и 
В выражении (24) первое слагаемое  характеризует изменение сил взаимодействия между молекулами, второе слагаемое
характеризует изменение сил взаимодействия между молекулами, второе слагаемое  представляет изменение кинетической энергии молекул. Так как в идеальном газе силы взаимодействия между молекулами отсутствуют, первое слагаемое равно нулю, и соотношение (24) упрощается:
представляет изменение кинетической энергии молекул. Так как в идеальном газе силы взаимодействия между молекулами отсутствуют, первое слагаемое равно нулю, и соотношение (24) упрощается:
 (30)
(30)
В интегральном виде выражение (30) примет вид:

Для идеального газа из формулы (29) получим разность теплоемкостей:
 (31)
(31)
Для многих твердых тел объем незначительно изменяется с повышением температуры. Поэтому в практических расчетах для этих тел можно принять cp = cV. Для газов это не так.
Найдя  из уравнения состояния идеального газа (6) и подставляя в равенство (31), получим:
из уравнения состояния идеального газа (6) и подставляя в равенство (31), получим:
cp – cV = Rг (32)
Это уравнение Майера. Оно показывает, что удельная теплоемкость идеального газа при постоянном давлении больше удельной теплоемкости при постоянном объеме на величину газовой постоянной.
Так как Rг > 0, то cp > cv.
Отношение удельных теплоемкостей  называется коэффициентом Пуассона.
называется коэффициентом Пуассона.
Политропные процессы – это процессы, происходящие при постоянной теплоемкости, вызываемые подводом тепла к термодинамической системе или отводом тепла от нее.
В общем виде все политропные процессы описываются уравнением политропы:
p Vn = const, (33)
где n – показатель политропы,  .
.
Работа политропного процессаопределяется выражением:

Выразим давление из уравнения политропы (33)
 и подставим его значение под знак интеграла. Здесь буквой С обозначена константа в выражении (35). Вынося константу за знак интеграла, получим:
и подставим его значение под знак интеграла. Здесь буквой С обозначена константа в выражении (35). Вынося константу за знак интеграла, получим:

Подставляя значение константы С из уравнения (33), получим окончательное выражение для работы политропного процесса:
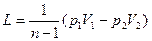 . (34)
. (34)
Количество тепла в политропном процессе:
Q = m c (T2 – T1). (35)
Изменение внутренней энергии:
ΔU = m cv (T2 – T1) . (36)
Изменение энтальпии:
ΔI = m cp (T2 – T1). (37)
Рассмотренные ранее изопроцессы, протекают при постоянной теплоемкости, и потому являются политропными.
|
 V = const, c = cv
V = const, c = cv
Показатель политропы для изохорногопроцесса:
 (38)
(38)
|
В изохорном процессе работа δL = p dV равна нулю. Значит, все подводимое к газу тепло расходуется на изменение его внутренней энергии.
ΔQ = dU = m cv dT

|
|
| |
| |
p = const, c = cp.
|
|
|
|

Работа в изобарном процессе равна:
L = p (V2 – V1) и равна площади
фигуры 1 - 2 – 2/- 1/.
Из первого закона термодинамики при p = const:
Q = U2 – U1 + p (V2 – V1) =
(U2 + pV2) – (U1 + pV1) = I2 – I1
То есть, в изобарном процессе внешняя теплота расходуется на изменение энтальпии газа.
 Изотермический процесс
Изотермический процесс
p = const, c = cт.

|
изотермического процесса:
В системе координат p – V изотерма.
Представляет собой кривую, которая называется гиперболой.
Работа изотермического процесса не может быть определена из выражения для работы политропного процесса, так как при n = 1 выражение (38) обращается в бесконечность. Получим выражение для работы в изотермическом процессе исходя из общего выражения для работы расширения:

Из уравнения политропы для изотермического процесса (закон Бойля – Мариотта)
 , где константа C = p1V1 = p2V2. Тогда
, где константа C = p1V1 = p2V2. Тогда
 (39)
(39)
Изменения внутренней энергии и энтальпии в изотермическом процессе равны нулю.
dU = 0, dI = 0