Второй закон термодинамики
Первый закон термодинамики позволяет решать многие термодинамические задачи. Однако он не рассматривает вопроса о направлении происходящих процессов. С точки зрения первого закона возможны любые процессы, которые не противоречат закону сохранения энергии. Например, первому началу термодинамики не противоречил бы процесс самопроизвольного перехода тепла от менее нагретого тела к более нагретому. Если рассматривать процесс падения камня с позиций закона сохранения энергии, то происходит превращение потенциальной энергии в кинетическую, а затем во внутреннюю энергию при ударе камня о землю. Первый закон термодинамики не запрещает обратного перехода внутренней энергии в механическую. То есть за счет своей внутренней энергии камень мог бы сам подняться на ту же высоту. Второй закон термодинамики утверждает, что такого явления не может быть.
Таким образом, второй закон термодинамики дает ответ на вопрос о направлении процессов, происходящих в природе.
Существует несколько формулировок второго закона термодинамики, имеющих один и тот же смысл. Рассмотрим некоторые из них.
Теплота сама собой не может переходить от тела менее нагретого к телу более нагретому без одновременных изменений в этих телах или в окружающей среде.
Другая формулировка:
Невозможно построить такую периодически действующую машину, которая бы непрерывно совершала работу за счет теплоты, выделяемой системой про охлаждении, причем других изменений в этой системе или в окружающей среде не происходило бы.
Эта формулировка по сути утверждает, что невозможно построить вечный двигатель второго рода.
Согласно первому закону термодинамики работа производится только за счет затрат энергии. Это значит, что невозможно построить такую машину, которая производила бы работу без затрат энергии, то есть вечный двигатель первого рода построить нельзя. Однако первый закон термодинамики не исключает возможность построить машину, которая работала бы за счет использования тепла окружающих тел. Например, если бы удалось построить двигатель, работающий за счет теплоты, получаемой от морей и океанов, то земной шар был бы обеспечен энергией в течении 1700 лет, а температура воды океанов понизилась бы только на 0,01 0С. Это был бы вечный двигатель второго рода. Второй закон термодинамики утверждает, что такого двигателя построить нельзя.
Применительно к тепловым машинам второй закон термодинамики можно сформулировать следующим образом.
Для того, чтобы действовала периодически работающая машина, необходимо минимум два источника тепла с различной температурой. При этом в работу может быть превращена лишь часть тепла, получаемого от высокотемпературного источника, в то время как оставшаяся часть тепла должна быть передана низкотемпературному источнику.
Высокотемпературный источник называют теплоотдатчикомили нагревателем,
низкотемпературный – теплоприемникомилихолодильником.
Рис. 8 иллюстрирует последнюю формулировку второго закона термодинамики. От нагревателя с температурой Т1 (Т1 > Т2) к тепловой машине передается количество теплоты Q1. Часть этой теплоты преобразуется в работу L, а оставшаяся часть Q2 отдается холодильнику, имеющему более низкую температуру Т2. КПД такой тепловой машины равен:
 (41)
(41)
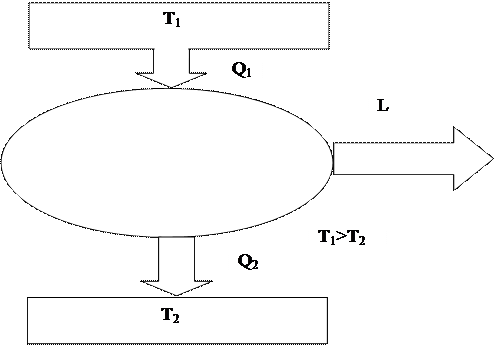 | |||
|
Если бы тепловая машина могла работать без холодильника, это бы означало Q2 = 0 и η = 1. То есть вечный двигатель второго рода обладал бы сто процентным КПД.
Процесс получения тепла тепловой машиной от нагревателя и передачи части тепла холодильнику показан на рис. 9 на примере работы паротурбинной установки.
 | |||
|
В этой схеме тепло источниками являются паровой котел и пароперегреватель, а роль теплоприемника выполняет конденсатор, в котором отработавший в турбине пар конденсируется и отдает свою энергию охлаждающей воде.
Первый закон термодинамики устанавливает существование у всякой термодинамической системы однозначной функции состояния – внутренней энергии.
Второй закон термодинамики устанавливает существование у всякой равновесной системы другой однозначной функции состояния – энтропии. Энтропия, в отличие от внутренней энергии, не изменяется у изолированной системы только при равновесных процессах и всегда возрастает при неравновесных процессах.
Если первый закон термодинамики – это закон сохранения энергии применительно к термодинамическим системам, то второй закон термодинамики – это закон об энтропии.
Рассмотренные ранее характеристики термодинамических процессов теплота Q и работа L не являются равноценными. Если работа может быть полностью превращена в любой вид энергии, то теплота Q непосредственно, без предварительного превращения в работу, приводит лишь к увеличению внутренней энергии системы. При превращении работы в теплоту может происходить изменение термодинамического состояния одного лишь тепло получающего тела (например, при нагревании за счет трения), то при превращении теплоты в работу, наряду с охлаждением теплоотдающего тела происходит изменение термодинамического состояния других, участвующих в этом процессе тел, т. е. холодильников. Этот процесс отдачи части теплоты рабочим телом другим телам называется компенсацией. Следовательно, превратить теплоту в работу без компенсации нельзя. В то время как работа в теплоту превращается без всякой компенсации.
Если в результате кругового процесса у какого-то тела было взято количество теплоты  (δQ > 0), а совершаемая работа равна L, то всегда выполняется условие:
(δQ > 0), а совершаемая работа равна L, то всегда выполняется условие:
Q1 > L ; если же работа превращается в теплоту, то всегда L = Q1.
Таким образом, второй закон термодинамики представляет собой совокупность двух независимых положений:
Q1 > L и L = Q1
Первое положение приводит в случае равновесных систем к установлению существования абсолютной температуры и новой однозначной функции состояния – энтропии. Совместно первое и второе положения устанавливают односторонний характер изменения энтропии при естественных процессах в замкнутых системах.
Таким образом, второй закон термодинамики определяет существование энтропии у всякой равновесной системы и неубывание ее при любых процессах в изолированных системах.
Для установления аналитической формы записи второго закона термодинамики необходимо рассмотреть его в отдельности для равновесных и неравновесных систем.
Применение второго закона термодинамики к равновесным процессам позволяет установить, что около каждого состояния термически однородной (с одинаковой температурой) системы существуют такие состояния, которые недостижимы из него равновесным адиабатическим путем. Это принцип адиабатической недостижимости.
Пусть из состояния 1 система равновесно переходит в состояние 2, получая от какого либо тела количество теплоты δQ > 0 и совершая работу δL, тогда
δQ = dU + δL (41)
Предполагая, что из состояния 2 система адиабатически может перейти в состояние 1, совершив работу δL1, находим:
0 = -dU + δL1 (42)
Складывая уравнения (41) и (42), получим, что за весь круговой процесс была совершена работа δL + δL1 за счет некомпенсированного превращения теплоты
δQ = δL + δL1 > 0
Поскольку по второму закону термодинамики такой процесс невозможен, следовательно, состояние 1 адиабатически недостижимо из состояния 2.
Если при равновесном переходе системы из состояния 1 в состояние 2 δQ < 0, то, предполагая возможным адиабатическое возвращение системы из 2 в 1, для всего кругового процесса получим:
δQ = δL + δL1 < 0
Такой процесс не противоречит второму закону термодинамики и, следовательно, возможен только при неравновесном адиабатическом возвращении системы из состояния 2 в состояние 1. Если бы процесс 2 – 1 был равновесным, то весь цикл был бы обратим, и, проводя его в обратном порядке, мы получили бы противоречие со вторым законом термодинамики.
Физический смысл принципа адиабатической недостижимости состоит в утверждении, что у всякой равновесной системы существует некая функция состояния, которая при равновесных адиабатических процессах не меняется (S = const). Эту функцию и называют энтропией. Через эту функцию можно определить элементарное количество теплоты δQ, которое согласно первому закону термодинамики не является полным дифференциалом:
δQ = T dS (43)
Энтропия определяется дифференциальным уравнением:
 (44)
(44)
Из второго закона термодинамики следует, что энтропия является однозначной функцией состояния. Это означает, что  для любого кругового равновесного процесса равен нулю. Если бы это не выполнялось, то можно было бы осуществить вечный двигатель второго рода. То есть
для любого кругового равновесного процесса равен нулю. Если бы это не выполнялось, то можно было бы осуществить вечный двигатель второго рода. То есть
 (45)
(45)
при любом круговом процессе.
Фактически существование энтропии как однозначной функции состояния говорит о том, что математической формой записи второго закона термодинамики являются уравнения вида (43) или (44). Интегральным уравнением второго закона термодинамики является равенство Клаузиуса:
 (46)
(46)
Комбинация первого закона термодинамики в виде выражения (15) и второго закона в форме выражения (44) позволяет получить основное уравнение термодинамики для равновесных процессов:
T dS = dU + p dV (47)