рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Вид работы: Конспекты Лекций
- /
- Тепловые циклы
Реферат Курсовая Конспект
Тепловые циклы
Тепловые циклы - Конспект Лекций, раздел Философия, Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы Для Непрерывного Получения В Тепловых Машинах Полезной Работы Необходимо Имет...
Для непрерывного получения в тепловых машинах полезной работы необходимо иметь периодические стадии расширения рабочего тела. Это возможно только, если в процессе работы тепловой машины рабочее тело сжимается и возвращается в первоначальное состояние.
Замкнутый процесс, в котором в конечном итоге рабочее тело
Замкнутый процесс, в котором в конечном итоге рабочее тело
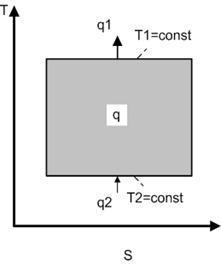
Цикл 1 – 2 – 3 – 4 – 1, в котором работа расширения больше работы сжатия, называется прямым цикломили циклом тепловой машины.
Цикл, осуществляемый в обратном направлении 1 – 4 – 3 – 2 – 1, называется обратным циклом или циклом холодильной установки.
|
 |
В прямом цикле тепло q1 подводится в процессе расширения газа 1 – 2 – 3. При этом газ совершает работу, численно равную площади фигуры
6-1-2-3-5-6.
В процессе сжатия газа 3 – 4 – 1 затрачивается работа lсж, численно равная площади фигуры 5-3-4-1-6-5. Часть подведенного тепла q2 отводится в холодильник, а рабочее тело возвращается в исходное состояние. В результате возникает полезная работа lц = lрасш. – lсж.
Соотношение между количеством тепла, использованного в цикле, и работой цикла определяется первым законом термодинамики:
qц = q1 – q2 = ∆uц + lц.
Так как в цикле конечное состояние совпадает с начальным, то ∆uц = 0, поэтому
qц = q1 – q2 = lц или q1 = lц + q2, то есть подводимая к рабочему телу в цикле тепловая энергия q1 частично превращается в полезную механическую работу, а другая ее часть отводится от рабочего тела.
Отношение количества теплоты, превращенной в работу, ко всей теплоте, подведенной от горячего источника, называется термическим КПД цикла:
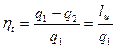 (73)
(73)
 КПД цикла является показателем совершенства цикла тепловой машины.
КПД цикла является показателем совершенства цикла тепловой машины.
Цикл Карно. Сади Карно доказал, что теоретически наиболее совершенным является тепловой цикл, составленный из 2-х изотерм и 2-х адиабат. Такой цикл получил название цикла Карно.
Цикл Карно для тепловой машины называется прямым циклом Карно, а цикл для холодильной машины – обратный цикл Карно. КПД прямого цикла Карно:


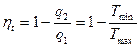 (74)
(74)
 |
|
Для осуществления обратного цикла Карно требуется затратить работу.
Эта работа превращается в тепло и передается вместе с теплотой q1 во внешнюю среду при изотермическом сжатии 3 – 2.
В соответствии с первым законом термодинамики
q1 = lц + q2
Таким образом, отвод тепла от холодных предметов и передача его теплому воздуху снаружи холодильной машины обязательно требует затрат механической работы.
Эффективность холодильной машины оценивается холодильным коэффициентом: определенное количество механической работы, равное площади диаграммы в координатах p – V.
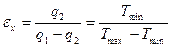
 |
– Конец работы –
Эта тема принадлежит разделу:
Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы
На сайте allrefs.net читайте: Конспект лекций Дисциплина по учебному плану направления подготовки: 260901 Технология швейных изделий. Омск СОДЕРЖАНИЕ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Тепловые циклы
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов