Уравнение состояния идеального газа
Идеальным называется газ, который состоит из молекул, обладающих пренебрежимо малыми размерами, силами взаимодействия между которыми можно пренебречь.
Уравнение состояния (уравнение Менделеева – Клапейрона) для такого газа имеет вид:
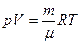 , (4)
, (4)
где m – масса газа, μ – его молярная масса, R – универсальная газовая постоянная (R= 8,314 Дж/моль град.).
Величина Rг = R/μ называется газовой постоянной и является константой только для данного сорта газа. С учетом этого, уравнение состояния можно записать в другом виде:
pV = mRгT (5)
Разделив обе части равенства (5) на массу газа, получим третью форму записи уравнения состояния через удельный объем:
pv = RгT. (6)
Уравнение состояния реальных газов(уравнение Ван-дер-Ваальса).
Это уравнение описывает газообразное и жидкое состояние реальных веществ. Для одного моля вещества (ν = m/μ = 1) уравнение Ван-дер-Ваальса имеет вид:
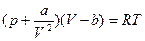 . (7)
. (7)
При условии p >> a/V2 и V>>b это уравнение переходит в уравнение состояния идеального газа.
Уравнение Ван-дер-Ваальса получается из уравнения Менделеева-Клапейрона путем внесения поправки a/V2 к величине давления и поправки b к объему.
Поправка b учитывает:
1. Объем, занимаемый молекулами реального газа.
2. Объем зазоров между молекулами при их плотной упаковке.
Т.е.
b = Vмол.+ Vзазор.
Поправка a/V2 учитывает силы взаимодействия между молекулами реальных газов. Она представляет внутреннее давление, которое возникает при взаимодействии соседних элементарных объемов. Внутреннее давление pi ~ n2 ~ ρ2 ~ 1/V2 (n – концентрация газа, ρ – его плотность).
Таким образом, общее давление складывается из внешнего и внутреннего давлений:
p + pi = p + a/V2 .
Законы изопроцессов.Изопроцессами называются термодинамические процессы, в которых один из трех параметров состояния остается постоянным. Эти законы были получены экспериментально. Однако их можно вывести теоретически из уравнения состояния для идеального газа.
Изотермический процесс.Это процесс, протекающий при постоянной температуре (T = const). В уравнении состояния идеального газа при постоянной температуре для определенной массы конкретного газа все величины в правой части уравнения являются константами. Следовательно, можно записать:
pV = const. (8)
Это и есть общая запись закона Бойля-Мариотта для изотермического процесса – произведение давления газа на его объем в изотермическом процессе сохраняется постоянным. Для двух состояний газа эта запись будет иметь следующий вид:
p1V1 = p2V2 или p1/p2 = V2/V1.
Отсюда следует другая формулировка закона Бойля-Мариотта – при постоянной температуре отношение давлений в газе обратно пропорционально отношению объемов газа.
Изобарный процесс– это процесс, протекающий при постоянном давлении (p = const). Запишем уравнение состояния в виде:
 . В этой форме записи при постоянном давлении правая часть уравнения также является константой. Следовательно, можно записать:
. В этой форме записи при постоянном давлении правая часть уравнения также является константой. Следовательно, можно записать:
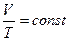 (9)
(9)
Это закон Гей-Люссака для изобарного процесса.
Для двух состояний газа имеем - 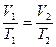 , или
, или  , т.е. при постоянном давлении отношение объемов газа пропорционально отношению температур.
, т.е. при постоянном давлении отношение объемов газа пропорционально отношению температур.
Изохорный процесс – это процесс при постоянном объеме (V = const). Из уравнения состояния получаем:
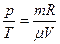 или
или 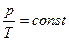 (10)
(10)
Для двух состояний газа запишем:
 После разделения переменных это выражение примет вид:
После разделения переменных это выражение примет вид: 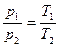 .
.
Каждая из этих формул представляет собой математическую запись закона Шарля для изохорного процесса. При постоянном объеме отношение давлений пропорционально отношению температур.
Закон Авогадро.При одинаковых температурах и давлениях в одинаковых объемах различных идеальных газов содержится одинаковое число молекул.
Из закона Авогадро следует, что количества газов, занимающих одинаковые объемы при постоянной температуре и давлении, относятся прямо пропорционально их молярным массам и обратно пропорционально удельным объемам.
При нормальных условиях 1 моль любого идеального газа занимает один и тот же объем, равный 22,4 л. Количество молекул, содержащихся в этом объеме, представляет собой константу, получившую название число Авогадро – Na = 6,02·1023 моль-1.
Закон Дальтона.Это закон для смеси идеальных газов. Формулируется он следующим образом. Давление газовой смеси равно сумме парциальных давлений газов, составляющих смесь.
Парциальное давление – это давление, которое оказывает на стенки сосуда каждая компонента смеси. В математической форме запись закона Дальтона:
pсм. = ∑ pi , (11)
где pi – парциальное давление i-й компоненты.