Обратимые и необратимые процессы
Определение обратимых и необратимых процессов связано с понятиями равновесных и неравновесных процессов. Так как равновесные процессы – это идеальные процессы, реально в природе не существующие, для характеристики реальных процессов вводят понятие процессов квазиравновесныхили квазистатических.
Квазистатическим называют процесс с малым отклонением от равновесного состояния. Это бесконечно медленный процесс, состоящий из ряда последовательных почти равновесных состояний. Равновесные процессы являются предельным случаем квазистатических. Равновесные процессы имеют два важных свойства.
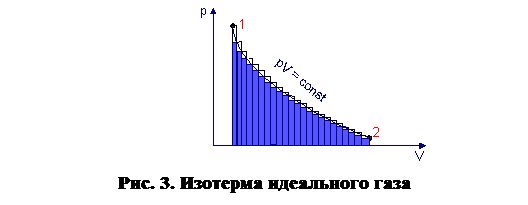
1. Равновесные процессы можно изображать графически в виде монотонной кривой. Это объясняется тем, что равновесные процессы описываются уравнением состояния, т. е. имеют функциональную зависимость между параметрами p, V, T, а всякую функциональную зависимость можно изобразить графически. Пример такой зависимости, представленной в виде графика на p – V диаграмме (p V = const) представлен на рис. 3.
2.Равновесные процессы обладают свойством обратимости. Обратимыми называются процессы, которые могут проходить как в прямом, так и в обратном направлении,
причем в последнем случае система проходит через те же состояния, что и при прямом процессе. При этом ни в окружающей среде, ни в самой системе ничего не изменяется.
 | |||||
 | |||||
|
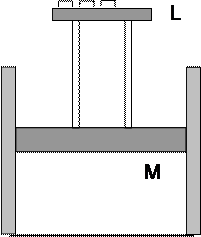
Рассмотрим иллюстрацию равновесного процесса с помощью опыта, схема которого представлена на рис.4. Поршень Мможет перемещаться в цилиндре без трения. Давление газа под поршнем р. На столике Lнаходится большое количество очень маленьких грузиков, которые можно снимать, уменьшая давление на поршень, либо добавлять, увеличивая давление. При снятии грузиков внешнее давление на газ уменьшается, и газ начинает расширяться, стремясь выровнять давление под поршнем с внешним давлением. При этом поршень будет подниматься. Если считать массы грузиков бесконечно малыми, можно считать подъем поршня бесконечно медленным и изотермическим, а давление одинаковым во всем объеме газа и равным внешнему давлению на поршень. Это будет процесс равновесного расширения газа, который иллюстрируется изотермой на рис. 3. Если теперь проводить процесс в обратном направлении, то есть добавлять на столик грузики бесконечно малой массы, то система будет проходить через те же состояния, что и в прямом процессе, при этом никаких изменений ни в самой системе, ни в окружающей среде не возникает.
Рассмотрим теперь процесс изменения состояния газа при изменении грузиков конечной массы. Пусть начальное состояние 1 (рис. 3) с более высоким давлением р1 уравновешивается определенным количеством грузиков на поршне. Если убрать один грузик, давление мгновенно упадет на величину ∆р. Газ при этом будет расширяться, совершая работу, равную площади прямоугольника со сторонами р и ∆V. Если убрать еще один грузик, то давление опять упадет на величину ∆р и опять произойдет расширение газа с совершением работы и т. д. В итоге система перейдет в состояние 2 и результирующая работа будет равна сумме площадей прямоугольников, то есть меньше площади под изотермой. Если же изменения давления сделать бесконечно малыми, то ломаная кривая сольется с изотермой и работа будет максимальной. Следовательно, работа, совершаемая газом в равновесном процессе расширения, максимальна.В обратном процессе сжатия газа при ступенчатом изменении давления работа всегда будет больше, чем в равновесном процессе при бесконечно малом изменении давления. Таким образом, в равновесном процессе работа расширения газа максимальна, а работа сжатия минимальна.