рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Вид работы: Конспекты Лекций
- /
- Удельная теплоемкость газов
Реферат Курсовая Конспект
Удельная теплоемкость газов
Удельная теплоемкость газов - Конспект Лекций, раздел Философия, Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы Экспериментально Установлено, Что Количество Теплоты, Необходимое Для Нагрева...
Экспериментально установлено, что количество теплоты, необходимое для нагревания тела, пропорционально массе тела и разности конечной и начальной температур.
Q ~ m (T2 – T1)
Введя коэффициент пропорциональности с, получим:
Q = c m (T2 – T1), откуда
 (16)
(16)
Коэффициент с имеет размерность 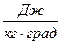 и называется удельной теплоемкостью вещества. Удельная теплоемкость газа равна количеству теплоты, которое нужно сообщить единице количества газа, чтобы повысить его температуру на 1 градус.
и называется удельной теплоемкостью вещества. Удельная теплоемкость газа равна количеству теплоты, которое нужно сообщить единице количества газа, чтобы повысить его температуру на 1 градус.
Если количество газа измеряется в единицах массы, то удельная теплоемкость называется массовойтеплоемкостью и определяется выражением (16).
Если количество газа измерять в единицах объема, получим объемную теплоемкость с’, размерность которой 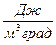 . Соответственно:
. Соответственно:
 . (17)
. (17)
Количество газа можно измерять числом молей. В этом случае удельная теплоемкость называется мольной:
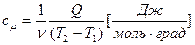 . (18)
. (18)
Значения удельной теплоемкости, определяемые формулами (16) – (18), являются средними. Чтобы получить истинную теплоемкость, надо перейти к пределу бесконечно малых величин. Например для массовой теплоемкости получим:
 . (19)
. (19)
Количество теплоты Q не имеет полного дифференциала, поэтому здесь использовано обозначение d’Q. Теплоемкость, как и количество теплоты, есть функция процесса, т. е. будет различной для изобарного, изохорного и изотермического процессов. Поэтому более общая запись величины удельной теплоемкости имеет вид:
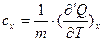 , (20)
, (20)
где х – параметр, остающийся в данном процессе постоянным.
Для изобарного процесса удельная теплоемкость при постоянном давлении:
 . (21)
. (21)
Для изохорного процесса удельная теплоемкость при постоянном объеме:
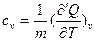 . (22)
. (22)
Для изотермического процесса:
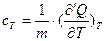 . (23)
. (23)
Отметим, что теплоемкость при постоянной температуре равна бесконечности (сТ = ∞), так как приращение температуры в этом случае равно нулю.
– Конец работы –
Эта тема принадлежит разделу:
Основные понятия термодинамики. Предмет термодинамики. Основные параметры состояния термодинамической системы
На сайте allrefs.net читайте: Конспект лекций Дисциплина по учебному плану направления подготовки: 260901 Технология швейных изделий. Омск СОДЕРЖАНИЕ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Удельная теплоемкость газов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов