Удельная теплоемкость газов
Экспериментально установлено, что количество теплоты, необходимое для нагревания тела, пропорционально массе тела и разности конечной и начальной температур.
Q ~ m (T2 – T1)
Введя коэффициент пропорциональности с, получим:
Q = c m (T2 – T1), откуда
 (16)
(16)
Коэффициент с имеет размерность 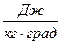 и называется удельной теплоемкостью вещества. Удельная теплоемкость газа равна количеству теплоты, которое нужно сообщить единице количества газа, чтобы повысить его температуру на 1 градус.
и называется удельной теплоемкостью вещества. Удельная теплоемкость газа равна количеству теплоты, которое нужно сообщить единице количества газа, чтобы повысить его температуру на 1 градус.
Если количество газа измеряется в единицах массы, то удельная теплоемкость называется массовойтеплоемкостью и определяется выражением (16).
Если количество газа измерять в единицах объема, получим объемную теплоемкость с’, размерность которой 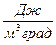 . Соответственно:
. Соответственно:
 . (17)
. (17)
Количество газа можно измерять числом молей. В этом случае удельная теплоемкость называется мольной:
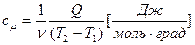 . (18)
. (18)
Значения удельной теплоемкости, определяемые формулами (16) – (18), являются средними. Чтобы получить истинную теплоемкость, надо перейти к пределу бесконечно малых величин. Например для массовой теплоемкости получим:
 . (19)
. (19)
Количество теплоты Q не имеет полного дифференциала, поэтому здесь использовано обозначение d’Q. Теплоемкость, как и количество теплоты, есть функция процесса, т. е. будет различной для изобарного, изохорного и изотермического процессов. Поэтому более общая запись величины удельной теплоемкости имеет вид:
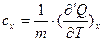 , (20)
, (20)
где х – параметр, остающийся в данном процессе постоянным.
Для изобарного процесса удельная теплоемкость при постоянном давлении:
 . (21)
. (21)
Для изохорного процесса удельная теплоемкость при постоянном объеме:
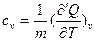 . (22)
. (22)
Для изотермического процесса:
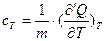 . (23)
. (23)
Отметим, что теплоемкость при постоянной температуре равна бесконечности (сТ = ∞), так как приращение температуры в этом случае равно нулю.