рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Практичне використання найпоширеніших хроматографічних методів (на самостійне опрацювання).
Реферат Курсовая Конспект
Практичне використання найпоширеніших хроматографічних методів (на самостійне опрацювання).
Практичне використання найпоширеніших хроматографічних методів (на самостійне опрацювання). - раздел Философия, Тема 1. Введення в фізико-хімічні методи аналізу Хроматографічні Методи На Сучасному Етапі Використовуються Спеціалістами В Рі...
Хроматографічні методи на сучасному етапі використовуються спеціалістами в різноманітних сферах науки та промисловості, зокрема, в таких як медицина, біологія, фізика, геологія, біотехнологія, хімічна та фармацевтична промисловість тощо.
Застосування хроматографічних методів для розділення білків мало величезний вплив на розвиток сучасної біохімії, фармацевтики, криміналістики, терапевтичного моніторингу у зв'язку із зростанням нелегального вживання наркотиків, ідентифікації антибіотиків, допінг-контролю, аналізу найбільш важливих класів пестицидів.
Найширше застосування для аналізу органічних речовин дістала газова хроматографія (газоадсорбційна і газорідинно-розподільна, колонкова, проявного типу). За її допомогою виконується біля 50 % всіх хроматографічних аналізів.
Області використання газової (ГХ) та рідинної (РХ) хроматографії суттєво відрізняються. У цілому, ГХ використовують для розділення летких матеріалів, а РХ – для нелетких рідин та твердих матеріалів. Однак існують деякі компоненти, які можуть бути розділені за допомогою обох методик, і, що більш важливо, багато нелетких субстанцій, таких як амінокислоти, стероїди та високомолекулярні жирні кислоти, які можуть бути розділені за допомогою ГХ. Капілярні колонки для ГХ набагато ефективніші, ніж їх РХ аналоги, а тому вони можуть забезпечити розділення мультикомпонентних сумішей, таких як ефірні олії. З іншого боку, тільки РХ використовують для розділення пептидів, поліпептидів, протеїнів та інших великих біополімерів, які мають біо-технологічну значимість.
Газову хроматографію використовують в багатьох медичних галузях: у гігієні та екології для визначення вмісту шкідливих домішок у повітрі, воді та харчових продуктах; у токсикології та судовій медицині для виявлення отруєнь технічними рідинами та пестицидами різноманітної структури; у фармакології – для контролю якості препаратів, дослідження метаболізму лікарських речовин. За допомогою ГХ визначають склад ліпідів крові, який є передумовою профілактики та лікування атеросклерозу та ішемічної хвороби серця; визначають спектр карбонових кислот циклу Кребса, що дозволяє розкрити особливості внутріклітинного метаболізму при різних патологічних процесах. Методом ГХ визначають підвищений вміст ацетону, гептанолу-2 та інших кетонів при цукровому діабеті, розроблено методи визначення катехоламінів (адреналіну та норадренліну) і споріднених сполук, гормонів щитоподібної залози, надниркових залоз. У медичній мікробіології використовують методи диференціації бактерій за їх жирнокислотними профілями, визначеними у ГХ. ГРХ та ГАХ широко використовують для визначення деяких фізико-хімічних характеристик речовин (константа розподілу, константа комплексоутворення, теплота розчинення, коефіцієнти активності, ізотерми та енергія адсорбції, енергії водневих зв’язків, тощо), а також для вимірювання кінетики хімічних реакцій.
Рідинна хроматографія використовується для розділення високополярних речовин та речовин з великою молекулярною вагою, що нелеткі та не можуть бути розділені за допомогою ГХ. РХ є одним з найважливіших методів досліджень у хімії, біології, біохімії, медицині та біотехнології.
Лігандообмінна РХ є найбільш ефективною для розділення ізомерів. Загальноприйнятим підходом до розподілу пептидів вважають рідинну гель-хроматографію. Метод адсорбції у завислому шарі широко використовується в біотехнологічній промисловості для очистки продуктів синтезу (секреції) мікроорганізмів, ендоплазматичних продуктів, периплазматичних продуктів та продуктів із тілець включень. РХ використовують для аналізу, розділення, отримання та очистки амінокислот, пептидів білків, ферментів, нуклеотидів, вуглеводів, ліпідів, гормонів, тощо; вивчення процесів метаболізму лікарських речовин у живих організмах; аналізу продуктів хімічного та нафтохімічного синтезу; вивчення ізотерм сорбції з розчинів, кінетики та селективності хімічних процесів. У хімії високомолекулярних сполук та виробництві полімерів РХ використовують для контролю, аналізуючи якість мономерів, вивчаючи молекулярно-масове розподілу та розподілу за типами функціональності олігомерів та полімерів. Знайшла використання РХ також у парфумерній та харчовій промисловості, криміналістиці та екології.
Таким чином, хроматографія – один з найпотужніших аналітичних методів. Лише за один крок він допомагає розділити багатокомпонентні суміші на окремі компоненти та одночасно дає кількісну характеристику кожного компоненту.
Більше 10 робіт, виконаних із застосуванням хроматографічних методів, було удостоєно Нобелівських премій.
5. Сорбція та розподіл молекул між фазами
5.1. Сили міжмолекулярної взаємодії.
Як вже говорилось, розділення компонентів суміші на хроматографічній колонці зумовлене їх різним утримуванням у нерухомій фазі. Молекули утримуються в результаті дії міжмолекулярних сил притягання або так званих сил Ван-дер-Ваальса, які мають електростатичну природу та виникають між сорбентом і сорбатом. Речовину, яка поглинає (сорбує) компоненти, називають сорбентом, а яка поглинається з газової або рідкої фази – сорбатом. Сорбент у хроматографії використовується як нерухома фаза.
Енергія взаємодії між молекулами сорбату та частинками сорбенту складається з енергій орієнтаційних, індукційних і дисперсійних сил. У багатьох випадках сорбція зумовлена також силами специфічної взаємодії –виникненням водневого або донорно-акцепторного зв'язку.
Орієнтаційна взаємодія виникає між полярними молекулами, які мають сталий дипольний момент. Взаємодія двох таких диполів зумовлює взаємне притягання молекул. Наприклад, у разі адсорбції полярних молекул хлористого метилу на полярному сорбенті – кремнеземі, вагомий внесок у міжмолекулярну взаємодію роблять орієнтаційні сили.
Індукційна взаємодія має місце між полярною і неполярною молекулами. При їх зближенні в неполярній молекулі виникає так званий індукційний диполь і в результаті відбувається взаємодія між індукційним і сталим диполями, що призводить до взаємного електростатичного притягання молекул. Така взаємодія відбувається, наприклад, при адсорбції неполярних молекул алканів на полярному сорбенті – оксиді алюмінію.
Дисперсійна взаємодія виникає між різними молекулами, незалежно від їх полярності. Однак більш вагомий внесок в енергію міжмолекулярної взаємодії сили дисперсії роблять у разі взаємного притягання неполярних молекул. Дисперсійна взаємодія зумовлена міграцією електронної густини в атомі (молекулі) внаслідок безперервного руху електронів. Тому навіть у неполярних молекулах, які за своєю будовою є також системою заряджених частинок – протонів та електронів, виникають короткочасні миттєві дипольні моменти. Електростатична взаємодія таких диполів спричинює міжатомне (міжмолекулярне) притягання, наприклад, у разі адсорбції неполярних молекул хлору на неполярному вуглецевому адсорбенті.
Водневий зв'язок виникає при взаємодії електропозитивних атомів водню, наприклад, тих, що входять до складу гідроксильної групи, з електронегативними атомами, в основному азоту, кисню та фтору. Водневий зв'язок у міжфазовій взаємодії сорбент-сорбат може утворюватись зокрема тоді, коли сорбентом є речовина, на поверхні якої знаходяться хімічно зв'язані гідроксильні групи, а до складу молекул сорбату входять електронодонорні атоми. Наприклад, метанол, піридин та інші електронодонорні молекули добре сорбуються на поверхні гідратованого кремнезему, який містить зв'язані гідроксильні групи.
Донорно-анкцепторний (координаційний) зв'язок виникає між атомами, один з яких має вільну електронну пару, наприклад, атом кисню в молекулі води або атом азоту в молекулі ацетонітрилу, а другий – вільні атомні орбіталі, наприклад, d-орбіталі силіцію в кремнеземі. Виникнення донорно- акцепторного зв'язку зумовлене передачею електронної пари із заповненої орбіталі одного атома (донора) на вакантну орбіталь іншого (акцептора) з утворенням спільної зв'язувальної орбіталі. Особливо сприятливі умови для виникнення донорно-акцепторних зв'язків створюються при адсорбції іонів d-елементів на адсорбентах з іммобілізованими або хімічно закріпленими на їх поверхні органічними реагентами, до складу яких входять електронодонорні атоми.
Однією з найпоширеніших теорій, що пояснює адсорбцію молекул газу на поверхні твердого тіла, є теорія Ленгмюра. Згідно теорії Ленгмюра на поверхні адсорбента знаходиться силове поле, яке здатне притягувати молекули іншої речовини і утворювати мономолекулярний шар адсорбованих молекул. Утримання поверхневих атомів чи молекул здійснюється або фізичними вандерваальсовими силами міжмолекулярної взаємодії або хімічними – утворенням поверхневих сполук. Між поверхнею адсорбента і середовищем встановлюється рухома адсорбційна рівновага, яка визначається рівністю швидкостей адсорбції і десорбції молекул.
5.2. Адсорбція. Адсорбція – це процес поглинання молекул із газового або рідкого середовища поверхнею (зовнішньою і внутрішньою) твердої речовини.
Речовину, на поверхні якої відбувається концентрування іншої речовини, називають адсорбентом, а яка вилучається з газової або рідкої фази і утримується на поверхні – адсорбатом.
Адсорбція відбувається в результаті дії міжмолекулярних сил притягання. Взаємодія за рахунок слабких сил Ван-дер-Ваальса та водневого зв'язку призводить до фізичної адсорбції, яка не впливає на стан поверхні асдорбенту. В разі фізичної адсорбції речовини елюються придатною рухомою фазою без їх руйнування. Якщо під час адсорбції на поверхні утворюються поверхневі хімічні сполуки, які за властивостями відрізняються від аналогічних об'ємних сполук, то адсорбцію називають хімічною. Елюювання в цьому разі може призвести до руйнування початкових сполук.
Фізична суть явища адсорбції:на поверхні адсорбенту діють поверхневі сили і при контакті компонентів аналізованої проби з поверхнею адсорбенту молекули всіх сполук, що знаходяться в пробі, утворюють адсорбційні зв'язки, міцність яких обумовлена природою (властивостями) молекул даного сорту. Оскільки природа розділюваних молекул різна, різної буде і міцність утворених ними адсорбційних зв'язків При цьому вже при введенні проби має місце конкуренція компонентів, що входять до її складу, за адсорбційні центри. Це призводить до того, що вже у верхньому шарі адсорбенту молекули з більшою сорбційною здатністю будуть витісняти слабкіше адсорбовані молекули. Таким чином, вже в процесі введення проби її компоненти розташуються по висоті колонки у відповідності з величинами їх сорбційної здатності. Додавання рухомого розчинника призводить до руйнування утворених адсорбційних зв'язків, оскільки концентрація рухомого розчинника у багато разів більше концентрації компонентів в пробі, і за законом діючих мас адсорбційна рівновага зсувається в бік інтенсивного протікання процесу десорбції цих компонентів з поверхні адсорбенту і переходу їх у рухомий розчинник.
При цьому, оскільки швидкість десорбції пов'язана з величиною міцності адсорбційних зв'язків, ті молекули, які утворюють дуже слабкі адсорбційні зв'язки, досить швидко переходять у рухомий розчинник, а молекули, що утворюють досить міцні адсорбційні зв'язку характеризуються меншою швидкістю переходу в рухливий розчинник. Десорбовані молекули переносяться рухомим розчинником вниз по колонці, і знову адсорбуються з рухомого розчинника на поверхні нових зерен адсорбенту, і потім знову десорбуються під дією нових молекул рухомого розчинника.
Таким чином, у міру пропускання рухомого розчинника в об’ємі колонки дуже велике число разів (тисячі, десятки тисяч) повторюється один і той же процес – процес адсорбції молекул суміші, що розділяється на поверхні адсорбенту і їх десорбції в рухливий розчинник, і, внаслідок багаторазового повторення цього процесу, ті компоненти, які утворюють менш міцні адсорбційні зв'язки переміщаються по колонці з більшою швидкістю, ніж компоненти, що утворюють більш міцні адсорбційні зв'язки, результатом чого і є розділення суміші на окремо розташовані по висоті колонки зони, відповідні індивідуальним компонентам аналізованої суміші.
Слід зазначити, що взаємодія між адсорбентом та адсорбатом має переважно кооперативний характер і найвагоміший внесок різних сил адсорбції в загальний процес розподілу речовин між фазами залежить від хімічної природи взаємодіючих компонентів адсорбційної системи.
Адсорбція речовин при досягненні стану міжфазової рівноваги залежить
від:
· температури;
· хімічної природи (спорідненості до сорбенту) і концентрації або тиску газу адсорбату;
· хімічної природи, структури та площі поверхні адсорбенту.
Як правило, адсорбція – процес екзотермічний, тому з підвищенням температури величина адсорбції зменшується. Чим більша площа поверхні адсорбенту, а також концентрація адсорбату, тим більша величина адсорбції. Отже, змінювати час утримування речовини у колонці можна, змінюючи температуру і пористість адсорбенту.
Проявлення спорідненості до сорбенту особливо помітне при адсорбції кількох речовин, оскільки можливим є витіснення одних сорбованих речовин іншими, які мають більшу спорідненість, хоча, можливо, й меншу концентрацію.
5.3. Ізотерма адсорбції. Для адсорбента певної маси кількість адсорбованої речовини залежить від концентрації (чи парціального тиску) речовини, що адсорбується. Чим вища концентрація чи парціальний тиск речовини, тим більше її адсорбується. Залежність кількості речовини, адсорбованої з газуватої або рідкої фази (Ca), від її концентрації в розчині (С) у стані рівноваги за сталої температури називають ізотермою адсорбції.
Загальне рівняння, що описує ізотерму, таке: Ca=f(С). Основні типи ізотерм адсорбції наведено на рис. 3.
 С
С
Рис. 3. Основні типи ізотерм адсорбції: 1– випукла, ізотерма Ленгмюра (l –тип); 2 – iзотерма Генрі (прямолінійна); 3 – увігнута, ізотерма Фрейндліха; 4 – s-подібна; 5 – Η-тип (хемосорбція)
В ідеальному випадку (при малих парціальних тисках і відсутності взаємодії між компонентами суміші) ізотерма адсорбції має лінійну форму й описується рівнянням Ca=DC, де D – коефіцієнт розподілу речовини, за допомогою якого можна кількісно описати ступінь розподілу речовини між двома фазами у стані рівноваги. Коефіцієнт розподілу знаходять у статичних умовах і обчислюють за формулою:
 (7.1.)
(7.1.)
де Ca – концентрація речовини у твердій нерухомій фазі у стані рівноваги, моль/кг (ммоль/г); C – концентрація речовини у рухомій фазі у стані рівноваги, моль/л.
Коефіцієнт розподілу речовини між двома фазами, одна з яких тверда, має розмірність л/кг або мл/г. Він залежить від хімічної природи адсорбенту та адсорбату і від температури.
Відповідно до теорії Ленгмюра, кожна елементарна частинка поверхні адсорбенту (активний центр) поглинає тільки одну молекулу адсорбату, внаслідок чого поверхня адсорбенту заповнюється мономолекулярним шаром адсорбату. Адсорбовані молекули через деякий період часу залишають поверхню, тобто десорбуються. Кількість молекул, які адсорбуються (десорбуються) за одиницю часу, віднесену до одиниці поверхні, називають швидкістю адсорбції (десорбції). Швидкість адсорбції зростає зі збільшенням концентрації адсорбату.
У стані адсорбційної рівноваги швидкість адсорбції Uадс. дорівнює швидкості десорбції Uдес:
Uадс.=K1С(1-θ), Uдес.= K2θ,
K1С(1-θ)= K2θ, (7.2.)
де K1, K2 – константи швидкості відповідно адсорбції й десорбції; C – рівноважна концентрація адсорбату, моль/л; θ – частка зайнятих молекулами адсорбату центрів адсорбції на поверхні адсорбенту.
Розв'язавши рівняння (7.2) відносно θ, отримаємо рівняння ізотерми адсорбції Ленгмюра:
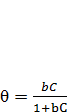 , (2.3.)
, (2.3.)
де  – константа, що залежить від температури і характеризує взаємодію адсорбату й адсорбенту, або так звану поверхневу активність адсорбенту.
– константа, що залежить від температури і характеризує взаємодію адсорбату й адсорбенту, або так звану поверхневу активність адсорбенту.
Позначимо максимальне число активних центрів адсорбенту, які можуть бути зайняті молекулами адсорбату, через а∞. Тоді Сa= а∞ і рівняння (7.3) перетвориться на рівняння випуклої ізотерми адсорбції, яку зображено на рис. 3 (крива 1):
і рівняння (7.3) перетвориться на рівняння випуклої ізотерми адсорбції, яку зображено на рис. 3 (крива 1):
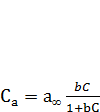 , (2.4)
, (2.4)
За малих рівноважних концентрацій адсорбату величина Ca пропорційна концентрації С, що відповідає рівнянню ізотерми адсорбції Генрі, яка має лінійний характер (рис. 3, крива 2):
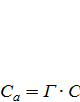 , (2.5)
, (2.5)
де Г– коефіцієнт Γенрі (коефіцієнт розподілу для твердої нерухомої фази).
Коефіцієнт Генрі не залежить від концентрації адсорбату і є сталою величиною за сталої температури. Речовини, які краще адсорбуються на певному адсорбенті, мають більші значення коефіцієнта Генрі.
При збільшенні спорідненості матеріалу сорбента і речовини Г зростає, а при збільшенні температури – зменшується. Отже, при розділенні суміші речовин першою з колонки елююватиметься речовина, яка має найменший коефіцієнт розподілу, останньою – речовина, яка має найбільший коефіцієнт розподілу.
Хоча рівняння Ленгмюра було отримане теоретично, воно дає змогу за малих концентрацій за лінійною залежністю (7.5) знайти коефіцієнт розподілу, а за високих, коли спостерігається насичення моношару, – максимальну ємність адсорбента а∞.
У деяких випадках ізотерми адсорбції мають іншу форму – увігнуту (ізотерма Фрейндліха) або S-подібну (рис. 3, криві 3, 4), що зумовлено утворенням на поверхні адсорбенту полімолекулярного шару адсорбату. Однак за малих концентрацій речовин, які сорбуються, ця ізотерма адсорбції близька до лінійної залежності й сорбційна здатність різних речовин адекватна величині коефіцієнта Генрі. Ізотерми Η-типу (рис. 3, крива 5) характерні для хемосорбції. У цьому разі на поверхні адсорбенту утворюється нова хімічна сполука, наприклад, при сорбції іонів металів на адсорбентах, модифікованих органічними комплексоутворювальними реагентами.
При врахуванні взаємодії між молекулами суміші спостерігається відхилення від лінійності як негативне (крива 2), так і позитивне (крива 3).
Форма ізотерм адсорбції, їх взаємне розміщення дає уяву про характер розподілу речовин в колонці і дозволяє вибрати умови адсорбційного хроматографічного розділення суміші. На явищі адсорбції грунтується промисловий процес адсорбційного розділення речовин.
5.4. Абсорбція. Абсорбція (розподіл) – це процес поглинання речовини з рідкої або газової фази усім об'ємом твердого тіла або рідиною. Речовину, яка поглинає (абсорбує) компоненти, називають абсорбентом, а яка поглинається з газової або рідкої фази – абсорбатом.
При контакті рідкої фази, яка містить розчинену речовину, з іншою рідкою фазою, що не змішується з першою і в якій цієї речовини немає, відбувається перехід речовини з однієї фази в іншу. Процес розподілу триває доти, доки відношення концентрації речовини в обох фазах не досягне сталої величини, яка залежить від хімічної природи обох фаз (розчинників) та природи речовини, що розподіляється між ними. Відповідно до закону розподілу Нернста, за сталої температурі у стані рівноваги відношення концентрацій речовини у рідких фазах, які не змішуються між собою, є величиною сталою:
 , (7.6)
, (7.6)
 де C1 і C2 – концентрація речовини у фазах, моль/л; D – коефіцієнт розподілу (безрозмірна величина).
де C1 і C2 – концентрація речовини у фазах, моль/л; D – коефіцієнт розподілу (безрозмірна величина).
Рис. 4. Розподіл розчиненої речовини між двома рідинами, які не змішуються.
Коефіцієнт розподілу не залежить від концентрації речовини, яка розподіляється між двома рідкими фазами, за умови однакового її молекулярного стану в обох фазах. Не залежить він також від об'ємів контактуючих фаз.
Розподіл розчиненої речовини між рухомою газовою і нерухомою рідкою фазами здійснюється за рахунок процесу розчинення і випаровування газу, що є компонентом аналізованої суміші, рідкою плівкою, розподіленою тонким шаром по поверхні твердого носія – газорідинно-розподільна хроматографія.
На цьому явищі грунтуються промислові процеси виділення і розділення - абсорбція і ректифікація.
Розподіл розчиненої речовини між двома рідкими фазами, які не змішуються між собою – рухомим і нерухомим розчинником, лежить в основі рідинно-розподільної або екстракційної хроматографії. Найбільша швидкість руху в колонці спостерігається у компонента суміші з найменшим коефіцієнтом розподілу між розчинниками. На принципі розподілу грунтується промисловий процес виділення і розділення компонентів – екстракція.
Зіставлення рівнянь (7.5) і (7.6) засвідчує, що коефіцієнти Г і D характеризують один і той самий рівноважний стан розподілу речовини між двома фазами, а тому залежність С2=f(С1) аналогічна рівнянню (7.5) лінійної ізотерми адсорбції Генрі.
Утримування речовин у рідкій нерухомій фазі відбувається за рахунок сил міжмолекулярної взаємодії.
– Конец работы –
Эта тема принадлежит разделу:
Тема 1. Введення в фізико-хімічні методи аналізу
ТЕМА РЕФРАКТОМЕТРИЧНИЙ МЕТОД АНАЛІЗУ... Метод що рунтується на вимірюванні показника заломлення називається рефрактометричним...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Практичне використання найпоширеніших хроматографічних методів (на самостійне опрацювання).
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов