БЕЛКИ, ИХ СТРОЕНИЕ И ФУНКЦИИ
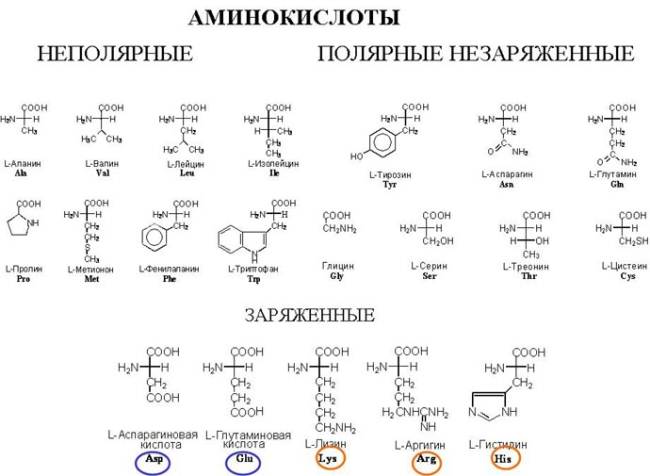
Белки входят в состав всех растительных и животных тканей. В клетках и тканях встречаются более 170 различных аминокислот. В составе белков обнаруживается лишь 26 из них. Обычными компонентами белка можно считать лишь 20 (магические аминокислоты). Белки состоят из углерода, водорода, кислорода, азота. Некоторые содержат серу, железо, цинк, медь. Растения синтезируют все необходимые им аминокислоты из более простых веществ. В отличие от них животные не могут синтезировать все аминокислоты, в которых они нуждаются. Часть аминокислот они должны получать в готовом виде, т.е. с пищей. Их называют незаменимыми. Остальные называются заменимыми.
| Незаменимые аминокислоты | Заменимые аминокислоты |
| Аргинин Гистидин Валин Лизин Треонин Лейцин Изолейцин Триптофан Фенилаланин Метионин | Аланин Аспарагин Аспарагиновая кислота Глутамин Глутаминовая кислота Глицин Пролин Серин Тирозин Цистеин |
Все известные аминокислоты различаются между собой только радикалами. Радикалы содержат серу, азот, кольцевые структуры и т.д. Белки – это сложные высокомолекулярные соединения, построенные из α – аминокислот.

В белках аминокислоты соединены между собой пептидными связями. Образование пептидной связи происходит в результате взаимодействия карбоксильной группы одной аминокислоты с аминогруппой другой с выделением одной молекулы воды.
При связывании от 2 до 100 аминокислотных остатков говорят о пептидах (до 10 аминокислот – олигопептиды), при большей степени полимеризации говорят о протеинах.
Протеины и белки – одно и то же, но пептиды в основном выполняют регуляторные функции: например, гормоны.
Различают простые белки – протеины, состоящие только из аминокислот, и сложные белки – протеиды, в состав которых кроме протеина входят и непротеиновые соединения.
Простые белки (протеины) подразделяют по их структуре и растворимости. Среди них выделяют глобулярные (сферопротеины) и фибриллярные белки (склеропротеины).
Глобулярные белки имеют сферическую форму (глобула) или стремятся к ней. Они хорошо растворяются в воде. Основная масса белков относится к глобулярным. Их функции разнообразны. Это большинство протеинов плазмы, ферменты.
Фибриллярные белки обычно нитевидные или винтообразные, плохо растворимы в воде. Их немного, они выполняют в организме защитную, опорную, строительную функции.
Сложные белки различают и называют по небелковым соединениям, входящим в состав протеидов. Например, липопротеиды, гликопротеиды, нуклеопротеиды, металлопротеиды, хромопротеиды.
Многообразие протеинов определяется многообразием их структурных форм. Различают четыре уровня организации протеинов.
Первичная структура. Определяется последовательностью аминокислот в полипептидной цепи, т.е. химическая структура белка – последовательность аминокислот в полипептидной цепи. Химические, морфологические, функциональные свойства клеток зависят от содержания в них специфических белков. Специфичность белков определяется набором аминокислот, их количеством и последовательностью расположения в полипептидной цепочке. Замена одной единственной аминокислоты в составе молекулы белка или изменение последовательности их расположения приводит к изменению его функции. Этим достигается разнообразие первичной структуры белковой молекулы.
Вторичная структура. Это α – спираль или β- структура. С помощью различных физических методов было обнаружено, что чаще всего полипептидная цепь закручивается в спираль и стабилизируется водородными связями. Молекула напоминает растянутую пружину. Это α- спираль. Водородные связи возникают между группами СО – и NН – и направлены параллельно длинной оси спирали. На один виток спирали приходится 3,6 аминокислотных остатка.
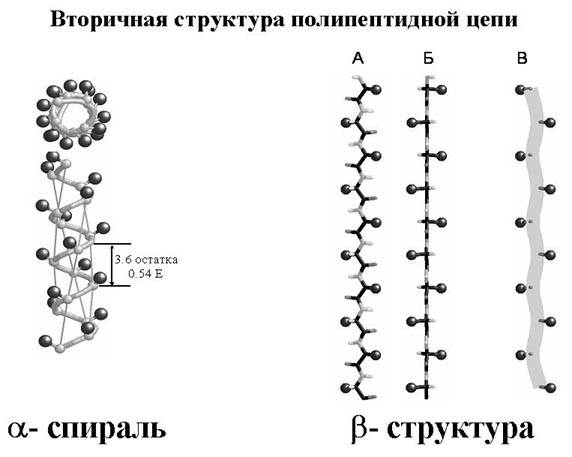
Например, кератин. Твердость и растяжимость зависят от числа дисульфидных мостиков между соседними полипептидными цепями. Фибриллярные белки имеют α – спиральную конформацию.
Существует другой тип вторичной структуры. Это β – структура. Представляет собой образования более вытянутые, чем α – спирали. Эти цепи уложены параллельно, но соседние цепи по своему направлению противоположны одна другой. Между параллельными цепями возникают водородные связи, в которых принимают участие группы С – О и N – Н.
Третичная структура. Реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль полипептидной цепи. В простейших случаях третичную структуру можно представить как спираль, которая свернута спиралью (глобула). Третичная структура поддерживается водородными, ионными, ковалентными, гидрофобными взаимодействиями.
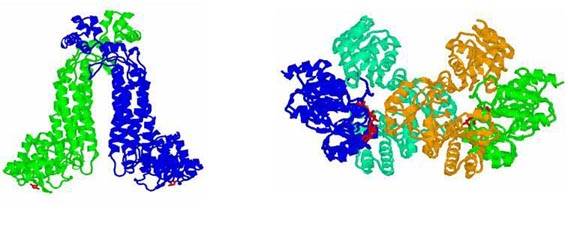
Четвертичная структура. Определяется тем, как располагаются друг относительно друга полипептидные цепи, образующие молекулу белка. Способ совместной упаковки и укладки этих полипептидных цепей называют четвертичной структурой белка. Например, гемоглобин – комплекс из четырех связанных между собой молекул. Только в такой форме он может присоединять и транспортировать кислород. Гемоглобин состоит из двух α – цепей и двух β – цепей. Эти полипептидные цепи удерживаются вместе за счет гидрофобных взаимодействий, водородных и ионных связей.