Параметры состояния системы
Техническая термодинамика изучает закономерности превращения энергии в процессах, происходящих в макроскопических системах, состоящих из большого числа частиц, и свойства тел, участвующих в этих превраще ниях.
Система - совокупность материальных тел, которые находятся в механи- ческом и тепловом взаимодействии друг с другом и с окружающей средой.
Открытая система - обменивается веществом и энергией в форме теплоты и работы с окружающей средой.
Закрытая система - не обменивается веществом, но обменивается энергией в форме теплоты и работы с окружающей средой.
Адиабатная система - не обменивается теплотой.
Изолированная система - не обменивается ни веществом, ни энергией.
Состояние системы описывается рядом величин, которые называются термодинамическими параметрами. Основные параметры - следующие.
Давление - p. Единица давления в системе СИ: 1Па=1Н/м2, производные единицы: 1 кПа = 1000 Па, 1 МПа = 106 Па, внесистемные единицы 1 бар = 105 Па = 750 мм рт. ст. = 10200 мм вод. ст.
Температура – T. Единица температуры в системе СИ - Кельвин (К), используется также градус Цельсия (оС), при этом T(К) = t (оС) + 273,15.
Удельный объем - v - объем системы, отнесенный к единице массы
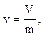 (1.1 )
(1.1 )
где V - объем системы (м3),
m - масса системы (кг),
v - удельный объем системы (м3/кг).
Удельный объем связан с плотностью простым соотношением:
 , (1.2 )
, (1.2 )
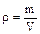 - плотность (кг/м3 ). (1.3 )
- плотность (кг/м3 ). (1.3 )
Нормальные физические условия соответствуют значениям параметров:
T = 273,15 К (= 0о С), p = 101325 Па (= 760 мм рт.ст.).
Если все термодинамические параметры одинаковы во всех точках системы и постоянны во времени, то такое состояние называется равновесным.
1.1.2. Уравнение состояния
Для равновесной системы существует связь между параметрами состояния, которая называется уравнением состояния. Наиболее простой вид имеет уравнение состояния для идеального газа, у которого отсутствуют силы взаимодействия между молекулами, а объем, занимаемый молекулами, пренебрежимо мал по сравнению с объемом системы.
Уравнение состояния для 1 кг идеального газа и для произвольной массы идеального газа имеет вид:
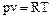 ,
, 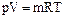 , (1.4 )
, (1.4 )
где p– давление (Па),
T– температура (К ),
v - удельный объем (м3 / кг),
V– полный объем (м3 ),
m - масса (кг),
R– газовая постоянная для данного газа (Дж /кг.К ).
Для 1 кмоль газа уравнение состояния имеет вид:

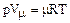 , (1.5 )
, (1.5 )
где 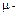 молярная масса газа (кг / кмоль),
молярная масса газа (кг / кмоль),
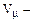 молярный объем газа (м3 / кмоль).
молярный объем газа (м3 / кмоль).
Так как молярные объемы разных газов в идеальном состоянии одинаковы, то произведение 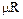 не зависит от природы газа, т.е.
не зависит от природы газа, т.е.
 8314 Дж / кмоль.К. (1.6 )
8314 Дж / кмоль.К. (1.6 )
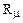 называется универсальной газовой постоянной.
называется универсальной газовой постоянной.
Количество вещества связано с его массой и объемом (для газов) соотношением: 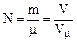 , (1.7 )
, (1.7 )
где 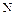 – количество вещества ( кмоль ).
– количество вещества ( кмоль ).
Отсюда следуют производные соотношения:
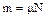 , (1.8 )
, (1.8 )
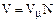 .
.  (1.9 )
(1.9 )
Подставляя (1.9) в (1.4 ), получаем еще один вид уравнения состояния для произвольного количества газа:
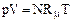 . (1.10 )
. (1.10 )
Следует добавить, что молярный объем любого газа при нормальных физических условиях составляет 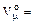 22.4 м3/кмоль.
22.4 м3/кмоль.
Если газ движется по трубопроводу, то уравнение состояния можно отнести к единице времени: 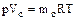 , (1.11 )
, (1.11 )
где 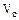 – объемный расход газа (м3/с),
– объемный расход газа (м3/с),
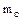 – массовый расход газа (кг/с).
– массовый расход газа (кг/с).