Теплоемкость газов
Под теплоемкостью газа (удельной теплоемкостью) понимают количество тепла, необходимое для нагревания количественной единицы газа (1 кг, 1м3, 1 киломоль) на 10С (или 1 К). В соответствии с этим различают теплоемкость массовую, объемную и мольную.
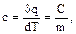
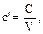
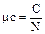 , (1.35)
, (1.35)
где 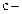 удельная массовая теплоемкость (Дж/кг.К, кДж/кг.К),
удельная массовая теплоемкость (Дж/кг.К, кДж/кг.К),
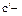 удельная объемная теплоемкость (Дж/м3.К, кДж/м3.К),
удельная объемная теплоемкость (Дж/м3.К, кДж/м3.К),
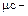 мольная теплоемкость (Дж/кмоль.К, кДж/кмоль.К).
мольная теплоемкость (Дж/кмоль.К, кДж/кмоль.К).
При этом имеют место соотношения:
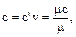
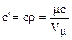 . (1.36)
. (1.36)
Величина теплоемкости зависит от рода газа, его температуры, давления и условий нагрева газа.
Теплоемкость газовой смеси определяется через теплоемкости компонентов:
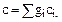
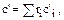
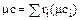 (1.37)
(1.37)
Теплоемкость, как и теплота процесса, зависит от характера процесса, что обозначается индексом процесса 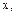 например:
например: 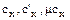
Чаще всего используется теплоемкость при постоянном объеме - 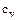 и теплоемкость при постоянном давлении -
и теплоемкость при постоянном давлении -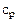 .
.
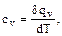
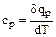 (1.38)
(1.38)
Из (1.26) при 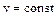 получаем
получаем 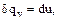 а из (1.29) при
а из (1.29) при 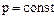 получаем
получаем 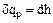 . Отсюда:
. Отсюда:
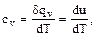
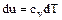 . (1.39)
. (1.39)
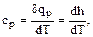
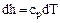 . (1.40)
. (1.40)
Для идеального газа изобарная и изохорная теплоемкости связаны между собой уравнением Майера:
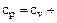
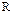 . (1.41)
. (1.41)
Отношение изобарной теплоемкости и изохорной:
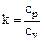 . (1.42)
. (1.42)
В классической теории теплоемкости теплоемкость идеальных газов не зависит от температуры и определяется числом степеней свободы поступа-тельного и вращательного движения молекул газа -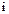 .
.
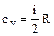 ,
, 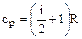 ,
, 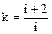 (1.43)
(1.43)
Для одноатомных газов 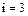
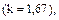 для двухатомных
для двухатомных 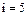
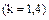 , для трехатомных
, для трехатомных 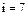
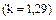
Однако теплоемкость реальных газов зависит от температуры, что объясняет квантовая теория теплоемкости, учитывающая колебательные степени свободы. Поэтому наряду с истинной теплоемкостью, определяемой по (1.35), вводится средняя теплоемкость в интервале температур от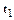 до
до 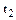 :
:
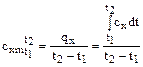 . (1.44)
. (1.44)
Значения истинной теплоемкости при заданной температуре 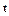 (оС) и средней теплоемкости в интервале температур от 0(оС) до
(оС) и средней теплоемкости в интервале температур от 0(оС) до 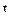 (оС) приводятся для различных газов в справочных таблицах.
(оС) приводятся для различных газов в справочных таблицах.
Количество теплоты, необходимой для нагревания газа от температуры 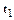 до температуры
до температуры 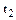 , определяется по формуле:
, определяется по формуле:
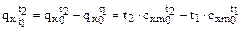 (1.45)
(1.45)