рефераты конспекты курсовые дипломные лекции шпоры
Реферат Курсовая Конспект
Ядерная модель атома Резерфорда.
Ядерная модель атома Резерфорда. - Лекция, раздел Философия, Лекция 16. Теория атома водорода по Бору. Элементы квантовой механики. План лекции 2. Постулаты Бора. Спектр атома водорода по Бору До Конца Xix В Науке Господствовало Убеждение, Что Атомы Являются Неделимыми ...
До конца XIX в науке господствовало убеждение, что атомы являются неделимыми частицами материи, "кирпичиками " мироздания.
Важнейшими событиями в науке, от которых берет начало атомная физика, были:
1) открытие электрона в 1897г.;
2) открытие явления радиоактивности.
эти открытия показали, что нейтральный атом является сложной системой электрически заряженных частиц; во всех атомах имеются электроны; положительный заряд связан с основной массой атома, но о распределении его внутри атома сведений не было.
Первые попытки создания модели атома на основе накопленных сведений принадлежат английскому физику Джозефу Томсону (1903г.).
В рамках этой модели положительный заряд считался равномерно распределенным в некотором небольшом объеме сферической формы, а электроны вкраплены в этот заряд подобно изюму в булочке.
Для выяснения характера распределения положительных и отрицательных зарядов в атоме было необходимо непосредственное опытное "зондирование" внутренних областей атома, которое осуществили сотрудники Резерфорда Гейгер и Мардсен с помощью 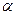 -частиц, наблюдая изменение направления их полета при прохождении через тонкие слои вещества.
-частиц, наблюдая изменение направления их полета при прохождении через тонкие слои вещества. 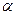 - частицы представляют собой дважды ионизированные атомы гелия:
- частицы представляют собой дважды ионизированные атомы гелия:
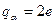 , где
, где 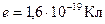 ,
, 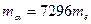 ,
, 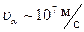 .
.
Они выбрасываются с огромной скоростью некоторыми веществами при радиоактивном распаде. В качестве мишени использовалась золотая фольга, толщина которой соответствовала ~400 атомам, так что соударения 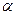 - частиц с атомами золота можно было условно считать единичными.
- частиц с атомами золота можно было условно считать единичными.
Результаты опыта:
1) подавляющее число 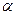 - частиц отклоняется на малые углы;
- частиц отклоняется на малые углы;
2) примерно одна из 2·104 частиц отклоняется на угол 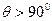 ;
;
3) некоторые частицы отклоняются на угол 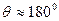 .
.
На основании этих результатов Резерфорд пришел к выводу, что сильные отклонения 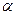 - частиц возможны только если внутри атома имеется заряд, связанный с массой, сконцентрированной в очень малом объеме. В 1911г. Резерфорд предложил ядерную модель атома (рис. 1).
- частиц возможны только если внутри атома имеется заряд, связанный с массой, сконцентрированной в очень малом объеме. В 1911г. Резерфорд предложил ядерную модель атома (рис. 1).
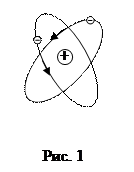 Согласно Резерфорду, атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом
Согласно Резерфорду, атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом 
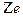 размером ~ 10-14 м, вокруг которого по орбитам движутся
размером ~ 10-14 м, вокруг которого по орбитам движутся 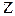 электронов.
электронов.
Модель Резерфорда явилась существенным шагом вперед, поскольку представляла атом как динамическую систему движущихся электрических зарядов. Однако она оказалась неустойчивой с точки зрения классической электродинамики и противоречила опытным данным: вращающийся по орбите электрон должен изучать эл.м. волны (как заряд, движущейся с центростремительным ускорением) с частотой , равной частоте его вращения, терять энергию, приближаясь к ядру и увеличивая частоту вращения и, в конце концов, упасть на ядро. Т.о. за 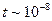 с атом должен перестать существовать и спектр его излучения должен быть сплошным. Однако атом – устойчивое образование, а спектр атома – линейчатый.
с атом должен перестать существовать и спектр его излучения должен быть сплошным. Однако атом – устойчивое образование, а спектр атома – линейчатый.
Ядерная модель атома в сочетании с классической физикой и электродинамикой оказалась неспособной объяснить устойчивость атомов и характер атомных спектров. Выход из создавшегося тупика был предложен в 1913г. учеником Резерфорда датским ученым физиком Нильсом Бором. Он сохранил ядерную модель атома Резерфорда, наделив её новыми квантовыми свойствами, согласно которым электрон мог бы, вращаясь вокруг ядра, испускать свет и не падать на ядро. Для этого Бору пришлось ввести предположения, противоречащие классической механике и электродинамике, доказать которые он был не в состоянии и назвал их постулатами.
– Конец работы –
Эта тема принадлежит разделу:
Лекция 16. Теория атома водорода по Бору. Элементы квантовой механики. План лекции 2. Постулаты Бора. Спектр атома водорода по Бору
гл... План лекции... Ядерная модель атома Резерфорда Постулаты Бора Спектр атома водорода по Бору...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Ядерная модель атома Резерфорда.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов