Постулаты Бора. Спектр атома водорода по Бору.
1. электроны в атоме движутся по строго определенным стационарным орбитам, не излучая и не поглощая при этом энергии.
 , (
, (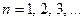 ),
),
где 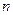 - номер орбиты;
- номер орбиты; 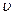 - скорость электрона;
- скорость электрона;  - радиус орбиты;
- радиус орбиты; 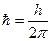 .
.
2. При переходе электрона с одной орбиты на другую атом излучает или поглощает энергию
 ,
,
где 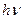 - энергия фотона;
- энергия фотона; 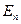 и
и 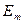 - энергии электрона на соответствующих орбитах.
- энергии электрона на соответствующих орбитах.
Постулаты Бора позволили ему теоретически рассчитать энергетический спектр атома водорода и водородоподобных атомов – атомов, состоящих из ядра с зарядом 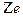 и одного электрона, движущегося вокруг ядра.
и одного электрона, движущегося вокруг ядра.
Можно доказать, что энергия электрона может принимать только определенные дискретные значения:
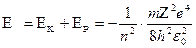 (n=1,2,3,….),
(n=1,2,3,….),
где 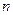 - номер стационарной орбиты, а знак минус означает, что электрон находится в связанном состоянии.
- номер стационарной орбиты, а знак минус означает, что электрон находится в связанном состоянии.
Из полученного выражения видно, что полная энергия электрона в водородоподобном атоме отрицательна и зависит от номера орбиты, по которой движется электрон, т.е. может принимать только дискретные значения.
При n=1 
Т.к. полная энергия отрицательна, то чем меньше её абсолютное значение, тем больше значение полной энергии. Следовательно, с ростом n энергия увеличивается.
При 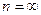
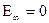 .
.
это и есть максимальное значение энергии системы, состоящей из ядра и одного электрона. Если электрону сообщить извне порцию энергии 13,55 эВ, то он уйдет с первой орбиты за пределы атома, а атом превратится в положительный ион. этот процесс отщепления электрона от атома называется ионизацией. Ионизация – это отщепление электронов от атомов, приводящее к образованию положительных ионов.
Величину энергии электрона в атоме часто отождествляют с энергией атома. Все возможные значения энергии атома, которыми он может обладать, называют энергетическими уровнями. Энергетические уровни атома изображают в виде горизонтальных прямых, расположенных друг относительно друга на расстояниях, пропорциональных разности энергий атома. Самая низшая прямая соответствует нормальному состоянию атома.
Используя теорию Бора и схему энергетических уровней атома, легко объяснить процессы испускания и поглощения излучения атомом.
Чтобы атом получил возможность испускать свет, его нужно возбудить, т.е. перевести электрон на более высокий энергетический уровень (нагреванием, освещением и т.д.). В возбужденном состоянии атом неустойчив и через t~ 10-8 c переходит на более близкую к ядру орбиту, испуская квант электромагнитного излучения (фотон) с энергией 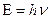 .
.
Согласно второму постулату Бора (для водорода  )
)
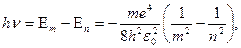
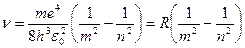 , (1)
, (1)
где  – постоянная Ридберга.
– постоянная Ридберга.
Исследования спектров излучения разряженных газов (т.е. отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр. Все обнаруженные серии в спектре атома водорода могут быть описаны одной эмпирической формулой , называемой обобщенной формулой Бальмера:
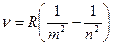 . (2)
. (2)
Для серии Лаймана (ультрафиолетовая область спектра) (рис. 2) m=1, n=2,3,4,…
Для серии Бальмера (видимая область спектра) m =2, n=3,4,5,…
Для серии Пашена (инфракрасная область спектра) m =3, n=4,5,6,…
Значения R в формулах (1) и (2) совпадают, что свидетельствует о правильности полученной Бором формулы (1).
 Теория Бора, на основе которой были рассмотрены спектры атома водорода и водородоподобных систем и вычислены частоты спектральных линий, не смогла объяснить интенсивности спектральных линий, вероятности возможных переходов и не позволила описать спектр атома гелия – одного из простейших атомов.
Теория Бора, на основе которой были рассмотрены спектры атома водорода и водородоподобных систем и вычислены частоты спектральных линий, не смогла объяснить интенсивности спектральных линий, вероятности возможных переходов и не позволила описать спектр атома гелия – одного из простейших атомов.
Все эти проблемы были решены в рамках квантовой механики.