рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Практикум З органічної хімії
Реферат Курсовая Конспект
Практикум З органічної хімії
Практикум З органічної хімії - раздел Философия, ...

О.І.Буря, Н.С. Гаюн
Практикум
З органічної хімії
Навчальний посібник
Дніпропетровськ
Видавництво “Наука і освіта”
УДК 546
ББК 24.2
Б 91
Рекомендовано
- науково-методичною радою Дніпропетровського державного аграрного університету як навчальний посібник (протокол № 8 від 23.06.2009 р.)
- вченою радою Дніпропетровського державного аграрного університету як навчальний посібник (протокол № 11 від 25.06.2009 р.)
Рецензенти:
О.В. Просяник, доктор хімічних наук, професор Українського державного
хіміко-технологічного університету
В.Ф. Варгалюк, доктор хімічних наук, професор Дніпропетровського національного університету
Л.Ю. Очеретенко, кандидат біологічних наук, доцент Уманського державного аграрного університету
Буря О.І., Гаюн Н.С.
Б 91 Практикум з органічної хімії: Навчальний посібник. – Дніпропетровськ: Видавництво “Наука і освіта”, 2009. – 161с.
Практикум містить близько 123 дослідів з головних розділів органічної хімії, підібраних згідно з навчальною програмою. До кожної лабораторної роботи наводяться вправи і задачі з номенклатури органічних сполук, методів їх отримання і властивостей, додаються контрольні запитання. Матеріал призначено для студентів, що навчаються за спеціальностями "Агрономія" та "Ветеринарна медицина".
ББК 24.2
ISBN Буря О.І., Гаюн Н.С.
Загальні правила
1. Працюючи в лабораторії, дотримуйтесь тиші, порядку, чистоти, раціонально будуйте свою роботу, проводьте її точно, акуратно, швидко, але без поспішності.
2. Не починайте досліду без дозволу викладача або лаборанта, під їх наглядом виконуйте досліди з особливо небезпечними речовинами (Br2, концентрованими кис-лотами тощо).
3. Не працюйте з брудним посудом, не залишайте його немитим.
4. Роботу з отруйними речовинами, горючими газами і парами проводьте у витяжній шафі.
5. Не виливайте в раковини залишки кислот, лугів, вогненебезпечних речовин тощо. Зливайте ці речовини в спеціальні склянки, розташовані у витяжній шафі.
6. Не плутайте пробки від склянок, які містять різні реактиви, щоб запобігти забрудненню останніх.
7. Виходячи з лабораторії, перевірте, чи вимкнули газ, воду, світло.
Запобіжні заходи
- концентровані кислоти, олеум і аміак розливати тільки за допомогою лійки і під тягою; - при розчиненні концентрованої сульфатної кислоти у воді, приготуванні… - при розбавленні концентрованої сульфатної кислоти вливати кислоту порціями у воду, злегка перемішуючи;Перша допомога при нещасних випадках
При опіках кислотами шкіру потрібно промити великою кількістю води, а потім нейтралізувати 1%-ним розчином соди або нашатирного спирту. При опіках рідким фенолом необхідно розтирати побілілу частину шкіри… При опіках лугами шкіру промивають водою, а потім нейтралізують 1%-ним розчином борної кислоти.Лабораторна робота 1
МЕТОДИ ОЧИСТКИ РЕЧОВИН
В лабораторній практиці найчастіше використовують такі методи очистки речо-вин: перекристалізація і сублімація (для твердих речовин), перегонка (для рідких і твердих речовин), поглинання (для газів).
Перекристалізація
Під розчинністю розуміють вміст (концентрацію) розчиненої речовини в насиченому розчині. Вона виражається у відсотках або грамах розчиненої речовини… а = ; в =,Перекристалізація речовин із органічних розчинників
Фільтр охолоджують холодною водою або льодом. Осад, що випав, відсмо-ктують за допомогою водоструминного насоса на лійці Бюхнера, яку встановлюють… Якщо на паперовий фільтр впливає фільтрувальна суміш, замість лійки Бюхнера…Перегонка
При перегонці чистої речовини температура кипіння постійна, тому що склад рідини і пари однаковий. Переганяти можна як рідкі, так і тверді речовини. Необхідною умовою… На діаграмі стану для такої суміші буде спостерігатись максимум або мінімум температури кипіння. Вся суміш…Перегонка при атмосферному тиску
Найпростіший прилад для перегонки складається з круглодонної колби з бічним відводом (колба Вюрца), термометра, холодильника, алонжа і приймача… До бічної трубки приєднують холодильник для конденсації парів рідини і відводу… Колбу заповнюють рідиною на 3/5 об’єму. Об’єм перегінної колби підбирають відповідно до передбаченої кількості…Дробна (фракційна) перегонка
Застосовується для вилучення у чистому вигляді компонентів суміші рідин, які відрізняються температурою кипіння і не утворюють одна з іншою азеотропних сумішей.
При розгонці суміші двох речовин для того, щоб отримати більш-менш чисту речовину, необхідно дистилят, який відганяється, розділити за температурою кипіння на кілька фракцій. Отримані фракції піддають дробній перегонці. Завжди збирають три фракції. Залежно від природи компонентів прилад (рис. 1.6), у якому розга-няється суміш, нагрівають на водяних банях, електроплитках або пальниках на азбестовій сітці. Прилад складається із перегінної колби 1, на дно якої кладуть “кип’ятильники”, дефлегматора 2, термометра 3, холодильника 4, алонжа 5 і приймача 6. Після того як прилад зібрали, виймають пробку з термометром із дефлегматора і на її місце
| встановлюють лійку (кінець її трубки має знаходитись нижче від-воду у дефлегматора) і наливають суміш. Дистилят повинен надхо-дити в приймач зі швидкістю 30-40 крапель за хвилину. При досяг-ненні верхньої межі темпера-турного інтервалу першої фракції змінюють приймач. Не припи-няючи нагрівання, продовжують збирати наступну фракцію в другий приймач. Потім приймач змінюють | 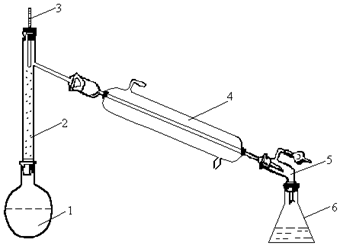 Рис. 1.6. Прилад для фракційної розгонки:
1 – перегінна колба; 2 – дефлегматор;3 – тер-мометр; 4 – холодильник; 5–алонж; 6 – приймач
Рис. 1.6. Прилад для фракційної розгонки:
1 – перегінна колба; 2 – дефлегматор;3 – тер-мометр; 4 – холодильник; 5–алонж; 6 – приймач
|
на третій. Перегонку припиняють, коли в перегінній колбі зостається 2-3 мл рідини. Для кращого розділення суміші речовин проводять вторинну розгонку. В перегінну колбу вміщують першу (основну) фракцію і переганяють її в тих самих температурних межах. При цьому отримана фракція збагачується низькокиплячим компонентом.
Коли температура парів, що відходять, досягне верхньої межі першого темпе-ратурного інтервалу, перегонку припиняють. Прилад охолоджують. В перегінну колбу додають середню фракцію від першої перегонки і знову починають розгонку. По закінченні перегонки середньої фракції до залишку приливають третю фракцію і продовжують розгонку, збираючи фракції в другий і третій приймачі.
При багатократному повторенні розгонки середня фракція значно зменшу-ється, розподіляючись на першу і третю. При цьому виникає звуження температурних інтервалів крайніх фракцій. Таким способом вдається досить добре розділити суміш компонентів. При перериванні перегонки необхідно щоразу додавати нові “кип’ятильники”.
Дослід 1.1. Перекристалізація бензойної кислоти
Дослід 1.2. Перегонка суміші бензолу і ксилолу
Переганяють при повільному нагріванні. В залежності від кількості фракцій готують чисті пробірки або колбочки як приймачі. При перегонці суміші бензолу і ксилолу (дві рівні частини по 50 мл) одержують… Перегонку припиняють тоді, коли в колбі залишається 2-3 мл рідини. Мірним циліндром визначають кількість кожної…Контрольні запитання
1. Основні вимоги до розчинників при перекристалізації.
2. Особливості перекристалізації речовин із органічних розчинників.
3. Перегонка як метод очистки і виділення органічних сполук.
4. Особливості простої і фракційної перегонки.
5. Методика перекристалізації бензойної кислоти.
6. Накреслити схему приладу і пояснити принцип дії на прикладі перегонки суміші бензолу і ксилолу.
Лабораторна робота 2
ВИЗНАЧЕННЯ ОСНОВНИХ ФІЗИЧНИХ КОНСТАНТ ОРГАНІЧНИХ РЕЧОВИН
Кожна органічна речовина має певні фізичні властивості. Найлегше визначити температуру плавлення і кипіння, показник променезаломлювання, густину. Всі ці властивості можуть служити критерієм чистоти речовини і є її константами. Речовину можна визнати достатньо чистою, якщо її константи не змінюються при повторних очистках.
Визначення температури плавлення
Незначні забруднення речовини іноді сильно знижують температуру її плав-лення, і воно проходить у ширшому інтервалі температур. Таке явище… Багато органічних речовин плавляться з розкладанням, про що свідчить… Між температурою плавлення речовини і її будовою існує залежність. Так, симетрично побудовані молекули плавляться при…Визначення температури кипіння
Індивідуальна речовина википає у вузькому інтервалі температур: 0,5-1,0°С. Температура кипіння є функцією тиску, тобто відхилення від нормального… При перегонці висококиплячих речовин іноді необхідно вводити поправку до… t = kn (t1 – t2),Визначення густини рідкої речовини
Визначення густини речовини проводять в пікнометрі ємкістю 1-2 мл. Пікно-метр попередньо миють ацетоном, спиртом, ефіром, після чого його просушують… Попередньо дистильовану воду кип’ятять у невеликій склянці протягом 10-15 хв… Наповнюють нею пікнометр вище риски на шийці пікнометра за допомогою гумової груші, обладнаної трубкою з капіляром.…Маса води в об’ємі пікнометра при 4° С(Х) 1
Маса 1 мл води при 20°С = 0,99823
Маса 1 мл води при 4°С(Х) 1
Отримана величина (Х) є водним числом, або “водною константою", пікно-метра.
Для визначення густини досліджуваної речовини зважують сухий чистий пікно-метр і звіряють його з масою, визначеною при розрахунку “водної константи”. Потім пікнометр наповнюють досліджуваною рідиною і проводять такі ж заміри, як описано вище для води. Відношення маси речовини в об’ємі даного пікнометра до величини водної константи відповідає густині даної речовини:
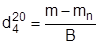
де B - водне число пікнометра; m - маса пікнометра з речовиною; mn - маса порож-нього пікнометра. В лабораторній практиці густину речовини часто вимірюють за допомогою набору ареометрів, відградуйованих при належній температурі і на належну величину густини.
Визначення показника заломлюваності
Показник заломлюваності визначається за допомогою рефрактометра. Під час вимірювання слід підтримувати постійну температуру. Для рідких органічних… Значення показника заломлюваності і густини часто використовують для… ,Дослід 2.1. Визначення температури плавлення
Штатив з приладом для визначення температури плавлення поставити на стіл У прилад на 2/3 об’єму влити чисту сірчану кислоту (вазелінове масло або… В отвір приладу з одним із трьох вказаних теплоносіїв закріпити на гумовій… Зібрати прилад і почати нагрівання. Протягом 10-15 хв нагрівати до темпе-ратури приблизно на 20° нижче передбаченої…Дослід 2.2. Визначення показника заломлення за допомогою рефрактометра ІРФ-22
Обережно закривають верхню півкулю вимірювальної головки. Рідину, що швидко… Показник заломлення суттєво залежить від температури. Він зменшується на – 5 одиниць в четвертому знакові після коми…Контрольні запитання
1. Як визначити приблизну і точну температуру плавлення речовини?
2. Яким чином капіляр заповнюють речовиною?
3. Як визначити поправку на стовпчик ртуті, що виступає?
4. Як визначити поправку до знайденої величини температури кипіння при перегонці висококиплячих речовин?
Лабораторна робота 3
ЯКІСНИЙ ЕЛЕМЕНТНИЙ АНАЛІЗ ОРГАНІЧНИХ СПОЛУК
До складу органічних сполук, окрім вуглецю і водню, часто входять кисень і азот. Молекула органічної речовини може містити й інші елементи (сірку, галогени, фосфор та ін.).
Для визначення елементів у складі органічних сполук їх необхідно перевести в органічні сполуки, для подальшого дослідження яких використовуть методи звичай-ного якісного аналізу. Наприклад, спеціальними методами вуглець переводять в діоксид вуглецю, водень - у воду, азот - в ціанистий натрій, сірку - в сульфід натрію і т.д.
Розглянемо визначення вуглецю, водню, азоту, сірки і галогенів. Для виз-начення кисню не використовують якісні реакції. Про його присутність найчастіше су-дять за даними кількісного аналізу.
Дослід 3.1. Визначення вуглецю пробою на обвуглювання
На кінчик скальпеля або кришку тигля вміщують декілька кристалів глюкози (цукру) і обережно нагрівають у полум’ї пальника. Глюкоза розплавляється,… На кінчик скальпеля вміщують крупинку казеїну і обережно нагрівають у полум’ї… На шматочок фільтрувального паперу (клітковини) вміщують краплю розчину сірчаної кислоти. Після висихання на папері не…Дослід 3.2. Визначення азоту сплавленням речовини з металічним натрієм
Після охолодження в пробірку зі сплавом додають 3 краплі етилового спирту для усунення залишків металічного натрію, який реагує зі спиртом не так… 2С2Н5ОН + 2Na ® 2C2H5ONa + H2 Потім в пробірку додають 5 крапель води і нагрівають на полум’ї пальника. За допомогою піпетки переносять розчин…Na + [C] + [N] ® NaCN
FeSO4 +2NaOH ® Fe(OH)2 + Na2SO4
FeCl3 + 3NaOH ® Fe(OH)3 +3NaCl
2NaCN + FeSO4 ® Fe(CN)2 +Na2SO4
Fe(CN)2 + 4NaCN ® Na4[Fe(CN)6]
гексаціаноферат-(II)
натрію
Утворений комплекс з солями заліза (III) може дати синій осад - берлінську лазур. Одначе луг, присутній в розчині, зв’язує іони Fe3+ в гідроксид заліза (III). Тому берлінська лазур може утворюватися тільки після розчинення гідроксиду в кислоті:
Fe(OH)3 + 3HCl ® FeCl3 + 3H2O
Na4[Fe(CN)6] + 4FeCl3 ® Fe[Fe(CN)6]3 +12NaCl
берлінська лазур
При проведенні досліду необхідно звернути увагу на те, щоб натрій не плавив-ся окремо від речовини, бо навіть при наявності в речовині азоту ціанистий натрій не утворюється і дослід буде невдалим.
Дослід 3.3. Визначення сірки сплавленням речовини з металічним натрієм
лю розчину нітропрусиду натрію Na2[Fe(CN)5NO]: в ту ж мить з’являється червоно-фіолетове забарвлення, яке поступово змінює свій колір. Ця кольорова… Хімізм процесу: 2Na + [S] ® Na2SДослід 3.4. Визначення хлору за зеленим забарвленням полум’я
Галогени найчастіше відкриваються за Бельштейном - прожарюванням орга-нічної речовини з оксидом міді в полум’ї пальника. Мідний дріт довжиною 10 см з петлею на кінці прожарюють у полум’ї пальника до… При прожарюванні кисень оксиду міді окислює вуглець і водень органічної речовини в діоксид вуглецю і воду, мідь же…Дослід 3. 5. Визначення хлору дією металічного натрію на спиртовий розчин органічної речовини.
(метод А. В. Степанова)
| Реактиви та матеріали: | Хлороформ, етиловий спирт, металічний натрій, нітрат срібла, 0,1Н розчин, нітратна кислота, 0,1Н розчин. |
У пробірку вміщують 3 краплі етилового спирту та збовтують. Потім вводять у розчин шматочок металічного натрію величиною з сірникову голівку. Суміш в пробірці починає бурхливо кипіти, й для охолодження пробірку занурюють в холодну воду. Рідина в пробірці мутнішає або з неї випадає осад погано розчинного в спирті хлориду RCI. По закінченні виділення пухирців гідрогену перевіряють, чи повністю розчинився металічний натрій. Якщо натрій розчинився, до суміші приливають 3-4 краплі дистильованої води й додають розведену нітратну кислоту до кислої реакції. Потім додають 2-3 краплі розчину нітрату срібла ─ випадає драглистий осад хлориду срібла.
Хімізм процессу:
C2H5OH + Na → C2H5ONa + H
етилат натрію
RCI + 2 H → R ─ H +HCl
вуглеводень
R ─ Cl + C2H5ONa → R ─ O ─ C2H5 + NaCl
простий ефір
HCl + C2H5ONa → C2H5OH + NaCl
NaCl + AgNO3 → AgCl + NaNO3
Реакцію утворення нерозчинних срібних солей галогеноводневих кислот при дії азотнокислого срібла безпосередньо не можна використовувати для визначення галогену в органічних з'єднаннях, бо вони не дисоціюють на іони й у розчині немає іонів галогену. Небхідно спочатку перевести галоген в неорганічне з'єднання ─ в даному випадку хлорид натрію. При дії гідрогену в момент виділення відбувається відщеплення галогену.
Якісне визначення фосфору
У маленьку (25 мл) колбу К'єльдаля вміщують 0,1 г досліджуваної речовини, 4 мл концентрованої сульфатної кислоти та 1 мл 100%-ної кислоти. Суміш нагрівають до появи парів SO2. Охолоджують. Додають 1 мл 100%-ної нітратної кислоти. Знову нагрівають. Операцію повторюють, доки розчин не знебарвиться й стане прозорим. Все змивають дистильованою водою в склянку й розводять 8 мл розчину, що проготовлений змішуванням 3 мл 96%-ної сульфатної кислоти в 100 мл нітратної кислоти (1:1). Нагрівають до 80-90°С. Доливають 10 мл розчину молібдату амонію. При наявності в речовині фосфору випадає жовтий осад фосформолібдату амонію (виявлення маскується присутністю миш'яку).
Розчин молібдату амонію (NH4)6Mo7O24· 4 H2O готують, змішуючи 100 мл 5%-ного розчину молібдату із 100 мл 10 н. сульфатної кислоти.
Контрольні запитання
1. Як визначається наявність вуглецю в органічній сполуці?
2. Поясніть принцип методу відкриття вуглецю і водню спаленням речовини з оксидом міді. Напишіть рівняння реакції.
3. Поясніть хімізм процесу сплавлення сірки з металічним натрієм.
4. Як відкривають галогени за Бельштейном?
Лабораторна робота 4
НАСИЧЕНІ ВУГЛЕВОДНІ
Будова, ізомерія, номенклатура, властивості
Насичені вуглеводні (алкани, парафіни) мають тільки прості (одинарні) зв’язки між атомами вуглецю, ненасичені мають і кратні зв’язки - подвійні та… гібридна орбіталь вуглецевого …Гомологічний ряд
Ізомерія насичених вуглеводнів залежить від структури вуглецевого скелета (ізомерія ланцюга, або ізомерія скелета). Бутан - найпростіший представник… Ізомерія алкільних радикалів починається з радикала С3Н7-: СН3 - СН2 – СН2 - пропіл …Дослід 4.1. Синтез метану та вивчення його властивостей
| Реактиви та матеріали: | оцтовокислий натрій, натронне вапно, бромна вода, перманганат калію (1Н розчин) |
| Обладнання: | пробірки, газовідвідна трубка, пальник |
В суху пробірку 1, обладнану пробкою з газовідвідною трубкою (рис. 4.1), кладуть суміш зневодненого оцтовокислого натрію і натронного вапна (приблизно 1:2, висота шару 6-10 мм). Натронне вапно (суміш їдкого натру і оксиду кальцію) беруть тому, що чистий їдкий натр роз’їдає скло при нагріванні. Крім того, натронне вапно не плавиться при нагріванні і завдяки його пористості полегшується виділення метану.
Хімізм процесу:
СН3СООNa + NaOH ® CH4 + Nа2CO3

Рис. 4.1. Синтез метану з оцтовокислого натрію
Підпалюють метан, який виходить з кінця газовідвідної трубки, він горить голубуватим несвітним полум’ям.
Хімізм процесу:
СН4 + 2О2 ® СО2 + 2Н2О
Таким чином, при нагріванні натрієвої солі оцтової кислоти з натронним вапном сіль розщеплюється з утворенням метану. Нагрівання натрієвих солей карбонових кислот з натронним вапном є загальним лабораторним способом отримання на-сичених вуглеводнів.
Реакція метану на бромну воду і перманганат калію
В суху пробірку вміщують 5 крапель розчину перманганату калію (або бромної води). Не припиняючи нагрівання суміші в пробірці 1 (рис. 4.1), вводять кінець газовідвідної трубки в пробірку 2 з перманганатом (або бромною водою). Знебарвлювання розчинів перманганату калію й бромної води не відбувається. В звичайних умовах алкани стійкі до дії окислювачів. Реакції заміщення у них відбуваються в жорстких умовах, а до реакції приєднання алкани не здатні.
Дослід 4.2. Галогенування насичених вуглеводнів
RH + Hal → RHal + HHal - ∆H Це радикальні ланцюгові процеси. Вони ініціюються світлом, нагріванням й… Cl2→ 2Cl зародження ланцюгаДослід 4.3. Бромування насичених вуглеводнів
| Реактиви та матеріали: | рідкі алкани, розчин брому в органічному розчинни-ку, аміак (25%-ний розчин), синій лакмусовий папі-рець |
| Обладнання: | пінцет, скляна паличка, пробірки, пальник |
Увага! Дослід проводити у витяжній шафі.
Хімізм процесу:Загальні положення про окисники
Перманганат калію. Для окиснення застосовують водні розчини перманганату калію різної концентрації в нейтральному, кислому або лужному… З'єднання шестивалентного хрому. У лабораторії застосовують для окиснення… Нітратна кислота. Для окиснення застосовують нітратну кислоту різної концентрації (10-65%). Рідкі органічні сполуки…Окиснення парафінів
При температурі вище 300°С насичені вуглеводні горять з утворенням СО2 і Н2О: С5Н12 + 8О2 ® 5СО2 +6Н2О При більш високих температурах у промисловості відбувається процес взаємо-дії метану з водою:Дослід 4.4. Окиснення алканів
| Реактиви та матеріали: | суміш алканів, вуглекислий натрій, перманганат калію |
| Обладнання: | пробірки, піпетки |
У пробірку відбирають 1 краплю алкану або суміші алканів, 1 краплю вуглекислого натрію і 2-3 краплі розчину перманганату калію. Суміш енергійно перемішують, фіолетовий колір водного шару не змінюється, бо алкани в цих умовах не окиснюються.
Дослід 4.5. Дія концентрованої сульфатної кислоти на насичені вуглеводні
| Реактиви та матеріали: | рідкі алкани, сульфатна кислота концентрована (d= 1.84 г/см)3. |
У пробірку вміщують 2 краплі рідкого алкану й 2 краплі сульфатної кислоти. Вміст пробірки енергійно перемішують 1-2 хв, охолоджуючи пробірку проточною водою. В умовах досліду алкани з сульфатною кислотою не реагують.
При невеликому нагріванні сульфатна кислота утворює з алканами, що мають третинний атом карбону, сульфокислоти. При високих температурах сульфатна кислота діє як окисник.
Дослід 4.5. Дія концентрованої нітратної кислоти на насичені вуглеводні
| Реактиви та матеріали: | рідкі алкани, нітратна кислота концентрована (d= 1,4 г/см3.) |
У пробірку вміщують 2 краплі досліджуваного алкану й додають 2 краплі нітратної кислоти. Суміш перемішують на протязі 1-2 хв. Ніякої зміни в пробірці не відбувається.
Концентрована нітратна кислота на холоді не реагує з алканами, при високій температурі вона діє як окисник. Реакція нітрування алканів йде добре з розведеною нітратною кислотою при нагріванні та підвищеному тиску. Легше за все нітруються алкани, що мають в молекулі третинний карбоновий атом. Алкани легко нітруються в газовій фазі діоксидом азоту або парами нітратної кислоти при 250-500°С. Ця реакція йде за радикальним механізмом.
Контрольні запитання
2. Напишіть структурні формули ізомерних вуглеводнів складу С6Н14. Назвіть їх. Вкажіть ізомери з третинними атомами вуглецю. 3. Які вуглеводні утворюються при дії металічного натрію на суміш: а)… 4. Напишіть структурну формулу органічної речовини складу С5Н12, якщо відомо, що при її хлоруванні утворюється…Лабораторна робота 5
АЛКЕНИ
Будова, ізомерія, номенклатура, властивості
За міжнародною номенклатурою назву алкену утворюють таким чином: вибирають найдовший ланцюг вуглецевих атомів з подвійним зв’язком і закінчення… Молекули з двома подвійними зв’язками належать до класу алкадієнів, які називають, додаючи перед закінченням частку…Дослід 5.1. Отримання етилену і його горіння
Хімізм процесу: СН3 - СН2ОН + HOSO3H CH3 - CH2 - OSO3H + H2O етилсульфатна кислотаДослiд 5.2. Приєднання до етилену брому
| Реактиви та матеріали: | етилен, бромна вода (насичений розчин) |
| Обладнання: | пробiрки, пальник, піпетка |
Не припиняючи нагрiвання пробiрки, в якiй знаходиться сумiш спирту i сульфатної кислоти, опускають кiнець газовiдвiдної трубки в пробiрку з п’ятьма краплями бромної води. Бромна вода швидко знебарвлюється внаслiдок приєднання атомiв брому на мiсцi подвiйного зв’язку.
Хiмiзм процесу:
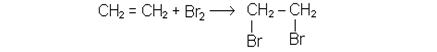
Для алкенiв ця реакцiя служить якiсною реакцiєю на подвiйний зв’язок.
Дослiд 5.3. Взаємодiя з окиснювачами
| Реактиви та матеріали: | етилен, перманганат калiю (0,1Н розчин) |
| Обладнання: | пробiрки, пальник, піпетка |
Не припиняючи нагрiвання пробiрки, в якiй знаходиться сумiш спирту i сульфатної кислоти, опускають кiнець газовiдвiдної трубки в пробiрку з однiєю краплею розчину перманганату калiю i чотирма краплями води. Розчин перманганату калiю швидко знебарвлюється. При цьому алкен окиснюється до двохатомного спирту.
Хiмiзм процесу:
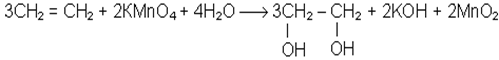
Ця реакцiя також є якiсною на подвiйний зв’язок.
Дослiд 5.4. Приєднання галогенів й галогеноводнів за кратним ланцюгом
Галогенування вуглеводнів із супряженими подвійними зв'язками призводить до утворення ізомерних ненасичених…Дослiд 5.5. Окиснення ненасичених вуглеводнів
Етиленові вуглеводні дуже чутливі до дії окисників. Будова продуктів окиснення визначається природою окисника. При дії кисню на етиленові вуглеводні… Каталітичне окиснення ненасичених вуглеводнів застосовується для отримання α-оксидів. Окиснення етилену киснем…Дослiд 5.6. Дія концентрованої сульфатної кислоти на ненасичені вуглеводні
| Реактиви та матеріали: | рідкі алкени, сульфатна кислота (d=1,84 г/см3). |
У пробірку вміщують 2 краплі рідкого алкену й 2 краплі сульфатної кислоти. Вміст пробірки добре перемішують протягом 1-2 хв, охолоджуючи пробірку холодною проточною водою. Суміш розігрівається, шар алкену зникає.
Хімізм процесу:
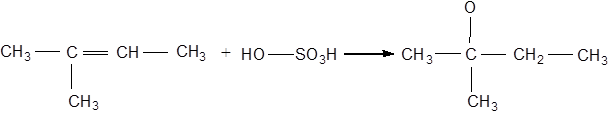
2-метил-2-бутен ізоамілсульфатна кислота
Сульфатна кислота взаємодіє з алкенами з утворенням алкілсульфатних кислот. Цю реакцію застосовують в газовому аналізі для виділення газоподібних алкенів із суміші з іншими газами й для отримання спиртів.
Дослiд 5.7. Дія концентрованої нітратної кислоти на ненасичені вуглеводні
| Реактиви та матеріали: | рідкі алкени, нітратна кислота (d=1,4 г/см3). |
У пробірку вміщують 2 краплі досліджуваного алкену й додають 2 краплі нітратної кислоти. Вміст пробірки струшують протягом хвилини. Суміш розігрівається й стає бурою. У результаті реакції утворюється складна суміш, що містить смолоподібні продукти.
Алкени здатні також приєднувати вищі оксиди азоту й хлористий нітрозил ClNO з утворенням нітрозитів й нітрозохлоридів:

нітрозит тетраметилетилену
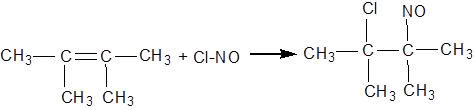
нітрозохлорид тетраметилетилену
Контрольнi запитання
1. Напишiть структурнi формули таких вуглеводнів: а) 5-метилгептен-3; б) 4,4-ди-метилпентен-2; в) 2,3,3-триметилпентен-1; г) 2,4-диметилпентен-1. Назвiть їх.
2. Напишіть структурні формули ізомерних ациклічних вуглеводнів складу С6Н12. Назвіть їх.
3. На прикладi пояснiть правило Зайцева.
4. Отримайте 4-метилпентен-2 iз 4-метилпентену-1. 4-метилпентен-2 окиснiть кон-центрованим розчином KMnO4.
5. Отримайте будь-яким способом 2-метилбутен-1. Напишiть для нього рiвняння реакцii з KMnO4.
6. Якi вуглеводнi отримують при дiї цинку на дигалогенпохiднi: 2,3-дибромпентан; 2,3-дибром-2-метилпентан?
7. Напишіть реакції приєднання: а) НВr до пропену; б) НСl до 2,2-диметилпентену-3.
Лабораторна робота 6
АЛКIНИ
Будова, iзомерiя, номенклатура i властивостi
Для ацетиленових вуглеводнiв характернi як реакцiї приєднання, так i реакцiї… Нd+ ® Сd- ºСd- ¬ Нd+Дослiд 6.1. Отримання ацетилену i його горiння
У пробiрку кладуть маленький шматочок карбiду кальцiю СаС2, додають двi краплi води i закривають пробiрку пробкою з газовiдвiдною трубкою, яка має… Хiмiзм процесу: CaC2 + 2H2O ® HC ºСH + Ca(OH)2Дослiд 6.2. Приєднання брому до ацетилену
| Реактиви та матеріали: | ацетилен, бромна вода (насичений розчин) |
| Обладнання: | пробiрка, газовiдвiдна трубка, піпетки |
Додають у пробiрку з карбiдом кальцію ще двi краплi води, закривають пробiрку пробкою з газовiдвiдною трубкою, кiнець якої опускають в пробiрку з п’ятьма крап-лями бромної води. Бромна вода знебарвлюється внаслiдок приєднання атомiв брому за мiсцем потрiйного зв’язку.
Хiмiзм процесу:
HC º CH + 2Br2 ® Br2HC - CHBr2
1,1,2,2-тетраброметан
Дослiд 6.3. Реакцiя ацетилену з окиснювачами
| Реактиви та матеріали: | ацетилен, перманганат калiю (0,1Н розчин) |
| Обладнання: | пробiрки, газовiдвiдна трубка, піпетки |
У пробiрку вносять 1 краплю перманганату калiю i 4 краплi води. В пробiрку з шматочками карбiду кальцiю додають ще двi краплi води i закривають пробкою з газовiдвiдною трубкою (див. дослiд 6.2), кiнець якої опускають в приготовлений розчин перманганату калiю. Рожевий колір розчину швидко знебарвлюється: йде окиснення ацетилену у мiсцi розриву потрiйного зв’язку з утворенням промiжного продукту окиснення - щавлевої кислоти, яка окиснюється далi до дiоксиду вуглецю:

щавлева кислота
Отже, як видно з двох останнiх дослiдiв, знебарвлення бромної води i перман-ганату калiю доводить ненасиченiсть ацетилену.
Дослiд 6.4. Утворення ацетиленiду срiбла
Хiмiзм процесу: AgNO3 + NH4OH ® AgOH + NH4NO3 2AgOH ® Ag2O + H2OДослiд 6.5. Утворення ацетиленiду мiдi
Хiмiзм процесу: HC ºCH + 2CuCl ® Cu - C ºC - Cu + 2HCl 2HCl + 2NH3 ® 2NH4ClКонтрольнi запитання
1. Напишiть структурнi формули iзомерних ацетиленових вуглеводнiв C7H12, голов-ний ланцюг яких складається з п’яти вуглецевих атомiв. Назвiть їх.
2. Напишiть структурнi формули: 2,5-диметилгексин-3; 3,4-диметилпентин-1; 2,2,5-триметилгексин-3; 2,7-диметилоктин-3; 3,3-диметилбутин-1.
3. Як можна розрiзнити: гексан, гексен-1 i гексин-1; пентен-2 i пентин-2; етилен i ацетилен; сумiш ненасичених i насичених вуглеводнiв?
4. Отримайте метилацетилен, використовуючи пропiловий спирт.
5. Якими реакцiями можна вiдрiзнити пентин-1 вiд пентину-2?
6. Напишiть структурнi формули усiх ацетиленових вуглеводнiв, якi утворюються при дегiдруваннi 2,2-диметилгексану.
7. Який вуглеводень утворюється, якщо на 3,3-диметилбутен-1 подiяти бромом, а потiм надлишком спиртового розчину лугу?
Лабораторна робота 7
АРОМАТИЧНI СПОЛУКИ
Будова, iзомерiя, номенклатура i властивостi
Найпростiший ароматичний вуглеводень - бензол С6Н6, формула його будови зображується по-рiзному: або або … Двi першi формули пiдкреслюють рiвномiрнiсть розподiлу електронної густини в… Гомологи бензолу мають емпiричнi i рацiональнi назви, похiднi вiд бензолу. Похiднi бензолу мають три iзомери, якi…Дослiд 7.1. Синтез бензолу iз бензойнокислого натрiю
Хiмiзм процесу: C6H5 - COONa + NaOH ® C6H6 + Na2CO3 бензойнокислий бензолДослiд 7.2. Синтез нiтробензолу
Хiмiзм процесу: Активною формою нiтруючого агента є катiон нiтронiю, який утворюється при дiї сiрчаної кислоти на азотну: НNO3 +…Вивчення властивостей бензолу
Дослiд 7.3. Розчинність бензолу у різних розчинниках
| Реактиви та матеріали: | бензол, етиловий спирт, діетиловий ефір, бромна вода, перманганат калію, 0,1Н розчин, сульфатна кислота, 2Н розчин. |
| Обладнання: | фарфорова чаша |
У три пробірки вміщують по 1 краплі бензолу. В одну пробірку додають 3 краплі води, в іншу – 3 краплі спирту, в третю – 3 краплі ефіру. Вміст пробірок ретельно збовтують. У пробірці з водою утворюється 2 шари, у пробірці із спиртом й ефіром утворюється однорідний розчин.
Отже, бензол у воді практично не розчиняється й добре розчиняється в органічних розчинниках.
Дослiд 7.4. Горіння бензолу
Увага! Дослід проводити у витяжній шафі.
У фарфорову чашку вміщують 1 краплю бензолу й підпалюють. Бензол горить яскравим чадним полум'ям.
Дослiд 7.5. Дiя бромної води на бензол
| Реактиви та матеріали: | бензол, бромна вода |
| Обладнання: | пробiрки, пiпетка |
У пробiрку вiдбирають пiпеткою 3 краплi бромної води i 2 краплi бензолу. Вмiст пробiрки енергiйно збовтують i дають вiдстоятися; верхнiй шар (бензол) забарвлю-ється у коричнево-жовтий колiр. Бром краще розчиняється у бензолi, нiж у водi, i тому переходить у верхнiй бензольний шар. Приєднання брому в цих умовах не вiд-бувається.
Дослiд 7.6. Дiя перманганату калiю на бензол
| Реактиви та матеріали: | бензол, перманганат калiю, сiрчана кислота, вода |
| Обладнання: | пробiрки, пiпетка |
У пробiрку вiдбирають 3 краплi води, краплю розчину перманганату калiю i краплю розчину сiрчаної кислоти. До отриманого розчину додають краплю бензолу i струшують вмiст пробiрки. Рожевий розчин при цьому не знебарвлюється. Для дослiду бензол попередньо очищають вiд домiшок, охолоджуючи його до +5°С. В такому разi бензол твердiє, а домiшки зостаються рiдкими i легко вiддiляються. Перекристалiзацiю бензолу роблять два-три рази.
Однiєю з найважливiших властивостей бензолу є його стiйкiсть до дiї окиснювачiв. Саме цим ароматичнi вуглеводнi найбiльше вiдрiзняються вiд ненасичених вуглеводнiв жирного ряду.
Сульфування аренів
з утворенням сульфокислоти. Як сульфуючі агенти використовуються концентрована сульфатна кислота, моногідрат, олеум. Для кожної реакції…Дослiд 7.7. Отримання бензолсульфокислоти
| Реактиви та матеріали: | бензол, сiрчана кислота (d=1,84 г/см3) |
| Обладнання: | водяна баня. |
У пробірку вміщують 3 краплі бензолу й 5 крапель концентрованої сульфатної кислоти. Вміст пробірки нагрівають на водяній бані при постійному збовтуванні реакційної суміші. Після отримання однорідного розчину виливають сульфомасу в пробірку з 10 краплями холодної води. Якщо сульфування закінчено повністю, утворюється прозорий розчин, оскільки сульфокислоти розчинні у воді.
Окиснення аренів
а нафталін – у фталевий ангідрид:Дослiд 7.8. Окиснення гомологiв бензолу
| Реактиви та матеріали: | толуол, перманганат калiю (0,1Н розчин), сiрчана кислота (2Н розчин) |
| Обладнання: | пробiрки, пiпетка |
В пробiрку вiдбирають пiпеткою 3 краплi води, краплю розчину перманганату калiю i краплю розчину сульфатної кислоти. Потiм додають краплю толуолу i енергiйно струшують протягом 1-2 хв. Рожеве забарвлення поступово зникає, i розчин знебарвлюється.
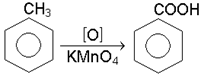
толуол бензойна кислота
Контрольнi запитання
1. Вкажiть, як можна розрiзнити гексан, гексен i бензол. Напишiть рiвняння реакцiй.
2. Як можна розрiзнити: бензол i толуол; бензол i нiтробензол?
3. Напишiть структурнi формули сполук: етилбензол; толуол; стирол; о-хлор-нiтро-бензол; п-толуолсульфокислота (п-сульфокислота); хлорбензол; 1-хлор-2-нiтро-4-сульфобензол.
4. Назвiть сполуки:
| 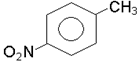
| 
| 
| 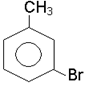
|
5. Напишiть формули двох сполук, якщо при їхньому окисненнi отримали: з однiєї - бензойну кислоту, з другої - п-C6H4(COOH)2.
Лабораторна робота 8
ГАЛОГЕНОПОХIДНI ВУГЛЕВОДНI
Будова, iзомерiя, номенклатура i властивостi
За кiлькiстю атомiв галогену в молекулi вони дiляться на моно-, ди-, три- i бiльше галогенопохiдних. Моногалогенопохiднi називають часто… Галогенопохiднi вуглеводнi називають за номенклатурами:Дослiд 8.1. Синтез бромистого етилу
| Реактиви та матеріали: | етиловий спирт, бромід калію (порошок); сульфатна кислота (d = 1,84 г/см3). |
У пробірку з газовідвідною трубкою вміщують 3 краплі спирту, 2 краплі води й 3 краплі сульфатної кислоти. Охолодивши розігріту спирто-кислотну суміш, до неї додають на кінці мікролопатки декілька кристалів броміду калію. Пробірку закріплюють під нахилом в лопатці штативу й обережно нагрівають вміст пробірки до кипіння. Кінець газовідвідної трубки вставляють в іншу пробірку, що містить 6-7 крапель охолодженої льодом води. Нагрівання ведуть до зникнення кристалів броміду калію в реакційній пробірці. У приймачі утворюються два шари: нижній – бромистий етил, верхній – вода. За допомогою палички вносять 1 краплю бромистого етилу до полум'я пальника. Краї полум'я зафарбовуються в зелений колір.
Хімізм процесу:
C2H5OH + HO – SO3H ↔ C2H5 – O – SO3H + HOH
етилсульфатна кислота
КBr + H2SO4 ↔ HBr + KHSO4
гідросульфід калію
С2H5 – O – SO3H + HBr → C2H5Br + H2SO4
бромистий етил
Найбільш зручним способом отримання галогеналкілів є заміщення гідроксильної групи спиртів R – OH на галоген. Отримання галогенопохідних із спиртів застосовується у великих масштабах, так оскільки спирти – легкодоступні й добре вивчені сполуки. У деяких випадках при отриманні галогеналкілів замість галогеноводнів застосовують галогеніди фосфору.
Дослiд 8.2. Синтез хлористого етилу
| Реактиви та матеріали: | етиловий спирт, сiрчана кислота (d = 1,84 г/см3), хлорид натрiю |
| Обладнання: | пробiрки, пальник, піпетки |
В пробiрку насипають дрiбнi кристали хлориду натрiю (шар » 1 мм), потiм до-дають 3 краплi етилового спирту, 3 краплi сiрчаної кислоти i нагрiвають сумiш на полум’ї пальника. Хлористий етил, що видiляється, спалахує, утворюючи характерне кiльце, забарвлене в зелений колiр.
Хiмiзм процесу:
C2H5OH + HO-SO3H ® C2H5 - O - SO3H + H2O
NaCl + H2SO4 ® HCl + NaHSO4
C2H5 - O - SO3H + HCl ® C2H5Cl + H2SO4
Хлористий етил - газ, легко згущується в рiдину з температурою кипiння 285 К.
Дослiд 8.3. Синтез йодоформу з етилового спирту
Двi краплi осаду переносять на предметне скло, розглядають їх пiд мiкроско-пом (рис.8.1) Кристали йодоформу мають вигляд шестикутникiв або… Йодоформ утворює кристали жовтого кольору з температурою плавлення 119оС, має…Дослiд 8.4. Отримання бромбензолу
| Реактиви та матеріали: | бензол, бром, залiзо (ошурки), натронне вапно, їд-кий натр (2Н розчин) |
| Обладнання: | пробiрка з вiдвiдною трубкою, скляна трубка-погли-нач, ватний тампон, водяна баня, термометр, піпетки |
Увага! Дослiд проводять у витяжнiй шафi.
рають за допомогою пiпетки. З бромбензолом проводять якiсну реакцiю на галоген. Хiмiзм процесу: 2Fe + 3Br2 ® 2FeBr3Дослiд 8.5. Вплив каталізаторів на хід бромування вуглеводнів
У чотирьох пробірках, що містять бензол, на холоді не спостерігають змін. Тому їх нагрівають на водяній бані до початку кипіння, а потім… Хімізм процесу: 2Al + 3Br2 → 2AlBr3Контрольнi запитання
2. Напишiть формули таких сполук: iзопропiлбромiд; йодистий алiл; хлористий вiнiл; 1,1,1-трифтор-2-бром-2-хлоретан (фторотан);… 3. Напишiть схеми синтезу 2,2-дихлорпропану: з вiдповiдного ненасиченого… 4. Перелiчiть реакцiї, за допомогою яких можна перетворити спирт на галогено-похiдне.Лабораторна робота 9
СПИРТИ I ПРОСТI ЕФIРИ
Будова, iзомерiя, номенклатура i властивостi
Функцiональна група спиртiв ОН-, окси- або гiдроксигрупа, гiдроксил. За кiль-кiстю гiдроксильних груп спирти дiляться на одно- i багатоатомнi, за… Спирти називають: - за радикально-функцiональною номенклатурою, додаючи до назви радикала слово спирт (РН);Дослiд 9.1. Визначення будови спиртів
| Реактиви та матеріали: | реактив Лукаса, пропіловий спирт, ізопропіловий спирт, третинний бутиловий спирт. |
Беруть 3 пробірки, нумерують восковим олівцем й приливають до кожної по 2 краплі спирту (у першу – пропіловий, у другу – ізопропіловий та в третю – третинний бутиловий спирт). Потім у пробірки приливають по 5 крапель реактиву Лукаса (хлористий цинк, розчинений в концентрованій соляній кислоті), збовтують вміст пробірок й залишають стояти 1 хв. У пробірці з пропіловим спиртом розчин залишається прозорим, розчин ізопропілового сприрту мутнішає, а в пробірці з третинним бутиловим спиртом утворюється на дні олійна крапля.
За допомогою проби Лукаса можна встановити, чи є даний спирт первинним, вторинним або третинним: первинний спирт залишається прозорим, вторинний - мутніє, а третинний вступає в хімічну реакцію з утворенням галогеналкілу.
Дослiд 9.2. Утворення i гiдролiз алкоголятiв
Хiмiзм процесу: C2H5OH + Na ® C2H5ONa + 1/2H2 C2H5ONa + H - OH ® C2H5OH + NaOHДослiд 9.4. Окиснення етилового спирту перманганатом калiю
Хiмiзм процесу: KMnO4 + H2SO4 ® HMnO4 + KHSO4; марганцева кислотаДослiд 9.5. Синтез дiетилового ефiру
Хiмiзм процесу: C2H5OH + HOC2H5 ® C2H5 - О - C2H5 + H2O Реакцiя проходить у двi стадiї. Спочатку спирт реагує з сульфатною кислотою, утворюючи кислий складний ефiр сульфатної…Контрольнi запитання
1. Напишiть структурнi формули сполук: 2-метилпентанол-3; 2,2,4-триметилпента-нол-3; 2-метилбутанол-1; 2-метилбутин-3-ол-2.
2. Напишiть структурнi формули первинних, вторинних i третинних спиртiв складу С6H13OH. Назвiть їх.
3. Отримайте метилпропiловий ефiр за допомогою спиртiв i наведiть хiмiзм процесу.
4. Отримайте спирти за допомогою реакцiй Гриньяра, маючи: формальдегiд i бромистий пропiлмагнiй; бутанон-2 i бромистий втор-бутилмагнiй.
5. Якi спирти утворюються в результатi лужного гiдролiзу: бромистого вторбутилу; 1-йод-2-метилпентану; 3-бромбутену-1?
Лабораторна робота 10
ФЕНОЛИ
Будова, iзомерiя, номенклатура i властивостi
За кiлькiстю гiдроксильних груп феноли дiляться на одно- i багатоатомнi, наприклад: фенол; оксибензол;… гідрохінон; п-діоксибензол …Дослiд 10.2. Отримання трибромфенолу
| Реактиви та матеріали: | фенол (водний розчин), бромна вода (насичений розчин) |
| Обладнання: | пробiрки, піпетки |
У пробiрку вносять 2 краплi бромної води i додають краплю фенолу. При цьому бромна вода знебарвлюється i утворюється бiлий осад трибромфенолу.
Хiмiзм процесу:

сим-трибромфенол
Гiдроксильна група належить до найбiльш сильних орто-пара-орiєнтантiв. Реак-цiя електрофiльного замiщення водню в бензольному ядрi для фенолiв проходить значно легше i в бiльш м’яких умовах, нiж для бензолу.
Дослiд 10.3. Сульфування фенолу
Реакцiйну сумiш у першiй пробiрцi нагрiвають на киплячiй банi протягом 2-3 хв, потiм охолоджують i виливають у пробiрку з 10 краплями холодної води.… Фенол легко сульфується з утворенням сумiшi о- i n-фенолсульфокислот.… Хiмiзм процесу:Дослiд 10.4. Нітрування фенолу
Гідроксильна група - замісник, який активує ядро. Реакції заміщення фенолів протікають значно легше, ніж у ароматичних вуглеводнів. Фенол нітрується…Дослiд 10.5. Кольоровi реакцiї багатоатомних фенолiв
Одночасно з утворенням фенолятiв, хлорид залiза дiє на феноли i як окис-нювач. Поява в пробiрцi з гiдрохiноном забарвлення, яке швидко змiнюється, вказує на… Помiтити зелений колiр можливо тiльки в перший момент попадання хлориду залiза в розчин гiдрохiнону при розгляданнi на…Дослiд 10.6. Окиснення фенолів киснем повітря в лужному середовищі
| Реактиви і матеріали: | 1%-ні розчини пірокатехіну, резорцину, гідрохінону, пірогалолу; їдкий натр, 2Н. розчин. |
| Обладнання: | фільтрувальний папір. |
На стрічку фільтрувального паперу (10×3 см) наносять через рівні проміжки по 1 краплі розчинів пірокахетіну, резорцину, гідрохінону та пірогалолу. У центр кожної з отриманих плям добавляють краплю розчину лугу. Пляма пірокатехіну миттєво зафарбовується в зелений колір, пляма пірогалолу - у темно-коричневий. Гідрохінон утворює жовту пляму із зеленою каймою по периферії. Резорцин тільки через деякий час утворює слабко виражене кільце коричневого кольору. Зелена пляма пірокатехіну поступово починає жовтіти (відбувається часткове окиснення до о-хінону). Отримані хроматограми додають до робочого журналу.
Дослiд 10.7. Отримання ауріну
Хімізм процесу:Контрольнi запитання
2. Напишiть реакцiю нiтрування фенолу. 3. В який спосiб можна роздiлити сумiш фенолу i бензилового спирту? 4. Яка з перелiчених сполук дає кольорову реакцiю з хлорним залiзом, реагує з розчином лугу, взаємодiє з соляною…Лабораторна робота 11
АЛЬДЕГІДИ І КЕТОНИ
Будова, iзомерiя, номенклатура i властивостi
для кетонiв. Iзомерiя альдегiдiв i кетонiв залежить вiд iзомерiї вуглецевого скелета, крiм того, у кетонiв - вiд положення карбонiльної групи. Альдегiди називають по тих кислотах, в якi вони перетворюються при окисненнi. Так, мурашиний (формальдегiд)…Дослiд 11.2. Отримання фенілгідразону оцтового альдегіду
| Реактиви і матеріали: | оцтовий альдегід, солянокислий фенілгідразин, насичений розчин, оцтовокислий натрій кристалічний. |
У пробірку вміщують 5 крапель солянокислого фенілгідразину та додають декілька кристаликів оцтовокислого натрію. Потім при збовтуванні додають 4 краплі оцтового альдегіду. Випадають кристали фенілгідразону.
Хімізм процесу:
С6H5NH - NH2 × HСl + CH3COONa ® C6H5 - NH -NH2 + CH3COOH + NaCl
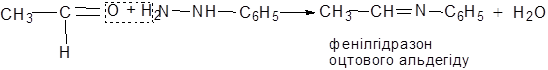
Дослiд 11.3. Отримання ацетону із оцтовокислого натрію
Після охолодження першої пробірки додають до неї краплю концентрованої соляної кислоти. Відбувається сильне спінювання внаслідок виділення оксиду… Хімізм процесу:Окиснення карбонільних сполук
Надкислоти, вступаючи в реакцію з вихідним альдегідом, утворюють кислоти:Дослiд 11.4. Окиснення альдегiдiв амiачним розчином оксиду срiбла
У чисту пробiрку вводять по 2 краплi розчину амiаку і нітрату срібла. Утворюється осад гiдроксиду срiбла, який розчиняють надлишком (1-2 краплi)… Хiмiзм процесу: AgNO3 + NH4OH ® AgOH + NH4NO3Дослiд 11.6. Окиснення бензойного альдегіду оксигеном повітря
| Реактиви і матеріали: | бензойний альдегід. |
| Обладнання: | предметне скло. |
Вміщують на предметне скло краплю бензойного альдегіду та залишають на повітрі. Через деякий час з’являються кристали бензойної кислоти, важко розчинні в холодній воді.
Хімізм процесу:

Ароматичні альдегіди окиснюються ще легше ніж альдегіди жирного ряду, утворюючи відповідні ароматичні кислоти. Наприклад, бензойний альдегід легко окиснюється до бензойної кислоти не тільки окисниками, але й киснем повітря, особливо на світлі. Як проміжний продукт утворюється перекісна сполука - надкислота.
Дослiд 11.7. Якiсна реакцiя на альдегiди з фуксинсiрчистою кислотою
| Реактиви та матеріали: | формальдегiд (40%-ний розчин), оцтовий альдегiд, фуксинсiрчиста кислота |
| Обладнання: | пробiрки, пiпетки |
У двi пробiрки вносять по 2 краплi розчину фуксинсiрчистої кислоти i додають в одну з них 2 краплi розчину формальдегiду, в iншу - 2 краплi оцтового альдегiду. Розчин фуксинсiрчистої кислоти при додаваннi розчину формальдегiду поступово забарвлюється у фiолетовий колiр, при додаваннi оцтового альдегiду - в рожево-фiолетовий.
Дослiд 11.8. Якiсна реакцiя на ацетон з нiтропрусидом натрiю
| Реактиви та матеріали: | ацетон; 0,5Н розчин нiтропрусиду натрiю; 2Н розчин оцтової кислоти; 2Н розчин їдкого натру |
| Обладнання: | предметне скло, пробiрки |
На предметне скло наносять краплю розчину нiтропрусиду натрiю, 2 краплi води i краплю водного розчину ацетону. При додаваннi краплi розчину їдкого натру сумiш забарвлюється у червоний колiр, який при додаваннi краплi розчину оцтової кислоти набуває вишнево-червоного кольору.
Дослiд 11.9. Реакцiя ацетону з гiдросульфiтом натрiю
Хiмiзм процесу: гідросульфітна сполука ацетонуДослiд 11.10. Дiя ацетону на пластмаси
| Реактиви та матеріали: | ацетон, кiноплiвка (ацетилцелюлоза) |
| Обладнання: | скляна паличка, пробiрки |
В суху пробiрку наливають 5-6 крапель ацетону i при перемiшуваннi скляною паличкою розчиняють маленький шматочок целулоїду (кiноплiвки). Коли розчин стане в'язким, в ньому змочують вату i натирають шматочок дерева. Пiсля звiтрення ацетону на деревi залишається плiвка лаку.
Далi два шматочки очищеної вiд емульсiї кiноплiвки змочують з кiнцiв ацетоном, через 1-2 хв накладають один на другий i трохи притискують. Пiсля висихання шматки мiцно склеюються.
Ацетон - хороший розчинник багатьох органiчних речовин.
Контрольнi запитання
1. Напишiть структурнi формули сполук: iзомасляний альдегiд; етилбутилкетон; 2-метилпентаналь; 3-метилгексаналь; 5,5-диметилгексанон-3; 2,2,6-триметилгепта-нон-4; 2-метилгептен-2-он-4; диметилглiоксим; пентандiон-2,4.
2. Напишiть структурнi формули альдегiдiв, якi утворюються при окисненнi спиртiв: пропiлового, бутилового. Чому при утвореннi альдегiдiв окисненням спиртiв альдегiд необхiдно зразу ж вилучати iз сфери реакцiї?
3. Напишiть реакцiї гiдролiзу дигалогенопохiдних: 1,1-дибром-3-метилпентан; 3,3-ди-хлор-2-метилпентан. Назвiть отриманi сполуки.
4. Якi сполуки утворюються при сухiй перегонцi кальцiєвих солей сумiшей кислот: мурашиної i iзомасляної; пропiонової i iзовалерiанової?
5. Наведiть схеми утворення ацетону з таких початкових речовин: етиловий спирт; пропiловий спирт; пропiлен.
Лабораторна робота 12
КАРБОНОВІ КИСЛОТИ ТА ЇХНІ ПОХІДНІ
Будова, iзомерiя, номенклатура i властивостi
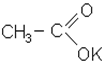
Для карбонових кислот в бiльшостi випадків вживаються тривiальнi назви. Крiм того, їх можна називати за рацiональною номенклатурою, згiдно з назвою… Радикали кислот, якi утворюються при вiднiманнi гiдроксильної групи вiд…Солі
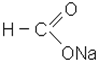
| 
|
| форміат натрію; метаноат натрію | ацетат калію; етаноат калію |
Ефiри
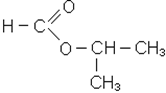
| 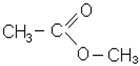
|
| ізопропілформіат; ізопропілметаноат; ізопропіловий ефір мурашиної кислоти | метилацетат; метилетаноат; метиловий ефір оцтової кислоти |
Двоосновнi кислоти та їхні похiднi
Карбоксильна група - приклад взаємного впливу атомiв у молекулi. Карбонiльна група -С=О , яка в нiй мiститься, вже не має своїх специфiчних… Такий запис неточний, бо в утвореному карбоксиланiонi негативний заряд належить в однаковiй мiрi обом атомам кисню, i…Жири
Жири (триглiцериди) - сумiш складних ефiрiв триатомного спирту глiцерину

i вищих карбонових кислот, серед яких переважають пальмiтинова C15H31COOH, стеаринова C17H35COOH, олеїнова C17H33COOH або CH3(CH2)7CH=CH(CH2)7COOH кислоти.
Жири називають, використовуючи звичайну номенклатуру складних ефiрiв або називаючи тiльки залишки кислот, i додають до останнього залишку закiнчення "-ин" ("-ін"):
При лужному гiдролiзi жирiв утворюється глiцерин i мило - сiль вищої кислоти: стеарат натрiю.

| 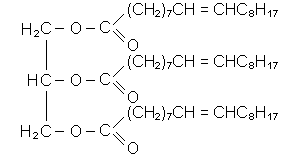
|
| дипальмітостеарин; дипальмітостеарат гліцерину | триолеїн; триолеат гліцерину |
Дослiд 12.1. Розчиннiсть кислот у водi
| Реактиви та матеріали: | кислоти (оцтова, масляна, iзомасляна, акрилова, стеаринова, олеїнова, щавлева, малонова) |
| Обладнання: | пробiрки, скляна паличка, пiпетка, пальник |
3 краплi або декiлька кристалiв кожної з кислот змiшують у пробiрцi з 5 крап-лями води. Якщо кислота не розчиняється, пробiрку нагрiвають. Гарячi розчини охо-лоджують i спостерiгають видiлення кристалiв кислот, якi розчиняються тiльки при нагрiваннi. Для усiх паралельних проб беруть однакову кiлькість кислоти i розчинника.
Кислотнi властивостi карбонових кислот
Дослiд 12.2. Дiя оцтової кислоти на iндикатори
| Реактиви та матеріали: | оцтова кислота (0,1Н розчин); метилоранж; лакмус; 1%-ний спиртовий розчин фенолфталеїну |
| Обладнання: | пробiрки, скляна паличка, пiпетка, пальник |
У три пробiрки наливають по 3 краплi розчину оцтової кислоти. В першу додають краплю метилоранжу, в другу - лакмусу, в третю - фенолфталеїну. В пробiрцi з метиловим оранжевим з'являється червоне забарвлення, в пробiрцi з лакмусом - рожеве, з фенолфталеїном - лишається безбарвним.
Дослiд 12.3. Взаємодiя з металами
+ Mg (СН3СОО)2Mg + H2 ацетат магнію На пiдтвердження того, що газ, який видiляється, - водень, у пробiрку вносять лучину. При цьому спостерiгається спалах…Дослiд 12.4. Взаємодiя з солями
Хiмiзм процесу: 2CH3COOH + Na2CO3 ® 2CH3COONa + CO2 + H2O ацетат натрiюДослід 12.5. Отримання мурашиної кислоти з хлороформу та її відкриття
Для відкриття утвореного форміату, який утворився, влийте в пробірку б реактив, заготовлений в пробірці 1. Срібло негайно відновлюється у вигляді…Дослід 12.6. Отримання натрієвої солі щавлевої кислоти
В іншу пробірку вміщують декілька кристаликів мурашинокислого натрію та додають 3-4 краплі води. В обидві пробірки додають по 1 краплі розчину… Хімізм процесу:Дослід 12.7. Відкриття щавлевої кислоти у вигляді кальцевої солі
Додайте до осаду 1 краплю 2Н CH3COOH - осад не розчиняється. Від додавання 1-2 крапель 2Н HCl осад повністю розчиняється. Зверніть увагу на цю…Реакцiя карбонових кислот нa окислювачi
Дослід 12.8. Окиснення щавлевої кислоти перманганатом калію
Отвір пробірки закривають пробкою з газовідвідною трубкою, кінець якої занурено в пробірку з баритовою водою. Реакційну суміш нагрівають. Рожевий… Хімізм процесу: HOOC - COOH + [O] ® 2CO2 + H2OДослiд 12.9. Окиснення олеїнової кислоти перманганатом калiю
| Реактиви та матеріали: | олеїнова кислота; перманганат калiю; 0,1Н та 0,5Н розчин карбонату натрiю |
| Обладнання: | пробiрки, пiпетки |
У пробiрку вiдбирають по 2 краплi олеїнової кислоти, розчинiв карбонату натрiю i перманганату калiю. При струшуваннi сумiшi рожевий колiр зникає.
Хiмiзм процесу:
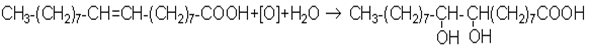
Дослiд 12.10. Приєднання брому до олеїнової кислоти
| Реактиви та матеріали: | олеїнова кислота, бромна вода (насичений розчин) |
| Обладнання: | пробiрки |
У пробiрку вносять 3-4 краплi бромної води, краплю олеїнової кислоти i енергiйно перемiшують. Бромна вода знебарвлюється.
Хiмiзм процесу:
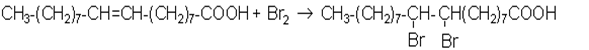
Знебарвлення перманганату калiю i бромної води свiдчить про наявнiсть подвiйного зв'язку в молекулi олеїнової кислоти.
Отримання складних ефiрiв
Дослiд 12.11. Отримання оцтовоетилового ефiру
Важливий спосiб утворення складних ефiрiв - взаємодiя карбонових кислот зi спиртами (реакцiя етерифiкацiї). В ролi каталiзаторiв використовують… Хiмiзм процесу:Контрольнi запитання
1. Напишiть структурнi формули таких кислот i солей: пропiонова кислота; 2-ме-тилпентанова кислота; н-валерiанова кислота; акрилова кислота; щавлева кисло-та; ацетат магнiю; формiат алюмiнiю. Назвіть їх за міжнародною номенклатурою.
2. Напишiть формули ацилiв (радикалiв кислот): ацетил; бутирил; валерил; оксалiл.
3. Наведiть схему реакцiй отримання пропiонової кислоти з бромистого етилу: через нiтрил; через магнiйорганiчнi сполуки.
4. Напишiть формули i назвiть 5 кислот, якi найчастiше входять до складу жирiв.
Лабораторна робота 13
СКЛАДНІ ЕФІРИ, ЖИРИ І ОЛИВИ
Складнi ефiри - це продукти реакцiй гiдроксильних сполук (спиртiв i фенолiв) з кислотами. Тут ми розглядаємо лише складнi ефiри, утворенi… кислота спирт складний ефірЖири та оливи
У зв'язку з тим, що всi жири i оливи - складнi ефiри глiцерину, їх вiдмiннiсть полягає в рiзнiй природi кислот, якi етерифiкують глiцерин.… додеканова (лауринова) кислота CH3(CH2)10COOH тетрадеканова (мiристинова) кислота CH3(CH2)12COOHДослiд 13.1. Отримання бензойноетилового ефiру
| Реактиви та матеріали: | бензойна кислота, етиловий спирт, сульфатна кислота (d = 1,84 г/см3) |
| Обладнання: | пробiрки, пальник |
У пробiрку вмiщують декiлька кристалiв бензойної кислоти, додають 4 краплi етилового спирту i 2 краплi сульфатної кислоти. Сумiш у пробiрцi струшують i обережно пiдiгрiвають до кипiння. Виливають отриману безбарвну рiдину у пробiрку з холодною водою. З'являється характерний запах бензойноетилового ефiру (етилбензоату). Частина бензойної кислоти, яка не вступила в реакцiю, випадає в осад.
Хiмiзм процесу:
C6H5COOH + C2H5OH ® C6H5-COOC2H5 + H2O
бензойна етанол етиловий ефір
кислота бензойної кислоти
Дослід 13.2. Порівняти розчинність рослинних олив у різних розчинниках
Екстрагування жиру на папері
До центру плями на одному з квадратиків паперу доторкуються скляним капіляром,… Після випаровування розчинника в центрі залишається коло чистого знежиреного паперу, а олія ─ на периферії плями…Дослід 13.3. Емульгування жирів
| Реактиви і матеріали: | олія соняшникова; їдкий натр, 0,1Н розчин; карбонат натрію, 2Н розчин; мило, розчин; білок, розчин. |
У п’ять пробірок наливають по 1 краплі соняшникової олії та додають по 5 крапель: води - у першу пробірку, розчин їдкого натру - у другу, карбонату натрію - у третю, розчин мила - у четверту та розчин білка - у п’яту. Сильно збовтують вміст кожної пробірки та спостерігають утворення емульсії.
Якщо жири добре збовтати з водою, то вони утворять емульсію, тобто мутну рідину, в якій дрібні краплі жиру зважені у воді. Але емульсія олії у воді дуже не стійка та швидко руйнується, оскільки краплі олії починають злипатися у більші, які потім утворюють шар жиру на поверхні води. Пробірки з отриманими емульсіями ставлять у штатив на декілька хвилин. Звертають увагу, в якій пробірці відбулося розшарування та які речовини дають стійки емульсії.
Дослiд 13.4. Визначення ступеня ненасиченостi жиру
(взаємодiя жиру з бромною водою)
| Реактиви та матеріали: | олія, твердий жир, бромна вода (насиче-ний розчин), етиловий спирт |
| Обладнання: | бюретка, пробiрки, колби, пiпетки |
Беруть 2 пробiрки: в одну з них вносять краплю рослинної олії, в iншу - краплю розплавленого жиру. В обидвi пробiрки додають по 3-5 крапель етилового ефiру до розчинення жиру, а потiм приливають iз бюретки бромну воду, ретельно змiшуючи сумiш у пробiрках доти, поки з'явиться стiйке жовтогаряче забарвлення. Визначають, скiльки мiлiлiтрiв бромної води витратилось на бромування твердого i рiдкого жиру.
Хiмiзм процесу:
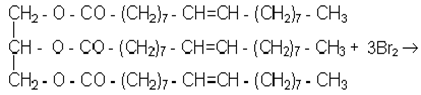
|
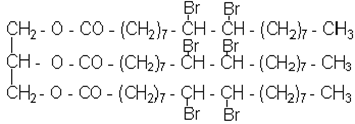
|
Дослiд 13.5. Визначення ненасиченостi жиру за допомогою
Спиртового розчину йоду
Ступiнь ненасиченостi жиру або масла визначають за кiлькiстю речовини. На практицi переважно використовують йод. Ступiнь ненасиченостi виражають так…Дослiд 13.6. Окислення рослинних олій перманганатом калiю
| Реактиви та матеріали: | рослинна, 0,1Н розчин перманганату калiю, 2Н розчин карбонату натрiю |
| Обладнання: | пробiрки, пiпетки |
У пробiрку вносять 2 краплi рослинної олії, 2 краплi розчину карбонату натрiю i 2 краплi водного розчину перманганату калiю. Сумiш струшують у пробiрцi. Малинове забарвлення перманганату калiю зникає - це вказує на окислення глiцеридiв ненасичених вищих кислот, якi входять до складу олії.
Хiмiзм процесу:

|
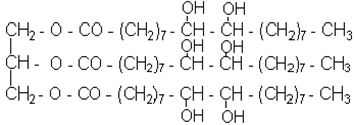
|
Дослід 13.7. Омилення жирів у водно-спиртовому розчині
У широку пробірку вміщують 2 г жиру та приливають 6 мл спиртового розчину лугу. Розмішують суміш скляною паличкою та нагрівають на водяній бані до… Для визначення кінця омилення вміщують у пробірку декілька крапель отриманої… Якщо суміш розчиняється у воді повністю, без виділення крапель жиру, то омилення можна вважати закінченим. Якщо…Дослiд 13.8 . Розчиннiсть мила у водi
| Реактиви та матеріали: | мило (тверде), вода |
| Обладнання: | пробiрки, пальник |
У пробiрку вмiщують шматочок мила (10 мг) i додають 5 крапель води, ретельно перемiшують протягом 1-2 хвилин. Пiсля цього сумiш у пробiрцi нагрiвають у полум'ї пальника. Натрiєвi та iншi лужнi мила (калiєве, амонiєве) добре розчиняються у водi.
Дослід 13.9. Виділення вільних жирних кислот із мила
| Реактиви і матеріали: | мило, концентрований розчин; сульфатна кислота, 2Н розчин. |
У пробірку вміщують 5 крапель концентрованого розчину мила, додають 1 краплю розчину сульфатної кислоти та трохи підігрівають вміст пробірки на полум’ї пальника. Піднімається білий масляний шар вільних жирних кислот, водний розчин освітлюється. Вміст пробірки залишають для наступного досліду.
Хімізм процесу:

Мила ─ солі вищих насичених та ненасичених органічних кислот. Тверде мило - суміш натрієвих солей пальмітинової, стеаринової та олеїнової кислот.
Дослід 13.10. Доказ ненасиченості жирних кислот, що входять до складу мила
| Реактиви і матеріали: | жирні кислоти (з попереднього досліду); бромна вода, насичений розчин. |
У пробірку з виділеними жирними кислотами додають 3 краплі бромної води та енергійно збовтують - бромна вода знебарвлюється. Отже, до складу жирних кислот, виділених із мила, входять й ненасичені кислоти, які легко приєднують бром у місці розриву подвійного зв’язку, знебарвлюючи при цьому бромну воду:
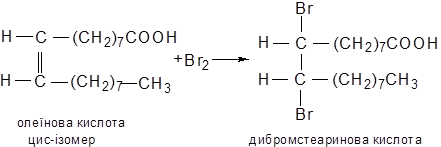
Дослiд 13.11. Гiдролiз спиртового розчину мила
Хiмiзм процесу: C17H35COONa + HOHÛ C17H35COOH + NaOH C17H35COONaÛ[C17H35COO]- + Na+Дослiд 13.12. Утворення нерозчинних кальцiєвих солей жирних кислот
| Реактиви та матеріали: | розчин мила, хлорид кальцiю (0,1Н розчин) |
| Обладнання: | пробiрки, пiпетки |
У пробiрку вносять 2 краплi розчину мила, краплю розчину хлориду кальцiю i перемiшують. Випадає бiлий осад.
Хiмiзм процесу:
2С17H35COONa + CaCl2 Û (C17H35COO)2Ca + 2NaCl
стеарат кальцію
Кальцiєвi солi жирних кислот нерозчиннi у водi.
Дослід 13.13. Утворення нерозчинного у воді мідного мила
| Реактиви і матеріали: | мило, розчин; сульфат міді (ІІ), 0,02Н розчин. |
У пробірку вміщують 1 краплю розчину мила та 4 краплі розчину сульфату міді. Випадає блакитно-білий осад мідного мила. Розчин нагрівають до кипіння, при цьому мідне мило спливає на поверхню розчину у вигляді зеленого кільця. Якщо у розчині залишається натрієве мило, що не увійшло до реакції, то зелене кільце не утвориться. У такому випадку додають ще 2-3 краплі розчину сульфату міді та знову нагрівають до кипіння.
Хімізм процесу:
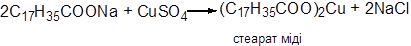
Контрольнi запитання
2. Напишiть схему гiдрування триолеїну i вкажiть каталiзатор, який використовується в промисловостi. 3. Напишiть схему гiдролiзу тристеарину i вкажiть каталiзатор, який… 4. Напишiть структурнi формули сполук: метиловий ефiр iзомасляної кислоти; етилформiат; етилбензоат.Лабораторна робота 14
МОНОСАХАРИДИ
Поняття про оптичну iзомерiю
Найпростiшою ознакою, за якою судять про iснування оптичних iзомерiв у сполуки, є наявнiсть асиметричного вуглецевого атома, зв'язаного з чотирма… Iзомери такого типу називають ще оптичними антиподами, але найчастiше - енантiомерами. Їхні фiзичнi i хiмiчнi…Будова, номенклатура i властивостi
Моносахариди мають тривiальнi назви. Для них характерне закiнчення "-оза", для назв сахарiв, якi мiстять кетогрупу біля другого… Моносахариди в розчинi iснують в декiлькох таутомерних формах. Наприклад,…Дослiд 14.1. Доказ присутностi гiдроксильних груп у глюкозi
Хімізм процесу: CuSO4 + 2NaOH ® Cu(OH)2 + Na2SO4Дослiд 14.2. Окислення глюкози гiдроксидом мiдi (II) в
До лужного розчину сахарату мiдi додають 5-6 крапель води (висота шару рi-дини повинна бути 10-15 мм). Вмiст пробiрки нагрiвають над полум'ям… Хімізм процесу: [O] + 2CuOH + H2O …Дослiд 14.3. Окислення глюкози реактивом Фелiнга
| Реактиви та матеріали: | 0,5%-ний розчин глюкози, реактив Фелiнга |
| Обладнання: | пробiрки, пальник, пiпетки |
У пробiрку вносять 3 краплi розчину глюкози i краплю реактиву Фелiнга (лужний розчин мiдного алкоголяту сегнетової солi). Пробiрку тримають пiд кутом i обережно нагрiвають верхню частину розчину. При цьому нагрiта частина розчину забарвлюється в жовтий колiр внаслiдок утворення Cu(ОН)2, який потiм переходить в червоний осад Cu2О. Окислення реактивом Фелiнга (C8H6O12CuNa2К2) - якiсна реакцiя на глюкозу.
Реакцiї альдегiдної групи
Дослiд 14.4. Окиснення глюкози амiачним розчином оксиду срiбла
У пробiрку вносять краплю розчину нiтрату срiбла, 2 краплi розчину їдкого натру i приливають краплями розчин амiаку до розчинення утвореного осаду… Хiмiзм процесу:Дослід 14.5. Реакція Селіванова на кетони
При нагріванні з концентрованими мінеральними кислотами, у даному випадку із соляною кислотою, молекули гексоз поступово розщеплюються, утворюючи… який конденсується з резорцином, утворюючи забарвлену сполуку. Ця реакція дозволяє швидко визначити у суміші сахарів…Контрольнi запитання
1. Якими реакцiями можна розрiзнити: пентозу i гексозу; глюкозу i фруктозу?
2. Яка реакцiя доводить присутнiсть в глюкозi карбонiльної групи; декiлькох гiдро-ксильних груп?
3. Чи є реакцiя "срiбного дзеркала" i вiдновлення Cu(ОН)2 до Cu2O доказом присутностi в молекулi глюкози альдегiдної групи?
4. Напишiть у двох таутомерних формах моносахариди: L-глюкозу, L-манозу, L- фруктозу.
5. Напишiть проекцiйнi формули моноз, епiмерних D-глюкозі i D-галактозі.
6. Напишiть проекцiйнi формули: a i b -галактози; a i b - фруктози.
7. Напишiть рiвняння реакцiй фруктози: з синильною кислотою; з гiдроксиламiном; з оцтовим ангiдридом.
8. Напишiть реакцiю утворення сахарату мiдi з глюкози.
9. Пояснiть на прикладi, що таке оптична iзомерiя.
Лабораторна робота 15
ПОЛІСАХАРИДИ
Класифiкацiя, номенклатура
В назвах олiгосахаридiв враховують назви вiдповiдних їм моносахаридiв, замiнюючи закiнчення "-оза" на закiнчення "-озидо" або…Дослiд 15.1. Доказ наявностi гiдроксильних груп у сахарозi
| Реактиви та матеріали: | 1%-ний розчин сахарози, 2Н розчин їдкого натру, 0,2Н розчин сульфату мiдi |
| Обладнання: | пробiрки, піпетки |
У пробiрку вносять краплю розчину сахарози, 5 крапель розчину лугу i 4-5 крапель води. Додають краплю розчину сульфату мiдi (II). Сумiш стає синьою внаслiдок утворення сахарату мiдi. Розчин зберiгають для наступного дослiду.
Дослiд 15.2. Вiдсутнiсть вiдновлювальних властивостей у сахарози
| Реактиви та матеріали: | розчин сахарату мiдi |
| Обладнання: | пробiрки; пiпетки; пальник |
Розчин сахарату мiдi обережно нагрiвають до кипiння над полум'ям пальника, при цьому пробiрку тримають так, щоб нагрiвалась тiльки верхня частина розчину. Сахароза в цих умовах не окислюється, що вказує на вiдсутнiсть в її молекулi вiльної альдегiдної групи.
Дослiд 15.3. Кислотний гiдролiз сахарози
До залишку гiдролiзованого розчину сахарози (перша пробiрка) додають кристалик резорцину, 2 краплi концентрованої соляної кислоти i нагрiвають до… Хiмiзм процесу:Дослiд 15.4. Реакцiя крохмалю з йодом
| Реактиви та матеріали: | крохмальний клейстер; 0,1Н водний розчин йоду |
| Обладнання: | Пробiрки, пiпетки, пальник |
У пробiрку вносять 2 краплi крохмального клейстеру i краплю розчину йоду. Вмiст пробiрки забарвлюється в синiй колiр. Отриману темно-синю рiдину нагрiвають до кипiння. Забарвлення при цьому зникає, а при охолодженнi з'являється знову.
Крохмаль - сумiш двох полiсахаридiв - амiлози (20%) i амiлопектину (80%). Амiлоза розчинна в теплiй водi i дає з йодом синє забарвлення. I амiлоза, i амi-лопектин складаються із залишкiв глюкози, пов'язаних L-глiкозидними зв'язками.
Амiлоза може утворювати комплекси - одним iз них є сполука амiлози з йодом, яка має синє забарвлення.
Схематичний вираз будови амілози:

Амiлопектин з йодом дає червоно-фiолетове забарвлення.
Дослiд 15.5. Кислотний гiдролiз крохмалю
Проба КолiрДослід 15.6. Ферментативний гідроліз крохмалю
У пробірку з гідролізованим крохмалем додають 4 краплі розчину лугу, 1 краплю розчину сульфату міді (ІІ), збовтують вміст пробірки та нагрівають до… Гідроліз крохмалю відбувся за рахунок ферменту слини амілази, яка дуже…Дослід 15.8. Взаємодія клітковини з лугом
Клітковина стійка до дії лугів. При обробці концентрованими розчинами їдких лугів утворюється міцна сполука - лужна клітковина, або алкаліцелюлоза.…Дослід 15.9. Отримання амілоїду з клітковини
| Реактиви і матеріали: | клітковина (фільтрувальний папір); аміак, 2Н розчин; сульфатна кислота (d=1,84 г/см3); розчин йоду в йодиді калію, 0,1Н розчин |
У пробірку вміщують 3 краплі води та 5 крапель сульфатної кислоти. Отриманий гарячий розчин охолоджують до кімнатної температури та опускають до нього кінець смужки фільтрувального паперу. Через 8-10 с папір виймають, ретельно промивають від кислоти у проточній воді та розчині аміаку і злегка висушують. Кінець паперу, який опущено в кислоту, стає більш щільним та водонепроникним. На межі двох ділянок паперу вміщують 1 краплю розчину йоду. Ділянка, оброблена кислотою, зафарбовується у червоно-синій колір.
При нетривалій дії концентрованої сірчаної кислоти відбувається частковий гідроліз клітковини та утворюється амілоїд - високомолекулярна сполука. Амілоїд нерозчинний у воді, йодом зафарбовується у синій колір.
Дослiд 15.10. Кислотний гiдролiз клiтковини
Хiмiзм процесу: (C6H10O5)x + xH2O ® xC6H12O6 При нагрiваннi з мiнеральними кислотами клiтковина гiдролiзується. Гiдролiз йде поступово, з утворенням все бiльш…Дослiд 15.11. Отримання азотнокислих ефiрiв клiтковини
Отриманий жовтуватий колоксилiн дiлять на двi частини. Шматочок колоксилiнової вати пiдносять до полум'я пальника - вата вмить спалахує. Iнший… Хiмiзм процесу:Дослід 15.12. Отримання триацетату клітковини
Невелику кількість отриманого сухого триацетату клітковини вміщують у пробірку, додають 4 краплі ацетону і повільно нагрівають до слабкого кипіння… Залишок ацетату клітковини розчиняють у 4 краплях хлороформу при невеликому…Контрольнi запитання
1. Як можна розрiзнити: сахарозу i фруктозу; молочний цукор i фруктозу; крохмаль i клiтковину?
2. Якими реакцiями можна розрiзнити глiцерин, глюкозу i сахарозу?
3. Напишiть схему синтезу з двох молекул глюкози: a-глюкопiранозил-a-глю-копiранозиду (тригалози); a-глюкопiранозилглюкози (мальтози); b-глюкопiрано-зилглюкози (целобiози).
4. Напишiть схему перетворення L-глюкопiранозил- b - фруктофуранозиду (сахарози) в iнвертний цукор. Пояснiть назву "iнвертний".
5. Напишiть у двох таутомерних формах моносахариди: L-глюкозу, L-манозу, L-фруктозу.
6. Напишiть проекцiйнi формули: a- i b-галактози; a- i b-фруктози.
7. Напишiть проекцiйнi формули моноз, епiмерних D-глюкозi i D-галактозi.
Лабораторна робота 16
АМІНИ. АМІНОКИСЛОТИ І АМІДИ КИСЛОТ
Будова, iзомерiя, номенклатура i властивостi
аміак первинний амін, метиламін вторинний амін, диметиламін третинний… Вiдповiдно до цього групи -NH , =NH i ºN називаються амiногрупами… Iзомерiя амiнiв залежить вiд iзомерiї вуглецевого ланцюга (в радикалах); положення амiногрупи у вуглецевому ланцюзi…Дослiд 16.1. Отримання метиламiну з ацетамiду
| Реактиви та матеріали: | ацетамiд, бромна вода, етиловий спирт, хлороформ, 0,1Н і концентрований розчини NаOH |
| Обладнання: | газовiдвiдна трубка, пробiрки |
Увага! Дослiд проводять у витяжнiй шафi.
Потiм додають стiльки ж крапель 0,1Н розчину NаОН. Кiнець газовiдвiдної трубки занурюють у пробiрку з водою, яка охолоджується льодом, а пробiрку з… Хiмiзм процесу:Дослiд 16.2. Властивостi амiнiв жирного ряду
1. Дiя iндикаторiв. До отвору газовiдвiдної трубки (пiсля дослiду 16.1) пiдносять вологий червоний папiрець - вiн синiє. В пробiрку вносять 2 краплi… Хiмiзм процесу: CH3NH2 + HOH ® [CH3NH3]+ OH- « [CH3NH3]+ + OH-Дослiд 16.3. Одержання анiлiну з нiтробензолу
Сумiш трохи пiдiгрiвають на полум'ї пальника i весь час ретельно збовтують. Якщо реакцiя стає повiльнiшою, сумiш у пробiрцi знову пiдiгрiвають i… Хiмiзм процесу: 3Sn + 6HCl ® 6H+ + 3SnCl2Дослiд 16.4. Розчиннiсть анiлiну у водi
| Реактиви та матеріали: | Анiлiн, вода |
| Обладнання: | пробiрки, пiпетка |
У пробiрку вносять 5 крапель води, краплю анiлiну i енергiйно збовтують – утворюється емульсiя анiлiну у водi. Додають ще 2-3 краплi води i знову збовтують сумiш у пробiрцi - емульсiя зберiгається.
Анiлiн погано розчиняється у водi. В насиченому водному розчинi анiлiну при 16oС мiститься 3% анiлiну.
Дослiд 16.5. Утворення солей анiлiну та їхній розклад
1. У пробірку вміщують 1 краплю аніліну, 8 крапель води та збовтують вміст пробірки. Одну краплю емульсії наносять на лакмусовий папірець. Колір… 2. Приготовлену емульсію аніліну ділять на дві частини. До однієї частини… Хімізм процесу:Дослiд 16.6. Кольоровi реакцii анiлiну
| Реактиви та матеріали: | солянокислий анiлiн, лігнін, 2Н розчин хлорного вапна, 2Н розчин їдкого натру, червоний лакмусовий папiрець |
| Обладнання: | пробiрки, скляна паличка, предметне скло |
1. Реакція аніліну з лігніном.
Краплю розчину солянокислого аніліну змішують з лігніном. З'являється жовте забарвлення, зумовлене присутністю лігніну.
2. Реакція аніліну з хлорним вапном.
Краплю розчину солянокислого анiлiну наносять на предметне скло i додають краплю хлорного вапна. З'являється темно-зелене забарвлення, яке переходить у синiй, а потiм у чорний колiр. Ця реакцiя зумовлена тим, що анiлiн легко окислюєть-ся.
Дослiд 16.7. Бромування анiлiну
| Реактиви та матеріали: | анiлiн (розбавлена анiлiнова емульсiя), насичений розчин бромної води |
| Обладнання: | пробiрки, пiпетка |
У пробiрку вносять 3 краплi бромної води i краплю анiлiнової емульсiї. Випадає бiлий осад триброманiлiну:

сим-триброманілін
Амiногрупа - електродонорний замiщувач, тому вона пiдвищує електронну густину в ароматичному ядрi i полегшує цим реакцiї електрофiльного замiщення.
Замiсть анiлiну для цього дослiду можна використовувати солi анiлiну. Вони бромуються так само легко, як i сам анiлiн.
Дослід 16.8. Конденсація аніліну з формальдегідом
У нейтральному або слабо лужному розчині при еквімолекулярному співвідношенні компонентів утворюється основа Шиффа C6 H5 - N = CH2, яку неможливо…Дослiд 16.9. Реакцiя амiнокислот на iндикатори
| Реактиви та матеріали: | амiнооцтова кислота, метилоранж, метиловий чер-воний, розчин лакмусу |
| Обладнання: | пробiрки, пiпетки |
У пробiрку вносять 2 краплi розчину амiнооцтової кислоти i додають краплю метилоранжу. Такий же дослiд проводять з метиловим червоним i лакмусом. Забарвлення iндикаторiв не змiнюється.
Амiнокислоти виявляють як кислотнi, так i основнi властивостi - кислотна група -СООН i основна -NН2 взаємно нейтралiзуються, тому амiнокислоти мають структуру амфотерних або бiполярних iонiв (внутрiшнi солi):
H3N+ - CH2COO–
У зв'язку з вищезгаданим воднi розчини одноосновних амiнокислот нейтральнi щодо iндикаторiв.
Дослід 16.10. Утворення мідної солі амінооцтової кислоти
| Реактиви і матеріали | амінооцтова кислота, 0,2Н розчин; оксид міді (ІІ) CuO, порошок; їдкий натр, 2Н розчин. |
У пробірку вміщують небагато порошку оксиду міді CuO, 4 краплі розчину амінооцтової кислоти та нагрівають на полум¢ї пальника, збовтуючи вміст пробірки. Пробірку ставлять на деякий час у штатив, щоб опустився надлишок чорного порошку оксиду міді. До відстояного синього розчину приливають 1 краплю розчину їдкого натру. Розчин залишається прозорим.
Для амінокислот характерне утворення мідних солей, пофарбованих у синій колір. a - амінокислоти дають із міддю пофарбовані внутрішні комплексні солі, які дуже стійкі:

Зв¢язок між атомами міді й азоту координаційний за рахунок вільної пари електронів азоту аміногрупи.
Дослiд 16.11. Дiя азотистої кислоти на амiнокислоти
| Реактиви та матеріали: | нiтрит натрiю, 0,2Н розчин амiнооцтової кислоти, 2Н розчин соляної кислоти |
| Обладнання: | пробiрки, пiпетки |
У пробiрку вносять 2 краплi розчину амiнокислоти, 2 краплi розчину нiтриту натрiю i 2 краплi соляної кислоти. При струшуваннi сумiшi у пробiрцi видiляються бульбашки газу.
Хiмiзм процесу:
NaNO2 + HCl ® HNO2 +NaCl

оксіоцтова кислота
Ця реакцiя покладена в основу кiлькiсного визначення амiногруп в амiно-кислотах, а також у бiлках i продуктах їхнього розпаду.
Дослід 16.12. Конденсація сечовини з формальдегідом. Отримання полімеру
Щоб зберегти пробірку, не треба доводити процес конденсації до повного отвердіння смоли, а відразу вимити пробірку під краном з допомогою йоржа. Схематично реакція конденсації сечовини з формальдегідом можна подати таким…Дослiд 16.13. Дiя мурашиного альдегiду на амiнокислоти
| Реактиви та матеріали: | 0,2Н розчин амiнооцтової кислоти, метиловий червоний, формальдегiд (40%-ний) |
| Обладнання: | пробiрки, пiпетка з капiлярним отвором |
У пробiрку вносять 3 краплi розчину формальдегiду i краплю метилового червоного - розчин червонiє. За допомогою пiпетки приливають розчин лугу до появи жовтого забарвлення (нейтральне середовище на метиловий червоний). В окрему пробiрку вносять 3 краплi амiнооцтової кислоти i приливають до неї сумiш першої пробiрки. З'являється червоне забарвлення
Хiмiзм процесу:

діоксиметил-
аміноетанова кислота
Блокована мурашиним альдегiдом амiногрупа не впливає на карбоксил, i розчин амiнокислоти стає кислим.
Контрольнi запитання
2. Як розрiзнити оцтову кислоту i глiкокол; ацетат натрiю i глiкокол? 3. Напишiть структурнi формули сполук: метилiзопропiламiн; метилдіетиламiн;… 4. Напишiть схеми реакцiй: етилпропiламiну з соляною кислотою; етиламiну з азотистою кислотою; глiцину з азотистою…Лабораторна робота 17
БІЛКОВІ РЕЧОВИНИ
Бiлки являють собою бiополiмери a-амiнокислот з дуже високою молекулярною масою (вiд 5000 до декiлькох мiльйонiв). Сполуки, побудованi з багатьох… За своїм складом бiлки дiляться на протеїни i протеїди. Протеїни - це простi… Значний внесок у вирiшення проблеми будови бiлкових речовин, утворення полiпептидних фрагментiв бiлкових молекул…Дослiд 17.1. Кольоровi реакцiї на бiлки
2. Ксантопротеїнова реакцiя. В пробiрку вводять 3 краплi водного розчину бiлка i краплю азотної кислоти. З'являється бiлий осад. При нагрiваннi… 3. Реакцiя на сiрку. В пробiрку кладуть трохи бiлої шерстяної пряжi, 2 краплi… 4. Азотнортутна реакція білків. У пробірку вміщують 2 краплі розчину білка і 1 краплю азотнортутного реактиву,…Дослiд 17.2. Буфернi властивостi розчину бiлкiв
В чисту пробiрку вносять 3 краплi бiлка i краплю забарвленого в синiй колiр розчину соляної кислоти. Забарвлення розчину набуває рожевого кольору,… 2. Готують дуже розведений розчин їдкого натру (так само, як i соляної… В чисту побiрку вносять 3 краплi розчину бiлка i краплю забарвленого розчину лугу. Рожевий колiр зникає, тобто…Дослід 17.3. Згортання білків при нагріванні
| Реактиви і матеріали: | білки, водні розчини; сульфат амонію, 2Н розчин |
У пробірку наливають 4 краплі розчину білка і нагрівають на полум¢ї пальника до кипіння. Білок при цьому випадає у вигляді муті або пластівців. Вміст пробірки трохи охолоджують, додають краплю розчину сульфату амонію та нагрівають до початку кипіння. Кількість білка, що згорнувся при цьому, збільшується.
Згортання білків при нагріванні характерне для більшості з них. Додавання нейтральних солей (сульфату амонію, хлориду натрію) полегшує і прискорює згортання білків при нагріванні. Згортання білків - процес необоротного осадження, оскільки білкові молекули при цьому змінюють свою структуру.
Дослід 17.4. Осадження білків концентрованими мінеральними кислотами
| Реактиви і матеріали: | білки, водні розчини; нітратна кислота (d=1,41 г/см3); хлоридна кислота (d = 1,19 г/см3) |
У пробірку наливають 2 краплі концентрованої нітратної кислоти та обережно, нахиливши пробірку, по стінці додають 2 краплі розчину білка. Через декілька секунд на межі розподілу білка й кислоти утворюється кільце згорнутого білка. При збовтуванні кількість згорнутого білка збільшується.
Такий же дослід повторюють із хлоридною кислотою. Осад, що випав при дії хлоридної кислоти, при збовтуванні розчиняється.
Концентровані мінеральні кислоти утворюють з білками солеподібні сполуки й одночасно викликають згортання білків. У більшості випадків осад, що випав, розчиняється у надлишку концентрованої кислоти (крім азотної).
Дослiд 17.5. Осадження бiлкiв солями важких металiв
| Реактиви та матеріали: | Бiлки, насичений розчин сульфату мiдi, 2Н розчин (СН3СОО)2Рb оцтовокислого свинцю |
| Обладнання: | пробiрки, пiпетки |
У двi пробiрки вносять по 3 краплi розчину бiлка. В одну пробiрку додають краплю розчину сульфату мiдi, в iншу - краплю розчину оцтовокислого свинцю. Утво-рюється пластiвчастий осад або муть: з сiллю мiдi - осад голубого кольору, а з сiллю свинцю - бiлого.
Контрольнi запитання
1. Класифiкацiя бiлкiв.
2. Якi основнi форми зв'язку амiнокислот в молекулi бiлка?
3. Якi ви знаєте ступенi ускладнення структури бiлкiв?
4. Напишiть рiвняння реакцiї хлорангiдриду a-хлорізовалерiанової кислоти з анiлi-ном. На отриманий продукт подiйте амiаком.
5. Напишiть схему синтезу аланiну з етилового спирту. Для амiнокислоти напишiть рiвняння реакцiї: з HCl; з NaOH; з HNO2.
6. Напишiть формули промiжних i кiнцевих продуктiв у схемах:
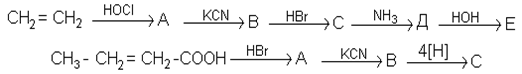
7. Напишiть рiвняння реакцiй гiдролiзу: аланiлглiцину; аланiлаланiну.
8. Отримайте: глiцилаланiн; аланiлглiцилвалiл; глiциллiзилтриптофан.
Лабораторна робота 18
ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
Гетероциклiчнi сполуки дiлять за розмiрами циклу i за числом гетероатомiв у ньому. Найбiльш важливi п'яти- i шестизначний гетероцикли з одним або… Наявнiсть поєднання пiдтверджується довжинами зв'язкiв i виражається… Нумерацiю в гетероциклах починають з гетероатома i ведуть проти годинникової стрiлки. Прийнято позначати атоми в…Дослiд 18.1. Отримання кофеїну з чаю
| Реактиви та матеріали: | 0,5 г сухого чаю, розчин танiну |
| Обладнання: | фарфоровий тигель, годинникове скло, азбестова сiтка, плитка |
У фарфоровий тигель кладуть 0,5 г сухого чаю, накривають годинниковим склом i обережно нагрiвають на азбестовiй сiтцi до появи на склi кристалiв кофеїну. Якщо нанести паличкою розчин танiну, колiр кофеїну змiнюється. Формула отриманої сполуки:

Дослід 18.2. Отримання фурфуролу
| Реактиви і матеріали: | 1 г тирси або висівок, 3-4 мл хлоридної кислоти (1:1), розчин хлорного заліза, суміш аніліну з оцтовою кислотою (1:1) |
| Обладнання: | пробірка з газовідвідною трубкою, водяна баня, фільтрувальний папір |
У пробірку з газовідвідною трубкою насипають приблизно 1 г тирси або висівок, або шкарлупи насіння соняшнику та додають 3-4 мл хлоридної кислоти і декілька крапель розчину хлорного заліза. Суміш нагрівають 10-15 хв на киплячій водяній бані, потім пробірку закріплюють у штативі й відганяють в іншу пробірку 1-1,5 мл отриманого розчину, котрий має запах житнього хліба. Це свідчить про присутність фурфуролу. Щоб переконатися в цьому, виконують реакцію на фурфурол, а саме - змочують фільтрувальний папір сумішшю аніліну з оцтовою кислотою (1:1) і наносять на нього декілька крапель відгону; фільтрувальний папір забарвлюється в рожево-червоний колір.
Дослiд 18.2. Якiснi реакцiї фурфуролу
1. Реакцiя з фуксинсiрчистою кислотою. На годинникове скло наносять 4 крап-лi фуксинсiрчистої кислоти, краплю розчину фурфуролу i перемiшують… 2. Реакцiя з амiакатом срiбла. На годинникове скло наносять краплю розчину… 3. Реакцiя з анiлiном. На годинниковому склi змiшують краплю анiлiну з краплею оцтової кислоти. Смугу фiльтрувального…Дослiд 18.3. Властивостi пiридину
2. Основний характер пiридину. За допомогою пiнцета смужку червоного лакмусового паперу вносять у пробiрку з розчином пiридину - папiр стає синiм. … Хiмiзм процесу:Контрольнi запитання
1. Як можна розрiзнити бензол, анiлiн i пiридин?
2. Як можна роздiлити бензол i пiридин?
3. Напишiть будову сполук: 2,5-диметилфуран; a-бромтiофен; a, a'- диметилпiрол; 2-амiнопiридин; b-пiридинсульфокислота; 4-iндолкарбонова кислота.
4. Напишiть рiвняння реакцiй при пропусканнi над нагрiтим до 450 оС оксидом алюмiнiю (реакцiя Юр'єва) речовин: метиламiну з 1-метилфураном; тiофену з етиламiном; 1-метилпiролу з сiрководнем.
Додаток 1.
БУДОВА ТА НАЗВА ФУНКЦІОНАЛЬНИХ ГРУП ОРГАНІЧНИХ МОЛЕКУЛ
НАФТА, БЕНЗИН, ПОЛІМЕРИДодаток 2. Фракції при перегонці нафти Октанове число деяких С7- та С8- вуглеводнів Фракції …Додаток 3
ОСНОВНІ ПОЗНАЧЕННЯ ПРИ КІЛЬКІСНИХ РОЗРАХУНКАХ ПО ХІМІЇ
1. М(х) - молярна маса, г/моль 2. m(x) - маса речовини Х, г 3. n(x) - кількість речовини, мольКОНЦЕНТРАЦІЯ РОЗЧИНІВ
1. w(х) - масова частка розчиненої речовини х, % w(х) = 100% 2. С(х) - молярна концентрація, [моль/л]: 1моль/л = 1М - одно-; 0,1 моль/л =… С(х) = або С(х) =ЛІтература
Змiст
| Загальнi правила | |
| Запобiжнi заходи | |
| Перша допомога при нещасних випадках | |
| Лабораторна робота 1. Методи очистки речовин | |
| Лабораторна робота 2. Визначення основних фiзичних констант органiчних речовин | |
| Лабораторна робота 3. Якiсний елементний аналiз органiчних сполук | |
| Лабораторна робота 4. Насиченi вуглеводнi | |
| Лабораторна робота 5. Алкени | |
| Лабораторна робота 6. Алкiни | |
| Лабораторна робота 7. Ароматичнi сполуки | |
| Лабораторна робота 8. Галогенопохiднi вуглеводнi | |
| Лабораторна робота 9. Спирти i простi ефiри | |
| Лабораторна робота 10. Феноли | |
| Лабораторна робота 11. Альдегiди i кетони | |
| Лабораторна робота 12. Карбоновi кислоти та їх похiднi | |
| Лабораторна робота 13. Складнi ефiри, жири i масла | |
| Лабораторна робота 14. Моносахариди | |
| Лабораторна робота 15. Полiсахариди | |
| Лабораторна робота 16. Амiни, амiнокислоти i амiди кислот | |
| Лабораторна робота 17. Бiлковi речовини | |
| Лабораторна робота 18. Гетероциклiчнi сполуки | |
| Додатки | |
| Література | |
| Зміст |
Навчальне видання
БУРЯ Олександр Іванович
ГАЮН Наталія Сергіївна
ПРАКТИКУМ З ОРГАНІЧНОЇ ХІМІЇ
НАВЧАЛЬНИЙ ПОСІБНИК
Редактор Т.С. Завгородня
Художній редактор Ю.О.Яремко
Коректор
Комп´ютерний набір Н.С. Гаюн
Задано на складання Підписано до друку Формат 60x84
Папір офсетний. Гарнітура літературна. друк офсетний. Умовн. друк. арк..
Увовн. фарб.-відб. Обл.- видавн. арк.. Тираж 500прим. Зам№
Комунальне підприємство “Наука і освіта”
49000, м. Дніпропетровськ, вул. Бердянська, 61
Свідоцтво про внесення до Державного реєстру
серія ДП № від
ISBN
– Конец работы –
Используемые теги: Практикум, органічної, хімії0.069
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Практикум З органічної хімії
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов