рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Диаграммы состояния двухкомпонентных сплавов
Реферат Курсовая Конспект
Диаграммы состояния двухкомпонентных сплавов
Диаграммы состояния двухкомпонентных сплавов - раздел Философия, АНАЛИЗ ДИАГРАММ ФАЗОВОГО РАВНОВЕСИЯ Диаграмма Состояния Представляет Собой Графическое Изображени...
Диаграмма состояния представляет собой графическое изображение состояния сплава. Если изменяется состав сплава, его температура, давление то состояние сплава также изменяется. Это находит графическое отображение в диаграмме состояния.
Диаграмма состояния показывает устойчивые состояния, т. е. состояния, которые при данных условиях обладают минимумом свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. В соответствии с этим и изменения в состоянии, которые отражены на диаграмме, относятся к равновесным условиям, т. е. при отсутствии перенагрева или переохлаждения. Однако равновесные превращения, т. е. превращения в отсутствие переохлаждения или перенагрева, в действительности не могут совершаться, поэтому диаграмма состояния представляет собой теоретический случай, а в практике используется для рассмотрения превращений при малых скоростях нагрева или охлаждения.
Для двухкомпонентных сплавов диаграмма состояния показывает изменение состояния в зависимости от температуры и концентрации компонентов. По оси ординат откладывают температуру по оси абсцисс – концентрацию. Общее содержание обоих компонентов в сплаве равно 100 % и каждая точка на оси абсцисс соответствует определенному содержанию каждого компонента. Пример диаграммы фазового равновесия для сплава из двух компонентов приведен на рис. 2.
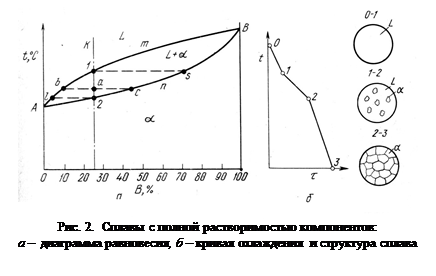
Количество фаз у сплава и их химический состав при заданной температуре и концентрации определяется правилом отрезков. Например, дано задание определить эти значения для сплава с концентрацией компонентов К (рис. 2) в точке а. Анализ диаграммы показывает, что сплав К в точке а состоит из жидкой и твердой фазы. Проведем горизонтальную линию до пересечения ее с границами области фазовых превращений и обозначим точки пересечения b и c. Состав жидкой фазы определится проекцией точки b, лежащей на линии ликвидус, на ось абсцисс. Состав твердой фазы сплава определяется проекцией точки с на ось абсцисс. Количество жидкой фазы определяется из соотношения отрезков [ac]/[bc], количество твердой [ba]/[bc].
В любой другой области фазовой диаграммы с помощью правила отрезков можно определить фазовый и структурный состав сплава аналогичным образом.
Рассмотрим несколько стандартных видов диаграмм фазовых равновесий двухкомпонентных сплавов.
Сплавы с полной растворимостью компонентов
в твердом и жидком состояниях
Полная растворимость в твердом состоянии возможно только для изоморфных компонентов, имеющих одинаковую кристаллическую решетку.
Если два компонента неограниченно растворяются в жидком и твердом состояниях, то возможно существование только двух фаз — жидкого раствора L и твердого раствора a. Следовательно, трех фаз быть не может, кристаллизация при постоянной температуре не наблюдается, горизонтальной линии на диаграмме нет. Диаграмма, изображенная на рис. 2., состоит из трех областей: жидкость, жидкость + твердый раствор и твердый раствор. Линия АmВ является линией ликвидус, а линия АmВ — линией солидус. Процесс кристаллизации изображается кривой охлаждения сплава. Между линиями ликвидус и солидус сплав находится в двухфазном состоянии.
Сплавы с эвтектическим превращением
при полной растворимости в жидком состоянии
Эвтектическая реакция характерна для компонентов, образующих граничные твердые растворы. При этом температуры плавления чистых компонентов различаются незначительно.
В этой системе из жидкости могут выделяться только твердые растворы a или b. Следовательно, около вертикалей А В (рис. 3), соответствующих чистым компонентам, находятся области существования твердых растворов a или b. Предельная растворимость компонента В в А определяется линией DF, а предельная растворимость А в В — линией CG. Сплавы, находящиеся между 1 этими двумя линиями, находятсяза пределами растворимости и являются двухфазными, состоящими из a + b. Окончание кристаллизации происходит по эвтектической реакции:
L ® a + b.
Линия АЕВ является на этой диаграмме линией ликвидус, линия ADCB — линией, солидус.
Зная правило фаз и правило отрезков, можно проследить за процессом кристаллизации любого сплава.
 |
Кристаллизация сплава I. Выше точки 1 сплав находится в жидком состоянии. В точке 1 начинается процесс кристаллизации. Выделяются кристаллы твердого раствора a, концентрация которого изменяется по кривой а — 2, а состав жидкости изменяется по кривой 1 — b. В точке 2 кристаллизация закончится, и полученные кристаллы твердого раствора должны иметь (для равновесной кристаллизации) концентрацию исходной жидкости. Эти, кристаллы не претерпевают изменений до точки 3, лежащей на линии предельной растворимости. Ниже этой точки твердый раствор ос является пересыщенным и выделяет избыточные кристаллы. Такими кристаллами являются кристаллы b-твердого раствора, что определяют, применяя правило рычага для сплава, лежащего внутри двухфазной области a + b. (т. е. для сплава ниже линии DF).

Состав твердого раствора a изменяется по кривой 3 — F, вследствие выделения кристаллов b. Количество кристаллов b при охлаждении увеличивается. Количество кристаллов b, выделившихся из сплава I, характеризуется отрезком от вертикали I до линии 3—F. Кривая охлаждения и схемы структур этого сплава при различных температурах показаны на рис. 4. Кристаллы b, выделившиеся из твердого раствора, называются вторичными кристаллами. Процесс выделения название вторичной кристаллизации в отличие от процесса первичной кристаллизации, когда кристаллы (первичные) образуются в жидкой фазе.
Кристаллизация сплава II. При кристаллизации этого сплава, в отличие от предыдущего, при достижении горизонтальной линии DEC наступает нонвариантная реакция. В равновесии находятся три фазы — жидкость L, a – кристаллы состава точки D и b - кристаллы состава точки С. Все три фазы, участвующие в реакции, имеют определенные составы и температура их превращения постоянна. В результате кристаллизации сплава II, кроме первичных a- кристаллов, образуется еще эвтектика a + b.
При дальнейшем охлаждении вследствие изменения растворимости выделяют вторичные кристаллы b и при нормальной температуре a-кристаллы (как первичные, так и входящие в эвтектику) будут иметь состав, отвечающий точке F. Кривая охлаждения сплава II и структуры этого сплава показаны на рис. 4. Выделение вторичных кристаллов из эвтектических составляющих обычно не обнаруживается при микроскопическом исследовании, так как вторичные выделения объединяются с такой же (одноименной) фазой эвтектики. Несмотря на многообразие структурных составляющих окончательно охлажденный сплав содержит только две фазы б и в, и правило фаз, если его применить ниже линии DE, покажет все количество a- и b- фаз независимо от того, в какой структурной форме они находятся.
Сплавы с перитектическим превращением
при полной растворимости в жидком состоянии
При эвтектическом превращении жидкость кристаллизуется с образованием двух твердых фаз. Возможен и другой тип нонвариантного превращения (трехфазного равновесия), когда жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов
L + b ® a.
Реакция соединения подобного типа называется перитектической. Перетектическая реакция характерна для компонентов, образующих граничные твердые растворы. При этом температуры плавления чистых компонентов различаются значительно. Например, с перетектической реакцией кристаллизуются сплав платина (Tпл =1773 °С) – серебро (Tпл =960 °С).
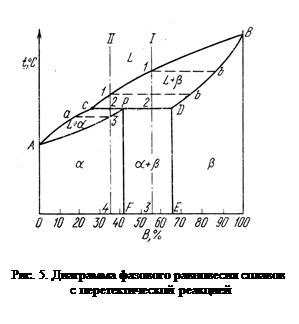 |
Диаграмма с перитектическим превращением показана на рис. 5. На диаграмме показаны три однофазные области: жидкость L и ограниченные твердые растворы b и a. Линия ABC является линией ликвидус, линия APDB — линией солидус.
Кристаллизация сплава I. Кристаллизация начинается в точке 1 (рис. 5), когда из жидкости выпадают кристаллы раствора состава точки b.
Затем по мере снижения температуры жидкость меняет свою концентрацию по линии ликвидус от точки 1 до точки С, а кристаллы b — по линии солидус от точки B до точки D. По достижении перитектической горизонтали CPD состав жидкости будет отвечать точке С, а состав кристаллов — точке D. Эти обе фазы реагируют и дают третью фазу a, концентрация которой определяется точкой С — третьей точкой на горизонтали. В данном сплаве имеется избыток b-фазы по сравнению с тем количеством, которое необходимо для образования a-кристаллов. Поэтому по окончании реакции в избытке остаются b-кристаллы. 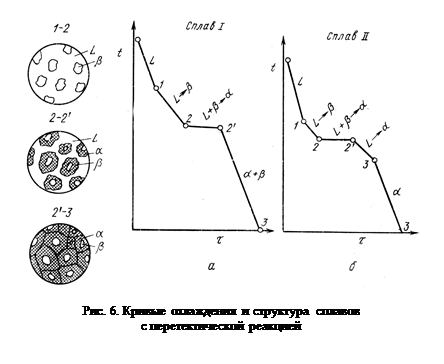
Следовательно, в структуре будут продукты перитектической реакции (т. е. a-кристаллы) и оставшиеся избыточные первичные b-кристаллы. Чем ближе точка 2 лежит к точке Р, тем меньше в реакции остается избыточных b-кристаллов.
На рис. 6, а показана кривая охлаждения сплава I; отдельные моменты кристаллизации показаны на схемах структур. Для перитектической кристаллизации (средняя схема) характерно то, что новая a-фаза появляется на границе реагирующей друг с другом жидкости и в-кристаллов. Для сплава I перитектической реакцией заканчивается процесс кристаллизации.
Кристаллизация сплава II. Отличие кристаллизации этого сплава от кристаллизации сплава I состоит в том, что при перитектической температуре имеется избыток жидкой фазы по сравнению с тем количеством, которое необходимо для образования a-кристаллов концентрации Р. Поэтому перитектическое превращение заканчивается исчерпанием b-твердого раствора, и оставшаяся жидкость в интервале между точками 2—3 кристаллизуется в a-фазу. При этом концентрация жидкости изменяется по кривой С—а, а концентрация образующихся a-кристаллов — по С—3 (см. рис. 5).
Наличие химического соединения
или другой промежуточной фазы
 |
Химическое соединение характеризуется определенным соотношением компонентов, а это отражается на диаграмме вертикальной линией, проходящей на оси абсцисс через точку, отвечающую соотношению компонентов в химическом соединении. Химическое соединение устойчиво, если его можно нагреть без разложения до расплавления, и неустойчиво, если при нагреве оно разлагается. В зависимости от этого могут быть два вида диаграмм. Кроме того, возможно образование нескольких химических соединений между двумя компонентами, а также растворимость на базе химического соединения — эти обстоятельства также находят отражение в диаграмме состояния.
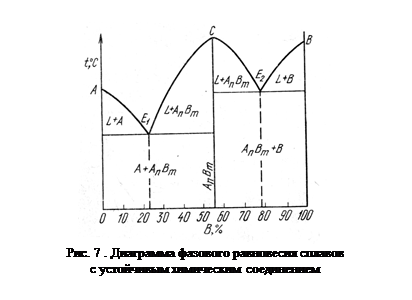
На рис. 7 показана диаграмма состояния с устойчивым химическим соединением АnВm. Точка С соответствует температуре плавления этого химического соединения. На диаграмме имеются две эвтектические точки Е1 и Е2. Эвтектика Е1 представляет собой смесь кристаллов компонента А и химического соединения, а эвтектика Е2 — кристаллов В и химического соединения. Соответствующими реакциями образования эвтектических смесей являются:
LE1 ® А + АnВm LE2 ® АnВm + B.
Если химическое соединение является неустойчивым, не имеющим определенной температуры плавления, такое соединение при нагреве распадается c перетектической реакцией:
AB ® L + A
Перечисленные виды диаграмм фазового равновесия не исчерпывают всех возможных вариантов фазовых превращений в сплавах. В частности, в твердом состоянии возможно протекание эвтектоидного превращения – реакции распада твердой фазы b при аллотропическом превращении на две фазы a' + a'' (рис.8):
b ® a' + a''
Другой пример, монетектическое превращение – распад жидкости L1 на несмешивающуюся с ней жидкость L2 и кристалл твердой фазы для сплавов «медь – свинец» (рис. 9):
L1 ® L2 + a.
Более подробно о характер протекания фазовых превращений можно узнать из специальной литературы.
|
– Конец работы –
Эта тема принадлежит разделу:
АНАЛИЗ ДИАГРАММ ФАЗОВОГО РАВНОВЕСИЯ
Федеральное агентство по образованию... Ивановский государственный университет Кафедра экспериментальной и технической физики...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Диаграммы состояния двухкомпонентных сплавов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?


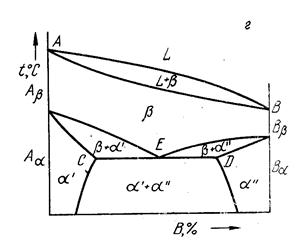 Рис. 8. Диаграмма сплава с эвтектоидным превращением
Рис. 8. Диаграмма сплава с эвтектоидным превращением
 Рис. 9. Диаграмма сплава с монотектическим превращением
Рис. 9. Диаграмма сплава с монотектическим превращением





Новости и инфо для студентов