КОНСПЕКТ ЛЕКЦІЙ З ДИСЦИПЛІНИ ТЕХНОЛОГІЇ ПОЛІСАХАРИДІВ ТА ЇХ ЗАСТОСУВАННЯ В ХАРЧОВІЙ ПРОМИСЛОВОСТІ
КОНСПЕКТ ЛЕКЦІЙ З ДИСЦИПЛІНИ ТЕХНОЛОГІЇ ПОЛІСАХАРИДІВ ТА ЇХ ЗАСТОСУВАННЯ В ХАРЧОВІЙ ПРОМИСЛОВОСТІ - Конспект, раздел Философия, Міністерство Освіти І Науки, Молоді Та Спорту України...
МІНІСТЕРСТВО ОСВІТИ І НАУКИ, МОЛОДІ ТА СПОРТУ УКРАЇНИ
ДЕРЖАВНИЙ ВИЩИЙ НАВЧАЛЬНИЙ ЗАКЛАД
УКРАЇНСЬКИЙ ДЕРЖАВНИЙ ХІМІКО-ТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТ
КОНСПЕКТ ЛЕКЦІЙ
З ДИСЦИПЛІНИ
“ТЕХНОЛОГІЇ ПОЛІСАХАРИДІВ ТА ЇХ ЗАСТОСУВАННЯ В ХАРЧОВІЙ ПРОМИСЛОВОСТІ”
ДЛЯ СТУДЕНТІВ НАПРЯМКУ ПІДГОТОВКИ
6.051701 – ХАРЧОВІ ТЕХНОЛОГІЇ ТА ІНЖЕНЕРІЯ
СПЕЦІАЛЬНОСТІ – ТЕХНОЛОГІЯ ЖИРІВ ТА ЖИРОЗАМІННИКІВ
Затверджено на засіданні
кафедри хімічної технології
високомолекулярних сполук
Протокол №____ від ________
Дніпропетровськ ДВНЗ УДХТУ 2012
Конспект лекцій з дисципліни «Технології полісахаридів та їх застосування в харчовій промисловості» для студентів напрямку підготовки 6.051701 – харчові технології та інженерія спеціальності - технологія жирів та жирозамінників / Укл.: А.О.Філінська, О.В.Черваков, Т.Г.Філінська – Дніпропетровськ: ДВНЗ”УДХТУ”, 2012. – 101с.
Укладачі: А.О.Філінська
О.В.Черваков, к.х.н
Т.Г. Філінська
Відповідальний за випуск О.В.Черваков, к.х.н
Навчальне видання
Конспект лекцій
з дисципліни
«Технології полісахаридів та їх застосування в харчовій промисловості»
для студентів напрямку підготовки 6.051701 – харчові технології та інженерія спеціальності - технологія жирів та жирозамінників.
Укладачі: ФІЛІНСЬКА Антоніна Олександрівна
ЧЕРВАКОВ Олег Вікторович
ФІЛІНСЬКА Тетяна Геннадіївна
ЗМІСТ
Стор.
ВСТУП5
ЗАГАЛЬНІ ПОЛОЖЕННЯ, НОМЕНКЛАТУРА
КОНТРОЛЬНІ ЗАПИТАННЯ 12ВСТУП
Наряду з білками і жирами вуглеводи є джерелом енергії. Вони забезпечують організм людини 55 – 60% всієї утилізованої енергії. Насамперед енергетичну функцію несуть глюкоза, цукроза, крохмаль і глікоген.
Але й так звані не перетравлювані вуглеводи – целюлоза, геміцелюлоза, пектинові речовини – також мають важливе значення в харчуванні. Харчові волокна стимулюють перистальтику шлунково-кишкового тракту, адсорбують токсичні речовини і холестерин, забезпечують оптимальні умови для життєдіяльності нормальної мікрофлори кишківника.
Вуглеводи взаємодіють в печінці з багатьма отруйними сполуками, перетворюючи їх в нешкідливі легкорозчинні речовини. Тим самим вони виконують структурно-пластичну і захисну функції.
Особливо велика кількість вуглеводів потрібна нашому мозку, але це не означає, що необхідно в необмежених кількостях споживати цукор у всіх його видах.
Вуглеводи можна розділити на дві групи:
– комплексні вуглеводи, які містяться в натуральних продуктах;
– ізольовані або концентровані вуглеводи, які були піддані хімічній обробці (рафінований цукор, солодощі).
Нашому організму, як і нашому мозку, корисні лише комплексні вуглеводи. Вони надходять в організм лише через їжу. Завдяки великій кількості структурних елементів ці вуглеводи мають довгі молекулярні ланцюги, для засвоєння яких потрібен досить тривалий час. Саме тому вони не потрапляють зразу в кров у великій кількості.
Слід зазначити, що організм потребує визначеної кількості корисних речовин. Надмірне споживання вуглеводів призводить до підвищеного рівня цукру в крові (надлишкове навантаження на підшлункову залозу), частина їх не може бути використана організмом і йде на утворення жиру. Надлишок жиру спричиняє розвиток атеросклерозу і пов’язаних з ним серцево-судинних захворювань. Крім того, підвищується алергічна чутливість організму.
Недостатня кількість вуглеводів в раціоні харчування призводить до зниження маси тіла. Але слід враховувати, що в разі виключення з раціону харчування вуглеводів, організм в якості джерел енергії починає використовувати жити і білки, в результаті чого порушуються обмінні процеси.
В залежності від того, що ми їмо, в наш організм надходять два різних види вуглеводів: більш прості швидкорозчинні і полісахариди. Якщо близько половини калорій, що отримує організм за добу, повинно відводитися на вуглеводи, то з них не більше 1/5 – на прості вуглеводи.
Злаки, овочі, картопля і горіхи забезпечують наш організм достатньою кількістю складних вуглеводів. Це дозволяє не лише забезпечити головний мозок оптимальним харчуванням, а й знизити ризик виникнення захворювань цивілізації – інсульту, ішемічної хвороби серця, атеросклерозу, діабету та деяких видів ракових захворювань. Для цього потрібна ще одна умова – їжа повинна містити як можна менше жиру.
До найважливіших видів вуглеводів відносяться:
– моносахариди – глюкоза (виноградний цукор), фруктоза, галактоза. Вони прості, швидкорозчинні, зразу ж переходять в кров. Містяться в меді, фруктах і овочах.
Клітини мозку і червоні кров'яні тільця для задоволення потреби в енергії орієнтовані лише на глюкозу. Наш мозок потребує в десять разів більше глюкози, ніж інші органи. Добова потреба мозку в глюкозі становить приблизно 150г, а це близько 1/4 всієї кількості даного вуглеводу, який ми отримуємо протягом доби з їжею.
Але якщо в організмі тимчасово недостатня кількість глюкози, печінка в змозі сама створювати цю життєво необхідну речовину, вона завжди напоготові акумулювати глікоген. Таке новоутворення глюкози з глікогену має назву глюконеогенез.
– дисахариди – цукроза (тростинний цукор, буряковий цукор), лактоза (молочний цукор), мальтоза (солодовий цукор). Вони не складні. Для їх перетравлювання потрібний більш тривалий час ніж для моносахаридів, але значно менший ніж для полісахаридів. Дисахариди містяться в молочних продуктах, пивному суслі і продуктах з рафінованого цукру.
– полісахариди для нашого організму більш значимі ніж моно- і дисахариди. Продукти харчування, в яких присутні полісахариди, додатково містять в своєму складі вітаміни, мінеральні речовини, мікроелементи і білки. Велика кількість полісахаридів міститься у волокнах рослин. До полісахаридів відносяться крохмаль і глікоген, достатня кількість яких присутня в картоплі, зернових культурах, м’ясі, печінці. Для їх перетравлювання потрібний тривалий час, тому вони вважаються довготривалими джерелами енергії. Завдяки їм підтримується постійний рівень цукру в крові, а мозок регулярно підживлюється.
1 ЗАГАЛЬНІ ПОЛОЖЕННЯ, НОМЕНКЛАТУРА ПОЛІСАХАРИДІВ
Полісахариди – це високомолекулярні сполуки з класу вуглеводів. Вони складаються з залишків моносахаридів, зв’язаних глікозидними зв'язками. Молекулярні маси полісахаридів коливаються в межах від декількох тис. (ламінарин, інулін) до декількох млн. (гіалуронова кислота, глікоген) і можуть бути визначені лише орієнтовно, оскільки індивідуальні полісахариди являють собою суміші компонентів, що різняться ступенем полімеризації.
Хімічна класифікація полісахаридів враховує будову моносахаридів, які входять до їх складу. Це гексози (глюкоза, галактоза, манноза), пентози (арабіноза, ксилоза), а також аміноцукри (глюкозамін, галактозамін), дезоксицукри (рамноза, фукоза), уронові кислоти та ін. До гідроксильних (–ОН) і аміногруп (–NH2) моносахаридів в молекулах природних полісахаридів можуть бути приєднані залишки кислот (оцтової, піровиноградної, молочної, фосфорної, сірчаної) або спиртів (зазвичай метилового).
Класифікація полісахаридів за походженням. Полісахариди можуть бути рослинного, тваринного, бактеріального та іншого походження. Крім того полісахариди рослинного походження можуть отримувати як з наземних рослин так і з водоростей. Полісахариди з наземних рослин вилучають з насіння рослин, плодів рослин і безпосередньо з самих рослин. Тваринні полісахариди відносять до групи зоогліканів, рослинні – до групи фітогліканів.
Гомополісахариди побудовані із залишків лише одного моносахариди (наприклад, глюкани, фруктани).
Гетерополісахариди побудовані із залишків двох і більше різних моносахаридів (наприклад, арабіногалактани, глюкуроноксилани).
Полісахариди можуть мати як лінійну так і розгалужену структуру (рис.1)
Лінійні полісахариди мають вид ланцюга (рис.1а). Таку структуру мають целюлоза, амілоза, мукополісахариди.
Розгалужені полісахариди можуть мати структуру двох типів (рис.1б,в). Маннани дріжджів і камеді рослин побудовані по типу б, а глікоген, амілопектин і галактан з виноградного равлика Helix pomatia – по типу в.
Тип структури полісахаридів в значній мірі визначає їх фізико-хімічні властивості, наприклад розчинність у воді. Такі лінійні регулярні (ті, що мають один тип міжмоносахаридного зв’язку) полісахариди, як целюлоза і хітин, нерозчинні у воді. В них енергія міжмолекулярної взаємодії більша ніж енергія гідратації. Високорозгалуджені полісахариди з невпорядкованою структурою добре розчиняються у воді.

Рис. 1 Структури полісахаридів:
а – лінійна; б,в – розгалужені; М - моносахарид
Хімічні реакції, в яких приймають участь полісахариди, такі ж як і для моносахаридів. Тільки ступінь протікання їх для полісахаридів, як правило, нижче. Це реакції окислення гідроксильних і відновлення карбоксильних, а також введення нових груп та ін. Хімічно модифіковані полісахариди часто характеризуються новими, цінними для практики властивостями, які були відсутні у вихідних сполук.
Більшість полісахаридів стійкі до дії лугів; при дії кислот протікає їх деполімеризація – гідроліз. В залежності від умов проведення кислотного гідролізу отримують моносахариди або олігосахариди. Гідроліз молекул гетерополісахаридів, які містять різні за кислотостійкістю типи глікозидних зв’язків, протікає селективно.
Біологічні функції полісахаридів різноманітні. Крохмаль і глікоген – резервні полісахариди рослин і тварин; целюлоза рослин і хітин комах і грибів – опорні полісахариди; гіалуронова кислоти, присутня в оболонці яйцеклітини і скловидному тілі ока, - високоефективний «замазочний матеріал»; камеді рослин і капсульовані полісахариди мікроорганізмів виконують захисну функцію; високосульватований полісахарид гепарин – інгібітор звертання крові. Фрагменти полісахаридів в змішаних вуглеводневих біополімерах (глюкопротеїдах, ліпополісахаридах), які присутні в поверхневому шарі клітини, обумовлюють специфічні імунні реакції організму. Позаклітинні полісахариди та інші вуглеводневі біополімери забезпечують міжклітинну взаємодію, скріплення клітин рослин (пектинові речовини) і тварин (гіалін).
В живих організмах полісахариди виступають основними резервами енергії. Вони розщеплюються внутрішньо - і міжклітинними ферментами з утворенням моносахаридів та їх похідних, які далі розпадаються з вивільненням енергії. Накопичення і розпад глікогену в печінці людини і вищих тварин – спосіб регулювання рівня глюкози в крові.
Полісахариди широко застосовуються в різних галузях промисловості: хімічній, харчовій, в медицині та ін.
Використання полісахаридів в харчовій промисловості. Полісахариди використовуються як харчові добавки в харчовій промисловості в якості гелеутворювачів, згущувачів, стабілізаторів водно-жирових емульсій та ін. Їм надано «Е» кодифікацію, а саме:
– полісахариди з бурих водоростей (Е400 – альгінова кислота; Е401 – альгінат натрію; Е402 – альгінат калію; Е403 – альгінат амонію; Е404 – альгінат кальцію);
– полісахариди з червоних морський водоростей (Е407 – карагінани);
– полісахариди з найбільш дорогих водоростей таких, як анфельція, геллідіум, граціллярія, еухеум ( Е406 – агар-агар, агароїд);
– камеді рослинного походження (Е410 – камедь рожкового дерева; Е411 – вівсяна камедь; Е412 – гуарова камедь або гуаран; Е413 – камедь трагаканта; Е 414 – гуміарабік; Е416 – камедь карайі; Е417 – тари камедь; Е418 – гелланова камедь; Е419 – гхаті камедь; Е425 – конжакова камедь та ін.);
– камеді бактеріального походження (Е415 – ксантанова камедь, або ксантан);
– пектини (Е440);
– крохмалі (Е1400);
– целюлоза і її похідні (Е460і – целюлоза дрібнокристалічна; Е460іі – целюлоза порошкоподібна; Е461 – метилцелюлоза; Е462 – етилцелюлоза; Е463 – гідроксипропілцелюлоза; Е464 – гідроксіпропілметилцелюлоза; Е465 – метилетилцелюлоза; Е466 – карбоксиметилцелюлоза; Е467 – етилгідроксицелюлоза; Е468 – кроскамелоза; Е469 – карбоксиметилцелюлоза ферментована).
Слід зазначити, що полісахариди використовуються в якості харчових добавок функціонального призначення як індивідуально так і в сумішах. Комплекси харчових стабілізаторів (згущувачів) являють собою складні суміші полісахаридів, кожен з яких впливає на властивості кінцевого продукту. Регулюючи співвідношення полісахаридів в сумішах можна регулювати властивості композиції в цілому, що дозволяє створювати різні комплекси для різних потреб. Використання ефекту синергізму – є одним з найбільш ефективних підходів до створення високоефективних, селективних, функціональних систем в технології харчових продуктів. Показники суміші полісахаридів – гелеутворювачів, які визначають ступінь і природу синергізму, наступні: диспергованість сухих порошків у воді в розчинах; рН систем; в’язкість систем; в’язкість систем після термообробки; органолептичні показники системи; наявність синерезису в системах; структурно-механічні показники систем; концентрація гелеутворювачів і добавок (за наявності останніх).
Знаходження полісахаридів в природі і їх вплив на організм людини. Основні групи полісахаридів, що споживаються людиною припадають на рослинні:
– фруктоолігосахариди(ФОС) містяться в багатьох рослинах (наприклад в коренеплодах топінамбура). Вони приймають участь в нормалізації кровяного тиску, сприяють зниженню рівня холестерину і ліпідів в крові. В кишківнику фруктоолігоцукридами харчуються біфідобактерії;
– целюлоза – це тверда частина волокон рослин, нерозчинна у воді. Призначення целюлози, яка входить до складу БАД, сприяти перистальтиці кишківника. Целюлоза адсорбує відходи метаболізму, які виводяться з організму разом з нею. До складу біодобавок зараз вводять штучно отримувану мікрокристалічну целюлозу;
– пектини (пектинові речовини) – це харчові волокна. Присутні практично у всіх наземних рослинах і водоростях. Це речовин, здатні утворювати студні. Сировиною для виробництва пектинів слугують яблучні вижимки, цукровий жом та ін. властивість пектинів набрякати дозволяє використовувати їх в якості продукту, що покращує роботу шлунково-кишкового тракту. Пектини зв’язують і виводять з організму токсичні речовини, в тому числі важкі метали (наприклад, ртуть з нирок);
– галактани – розчинні полісахариди. Вони містяться у вівсі. Набрякаючи, вони зв’язують жовчні кислоти і виводять їх з організму, понижуючи тим самим рівень холестерину в крові. Вони виводять з організму й інші продукти обміну, токсичні речовини, регулюють рівень цукру в крові;
– камеді (гуммі) – це затверділий сік дерев, в тому числі й фруктових (абрикоса, вишня черешня). При їх розчиненні утворюється клейкий колоїдний розчин, що дозволяє використовувати їх при лікуванні гастритів, колітів, ентероколітів, виразках кишківника;
– слизі використовуються в тих же випадках, що й пектини і камеді. Вони містяться у вівсянці, рисі, перловій крупі, насінні льону та ін.
– крохмаль складається з глюкозних залишків і має обволікаючу дію. Вівсяні і рисові відвари, що містять багато крохмалю, обволікають запалені тканини шлунку і кишківника, захищаючи їх від дратівливих речовин і зменшуючи всмоктування токсинів. Крохмаль стимулює синтез вітаміну В6 бактеріями товстого кишківника, гальмує процес підвищення рівня цукру в крові. На крохмаль припадає до 80% всіх вуглеводів, що споживає людина.
Функціональні властивості. Структурні полісахариди придають стінкам клітин міцність, водорозчинні полісахариди запобігають процесу висихання клітин, а резервні полісахариди за необхідності розщеплюються на моносахариди і використовуються організмом.
Виділення полісахаридів. Методи виділення полісахаридів залежать від їх властивостей, насамперед розчинності. Розчинність полісахаридів у воді різна, тому розчинні полісахариди можна вилучати екстракцією водою або кислими чи лужними розчинами. Якщо ж полісахариди практично нерозчинні у воді, значно легше вилучити супутні речовини. Таким чином проводять процес при виділенні целюлози і хітину, які характеризуються високою хімічною стійкістю.
Номенклатура полісахаридів Єдиної систематичної номенклатури полісахаридів не існує. Найчастіше для позначення полісахаридів використовується раціональний принцип, який полягає в тім, що за основу береться назва моносахаридів, які являють основу даного полісахариду і закінчення «оза» замінюється на «ан». Наприклад, полісахариди, побудовані з D-глюкози називаються D-глюкозанами, з D-галактози – D-галактанами. Полісахариди, які містять в своєму складі L-арабінозу і D-галактозу мають назву L-арабіно-D-галактан.
З залежності від наявності α- або β-глікозидних зв'язків перед назвою ставиться відповідна літера (наприклад, α-D-галактан.
Разом з раціональними назвами часто користуються й іншими. Наприклад, поліуронідами називаються полісахариди, побудовані із залишків уронових кислот; геміцелюлозами – полісахариди, які супроводжують целюлозу.
Іноді назва зовсім не підпадає під будь-який раціональний принцип, як мукополісахариди, що містять в своєму складі аміноцукри і уронові кислоти. Їх назва виникла раніше, ніж коли стали відомими самі структурні одиниці.
Назва полісахариду може бути пов’язана з джерелом його виділення: нігеран – з гриба Aspergillus niger, одонталан – з водорості Odontalia corymbifera.
Для багатьох полісахаридів до цих пір використовують давні емпіричні назви: для деяких гомогліканів – глікоген, крохмаль, клітковина, хітин; для гетерогліканів – хондроітин, пектин, гепарин, гілуаронова кислота та ін.
КОНТРОЛЬНІ ЗАПИТАННЯ
1. Які сполуки відносять до групи полісахаридів?
2. За якими ознаками полісахариди поділяють на групи?
3. На які групи поділяють полісахариди за походження?
4. В чому основна відмінність між гетеро- і гомополісахаридами?
5. Які особливості структури лінійних і розгалужених полісахаридів?
6. Які основні функції полісахаридів?
7. В чому полягає основна відмінність між фітогліканами і зоогліканами?
8. Основу якої групи «Е» добавок складають полісахариди?
9. Основні методи виділення полісахаридів. На яких властивостях полісахаридів вони базуються?
10. Як відрізняється назва полісахаридів від назви моносахаридів, які входять до її складу?
ТЕХНОЛОГІЯ ПЕКТИНУ І ПЕКТИНОВИХ ПРОДУКТІВ
Пектинові речовини, як полісахаридний компонент рослинної сировини, відкриті італійським вченим Браконно в 1825 році. Свою назву вони отримали від грецького слова «pectos», що значить «застигаючий». В 19 столітті і першій половині 20 століття були проведені дослідження хімічної будови пектинових речовин, розроблені методи визначення їх кількісного вмісту в плодах, ягодах і коренеплодах.
У відповідності до сучасних уявлень пектин має лінійну структуру. Основою пектинових речовин є молекулярний ланцюг із залишків D-галактуронової кислоти, які мають піранозну конфігурацію і з’єднані 1,4-α-глікозидним зв’язком (рис.2,а).
Використовують й інший спосіб зображення молекули пектину, в якому окремі кільця повернуті відносно одне одного і лежать в різних площинах (рис.2,б).
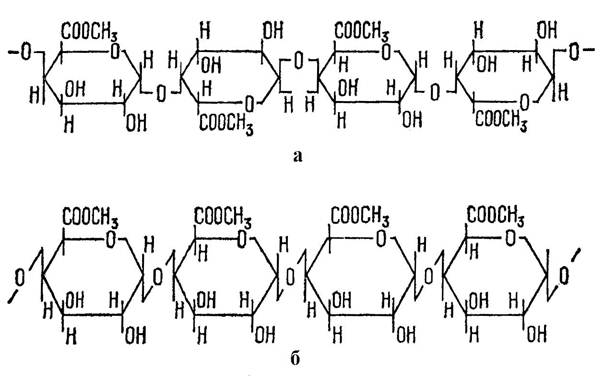
Рис.2 Структурна формула пектину
Пектинові речовини поділяють на декілька основних груп.
Перша група - пектинові речовини (pectin substances) – фізичні суміші пектинів з супутніми речовинами (наприклад, пентозанами і гексозанами).
Друга група – пектин (pectin) – водорозчинна речовина (вільна від целюлози), яка складається з частково або повністю метоксильованих залишків полігалактуронової кислоти. В залежності від кількості метоксильних груп і ступеню полімеризації існують різні пектини:
– Н-пектин (Н-pectin) – високоетерифікований пектин, який має ступінь етерифікації (відношення числа етерифікованих карбоксильних груп на кожні 100 карбоксильних груп пектинової кислоти у відсотковому вираженні) більше 50%;
– L- пектин (L-pectin) – низькоетерифікований пектин, який має ступінь етерифікації менше 50%.
Третя група – протопектин (protopectin) – нерозчинний у воді природний пектин рослин, який складається в основному з сітки пектинових ланцюгів, утворених в результаті з'єднань іонів багатовалентних металів з неетерифікованими групами –СООН з утворенням іонних містків і, в незначній кількості, за допомогою ефірних містків з Н3РО4.
Четверта група – пектові кислоти (pectic acid) – повністю деметоксильовані пектини з незайманим ланцюгом. Солі пектинових кислот називаються нормальними або кислими пектатами (pectates).
П’ята група – пектинові кислоти (pectin acid) – високомолекулярні полігалактуронові кислоти, незначна частина карбоксильних груп яких етерифікована метиловим спиртом. Солі пектинових кислот називають нормальними або кислими пектин атами (pectinates).
Шоста група – похідні пектину – пектини, зв’язані по головним валентностям з різними групами, наприклад, ацетилпектин.
Основною структурною ознакою пектинових речовин є лінійні молекули полігалактуронової кислоти, в якій мономерні ланцюги зв’язані α 1→4 глікозидним зв’язком. Мономер має конфігурацію С1, тому глікозидні зв’язки являються діаксиальними. У пектинів цукрового буряка, соняшника, картоплі, груші в деяких мономерних ланцюгах галактуронану спиртові групи в положеннях С2 і С3 ацетильовані.
Гетерополісахаридний характер пектину обумовлений присутністю трьох структурних одиниць:
– пектової кислоти;
– галактану;
– арабінану.
Пектова кислота, крім D-галактуронової кислоти, містить нейтральні цукри: L-арабінозу, D-галактози, L- рамнозу.
Властивості пектину
Розчинність. Найкращим розчинником пектинових речовин є вода. У водному розчині пектинова молекула має форму спіралі, карбоксильні групи якої розміщені в сусідніх витках (рис.3)
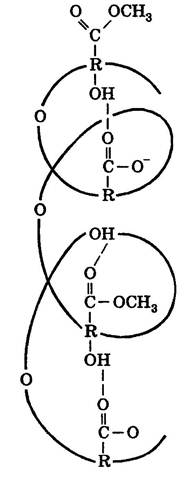
Рис.3 Просторова структура молекули пектину
Карбоксильні групи пектину здатні до дисоціації. Константа дисоціації пектинових речовин, які є поліелектролітами, коливається в межах від 0,1·10-4 до 10 ·10-4. Константа дисоціації тим менша, чим вища густина заряду нитковидної молекули і чим більша іонна сила. При високому ступеню дисоціації карбоксильних груп в результаті взаємодії однойменно заряджених електричних центрів, спіральна конформація молекул пектинових речовин порушується, їх лінійні розміри збільшуються. Водним розчинам пектинових речовин, як і золям інших ліофільних колоїдів, властива висока відносна в’язкість, а також структурна або аномальна в’язкість. Відносна в’язкість різко зростає при збільшенні концентрації розчину пектинових речовин.
Пектинові речовини також добре розчиняються в 84% – вій фосфорній кислоті і в рідкому аміаку; в гліцерині і формаміді вони набрякають. В багатьох інших органічних і неорганічних розчинниках вони практично нерозчинні.
Розчинність пектину залежить від ступеню його полімеризації і ступеню етерифікації. Розчинність пектину у воді збільшується при збільшенні ступеню етерифікації і зменшенні молекулярної маси. З двох пектинів легше розчиняється пектин з меншою довжиною ланцюга, але з більшою кількістю метоксильних груп. Пектини із ступенем етерифікації 66% добре розчинні у воді, а зі ступенем етерифікації до 39,6% - малорозчинні.
Для отримання однорідного розчину необхідно порошок пектину попередньо перемішати з цукром, або змочити спиртом. Без такої підготовки при кімнатній температурі можна отримати водні розчини з вмістом пектинових речовин не більше 3%.
Зручний спосіб розчинення порошку пектину з використанням змішувача із швидкістю обертання мішалки 20 – 30 об./хв.
Змішаний у сухому вигляді з 5 частинами цукру тонкоподрібнений пектин легко розчиняється у воді. Щоб пектин розчинився повністю, рекомендується прокип’ятити суспензію протягом 1 хвилини. Оскільки розчинення пектину ускладнюється при збільшенні вмісту розчинних сухих речовин, більшу частину цукру в рецептуру слід додавати лише після розчинення пектину.
Пектинові речовини оптично активні, їм також властива здатність до подвійного заломлення променю світла. Із зменшенням довжини пектинової молекули під дією ферментів або лугів, подвійне заломлення зменшується. При очищенні пектину і нейтралізації карбоксильних груп, подвійне заломлення збільшується до тих пір, доки не відбудеться коагуляція системи.
В’язкість. Підвищена в’язкість – одна з характерних властивостей водних розчинів пектинових речовин, які є ліофільними колоїдами. Молекули пектину в розчині легко асоціюються або між собою, або з великими молекулами супутніх речовин.
Будучи високомолекулярними речовинами, пектини не дифундують з розчинів через клітинні мембрани рослин. Ця властивість використовується для відділення пектинових речовин від низькомолекулярних речовин, наприклад в процесі дифузії бурякового цукру. Обмежена здатність до дифузії може і повинна бути використаною у виробництві пектину, а саме: в процесах концентрування і нормалізації середовища пектинових розчинів. Це дозволить знизити витрати хімічних реагентів і отримати цільові продукти з високим вмістом пектинових речовин.
Молекули пектину у воді піддаються сольватації, тобто навколо них утворюється рідинний шар, більш щільний в перших шарах, і рихлий на ділянках, віддалених від частинок пектину. Взаємне розміщення пектинових молекул в обводнених структурах може змінюватися в широкому діапазоні в залежності від хімічної природи розчинника, впливаючи при цьому на в’язкість колоїду.
Розрізняють наступні види в’язкості:
– абсолютну [ɳ];
– відносну [ɳ відн];
– питому [ɳ пит];
– приведену [ɳ пр].
Для пектинових речовин характерна також структурна або аномальна в’язкість. В’язкість водних розчинів пектинів залежить від різних чинників:
– концентрації;
– довжини молекулярного ланцюга;
– ступеню етерифікації;
– присутності електролітів;
– температури.
Із збільшенням молекулярної маси пектину при інших постійних умовах в’язкість збільшується. При однаковій молекулярній масі в’язкість зростає із збільшенням електричного заряду макромолекули, який визначається кількістю вільних карбоксильних груп.
Висока відносна в’язкість [ɳ відн] обумовлена явищем сольватації.
При зміні виду розчинника і температури рівновага між сольватацією ланцюгових молекул пектину та їх взаємною асоціацією зміщується в той чи інший бік. При підвищенні температури в’язкість зменшується внаслідок руйнування суперструктури пектинових речовин. При збільшенні взаємної асоціації молекул пектину при додаванні цукру або спирту утворюються стійкі агрегати молекул – золь переходить в гель.
Структурування під час застигання пектинових гелів протікає безперервно і супроводжується поступовим збільшенням відносної в’язкості системи. При цьому різні цукри впливають на в’язкість по-різному. Глюкоза, мальтоза і сахароза збільшують приведену в’язкість [ɳ пр] пектинових розчинів, в той час як декстрини її понижають. Збільшення в’язкості є обов’язковим при формуванні просторових агрегатів між пектиновими молекулами.
В’язкісні властивості пектинів також залежать від вмісту метоксильних груп в їх молекулі. Поведінка пектинів з вмістом метоксильних груп в діапазоні 20 – 50% аналогічна поведінці високомолекулярних речовин. Пектини з вмістом метоксильних груп більше 50% проявляють в розчинах властивості, характерні високомолекулярним сполукам.
Визначення в’язкості пектинових розчинів використовують для характеристики молекулярної маси пектинових речовин.
В’язкість розчинів пектину розраховують за формулами:
– відносна в’язкість ɳ відн = τ/τ1,
де τ – час витікання через віскозиметр досліджуваного розчину; τ1 – час витікання розчинника;
– питома в’язкість ɳ пит = ɳ відн – 1;
– приведена в’язкість ɳ пр. = ɳ пит./С,
де С – концентрація пектину в 100мл розчину, г.
Абсолютну або характеристичну в’язкість розчину [ɳ] визначають графічним способом. На осі ординат відкладають значення приведеної в’язкості [ɳ пр], на осі абсцис – концентрацію пектину [С] в 100мл розчину. Відрізок, який відсікає пряма на осі ординат, дає величину абсолютної в’язкості.
Гнучкість пектинових ланцюгів. Пектинові молекули мають переважно нитчасту структуру і відносяться до лінійних колоїдів з довжиною молекули ~ 10-5см. У водних розчинах молекула пектину приймає форму спіралі. Таку конформацію зазвичай приймають макромолекули, в яких дальній конфірмаційний порядок у вигляді спіралі іммобілізований, наприклад водневими зв'язками. Конфірмаційні характеристики визначають таку важливу для полімерів властивість як гнучкість ланцюга, тобто здатність змінювати свою конформацію в результаті внутрішньо молекулярного теплового руху, або внаслідок дії зовнішніх сил. Радіус обертання пектинової молекули, що має транс конформацію, у водних розчинах дорівнює 3200А. За термодинамічною гнучкістю пектинова молекула відноситься до напівгнучких полімерів. У водних розчинах пектини являють собою напівгнучку макромолекулу, що має конформацію спіралі з постійним поперечним перетином. При цьому карбоксильні групи розміщуються одна над одною. Локальна гнучкість пектинового ланцюга визначається її довжиною: причому чим більша довжина ланцюга, тим більша її гнучкість. На гнучкість пектинової молекули крім довжини впливають також: молекулярна маса, величина негативного заряду дисоційованих карбоксильних груп і сила електростатичного відштовхування.
Поліелектролітичні властивості. Завдяки присутності в молекулі уронових кислот, пектини є поліелектролітами. Електростатичні властивості частинок пектинових речовин визначаються величиною негативного заряду, який є функцією ступеню етерифікації карбоксильних груп пектової кислоти.
Електростатичні властивості пектинової молекули залежать від вмісту метоксильних і вільних карбоксильних груп, а також довжини пектинового ланцюга або ступеню полімеризації. Пектові кислоти з низьким вмістом метоксильних груп характеризуються високою чутливістю до електролітів. Із збільшенням вмісту карбоксильних груп в пектиновій молекулі і ступеню полімеризації її чутливість до електролітів також збільшується.
Додавання електролітів до золів пектинів майже не змінює їх здатність до утворення структурованих гелів.
При змішуванні водних пектинових розчинів з полярними органічними розчинниками (ацетон, спирт) пектин виділяється у вигляді коагульованого осаду. Ця властивість використовується як у виробництві, так і в лабораторній практиці для очищення і фракціонування пектинових препаратів.
Іонна селективність. Спорідненість катіонів до карбоксильних груп пек татів змінюється в ряду: кальцій < стронцій << магній. Пектинові речовини зв’язують в 2 рази більше кальцію ніж магнію. Це можна пояснити тим, що по карбоксильних групам іони Са2+ утворюють стійку структуру, так звану «решітку для яєць» (рис.4)
В цій моделі іони Са2+приймають участь в дев’яти координаційних зв’язках: з двома атомами кисню з глікозидних зв’язків, з двома атомами кисню з кілець, з двома кислотними залишками і з трьома спиртовими групами.
Іонна селективність залежить від ступеню етерифікації пектину. Встановлено, що утворення комплексів пропорційно кількості вільних карбоксильних груп. Низькометоксильований пектин сорбує іони в ряду мідь > цинк > кадмій.
Дія кислот і лугів. Під дією кислот природний протопектин розчиняється навіть при низьких температурах.
Під дією сильних мінеральних кислот пектова високоетерифікована кислота вже при кімнатній температурі гідролізується. При підвищенні температури процес прискорюється. Причому швидкість процесу кислотного гідролізу може збільшуватися настільки, що починає переважати деградація пектину.

Рис.4 Модель коплексоутворення пектину «решітка для яєць»
Встановлено, що в пектиновому екстракті, отриманому з сушеного бурякового жому, при температурі 78 – 800С і рН 0,8 – 1,0 протягом 12 годин відбувається повна деградація пектинових речовин.
Гідроліз ефірних груп каталізується не лише кислотами а й лугами. При обережному додаванні гідроксиду калію або натрію до розведених пектинових розчинів утворюються кислі, а потім нейтральні пектати.
Дія ферментів. Розщеплення пектинових речовин під дією ферментів має велике практичне значення. Воно широко використовується при переробці плодів цукрового буряка, а також при освітленні соків і вин.
Як відомо, під дією ферментів класу гідролаз реакції протікають за наступною схемою: RR1 + НОН ↔ RН + R1ОН
В процесі ферментативного гідролізу утворюється фермент-субстратний комплекс, в якому протікає внутрішньомолекулярне перегрупування під впливом активного центру ферменту.
Каналізоване розривання ангідридного зв’язку субстрату призводить до виділення з фермент-субстратного комплексу одного з продуктів реакції. Другий продукт виділяється після перегрупувань, пов’язаних з приєднанням молекули води.
В процесі ферментного гідролізу пектинових речовин приймають участь: пектин-естераза, ендополігалактуроназа, екзополігалактуроназа.
Негідролітичне розщеплення пектину каналізують ферменти класу ліаз – пектинтранселімінази.
Комплексоутворююча здатність. Однією з найважливіших властивостей пектинових речовин є здатність до коплексоутворення, яка базується на взаємодії молекули пектину з іонами важких і радіоактивних металів. Ця властивість дає підстави рекомендувати пектин для включення в раціон харчування осіб, які знаходяться в середовищі, забрудненому радіонуклідами і контактують з важкими металами.
Для організму людини особливо небезпечні довгоживучі ізотопи цезію (Cs137), стронцію (Sr90), ітрію (І91) та ін. Екскреція пектину по відношенню до введеної дози цезію складає 8,4%, стронцію – 52,6%.
Комплексоутворюючі властивості пектинових речовин залежать від вмісту вільних карбоксильних груп, тобто від ступеню етерифікації карбоксильних груп метанолом. Ступінь етерифікації визначає лінійну густину заряду макромолекули, і як наслідок силу і спосіб зв’язку катіонів.
При високому ступеню етерифікації пектину (більше 90%) вільні карбоксильні групи, в які включені атоми С6, в значній мірі віддалені один від одного. При цьому кальцієві або стронцієві солі пектинової кислоти практично повністю дисоціюють із зменшенням ступеню етерифікації, тобто при збільшенні заряду макромолекули зв'язок пектинових речовин з катіонами зростає, а константа стабільності пек татів збільшується. При ступеню етерифікації 40% відбувається зміна конформації, що призводить до агрегатування пектинових макромолекул і утворення міцного халатного зв’язку.
Комплексоутворююча здатність не залежить від молекулярної маси пектину і визначається коефіцієнтом селективності катіонного обміну, який є характеристикою насичення пектинових речовин двовалентним катіоном. Вказаний коефіцієнт для Cu2+, Pb2+, Со2+, Sr2+, Са2+ відповідно дорівнює: 3300, 2580, 241, 120, 121.
Дослідження сорбційної здатності пектової кислоти показали, що катіони за комплексоутворюючою здатністю або «активністю» розміщуються в ряд: Mn2+ > Cu2+ > Zn2+ > Co2+ > Pb2+ > Ni2+ > Ca2+ > Mg2+ > Cd2+. Така послідовність пояснюється тим, що катіони двовалентного марганцю, міді, кобальту, нікелю окрім сполук типу R(COO)2Me утворюють сполуки іншого типу за рахунок взаємодії (крім карбоксильних) з оксигрупами макромолекул або за рахунок утворення солі типу R(COO)Me(OOCCH3).
Комплексоутворююча здатність пектину залежить від рН середовища. При різних значеннях рН пектинові речовини мають різні значення комплексоутворюючою здатності. Оптимальне значення рН середовища, при якому відбувається максимальне коплексоутворення, для кожного типу пектину індивідуальне і залежить від виду сировини.
Суттєво впливає на комплексоутворюючу здатність парний ефект пектину і солі важкого металу. Одночасне зниження концентрації пектину в розчині при збільшенні концентрації важкого металу в ньому призводить до значного збільшення константи зв’язування.
Завдяки комплексоутворюючій здатності по відношенню до металів пектин є незамінною речовиною у виробництві продукції профілактичного і лікувального харчування. Оптимальна профілактична доза пектину складає не більше 2 – 4г на добу для людей, які контактують з важкими металами. Для тих людей, які перебувають в умовах радіоактивного забруднення, рекомендується добова норма пектину не менше 15 – 16г.
Здатність до утворення студнів. Не менш важливою властивістю пектинових речовин, яка визначає широкий спектр використання їх в харчовій промисловості, є здатність до утворення студнів. Ця властивість залежить від:
– молекулярної маси пектину;
– ступеню етерифікації його молекули і вмісту функціональних груп;
– концентрації цукру в розчині;
– кількості баластних речовин, супутніх даному пектину;
– температури;
– рН середовища.
Для того, щоб утворення студню було можливим, пектинова молекула повинна мати визначені розміри. Встановлено, що пектин з молекулярною масою від 150000 до 200000 характеризується високою здатністю до утворення студню.
В залежності від ступеню етерифікації молекули пектину розрізняють два види студнів – з побічною і основною валентністю, механізми утворення яких представлені на рис.5.
Кислотно-цукрові пектинові студні утворюються водневими зв'язками за участю недисоційованих вільних карбоксильних груп. Такий тип студнів характерний для високоетерифікований пектинів (рис.6).
Низькоетерифіковані пектини утворюють студні лише в присутності іонів Са2+ (рис.7). При цьому молекули пекти ну взаємодіють між собою за рахунок вільних карбоксильних груп, які зв’язуються іоном кальцію в міцний каркас. Такі студні називають іонозвязаними.
Крім вище зазначених основних типів, можливе утворення студнів проміжного типу. Вони містять і цукор і кальцієві іони. Такі студні характерні для пектинів із ступенем етерифікації 50%(для бурякового пектину).

Рис.5 Механізм утворення студнів:
а – низькометоксильованим пектином; б – високометоксильованим пектином
В залежності від умов, за яких утворюються студні, їх структура формується за участю різної кількості різноманітних зв’язків. Додана для утворення студня кислота: витісняє катіони з пектинової молекули; створює вільні карбоксильні групи; зменшує їх дисоціацію, нейтралізуючи електростатичні сили відштовхування між молекулами пектової кислоти.
Найбільш міцні студні утворюються в присутності лимонної, винної і триоксиглутарової кислот.
Цукор в процесі утворення студня виконує функцію дегідратуючої речовини. Здатність до гідратації у різних цукрі – сахарози, глюкози, мальтози різна і визначає характери їх впливу на в’язкість пектинових розчинів. Найбільша міцність студня досягається при додаванні сахарози, найменша – мальтози.

Рис.6 Структура студня високометоксильованого пектину
Для утворення міцного студня в трьохкомпонентній системі пектин – цукор – кислота необхідне їх оптимальне співвідношення, яке не має абсолютного характеру, а залежить від виду пектину. Саме вид пектину визначає межі співвідношення компонентів рецептурної суміші. На практиці оптимальним є приблизним співвідношення - пектин : цукор : кислота = 1 : 60 : 1.
Утворення студнів залежить від рН і температури процесу. Для високоетерифікованих пектинів максимальна міцність студня досягається при рН 3,0 – 3,3, а для низькоетерифікований – при рН 2,5 – 2,8. Зниження рН на 1/10 може призводити до підвищення оптимальної температури на 50С.

Рис.7 Структура студня низькометоксильованого пектину
Суттєво на процес утворення студнів впливає хімічна будова макромолекули пектину. Пектова кислота, в якої всі залишки галактуронової кислоти мають карбоксильні групи, нерозчинна у воді і не характеризується здатністю до утворення студня.
Присутність баластних речовин, зв’язаних з пектином валентними зв'язками, призводить до зміни конформації його молекули і негативно впливає на процес формування і міцність студня.
Емульгуюча і піноутворююча властивість. Пектин є поверхнево-активною речовиною і характеризується емульгуючою і піноутворюючою властивостями.
В’язкість емульсії пектину з жиром різко зростає із збільшенням концентрації емульгатора і жиру. Так, для 50% – вої емульсії з 0,5% бурякового пектину в’язкість дорівнює 4,8сПс, з 1% - 5880сПс. При збільшенні концентрації жиру в’язкість також збільшується. Наприклад, при збільшенні концентрації жиру з 50 до 55% в’язкість зростає з 4,8 до 13,5сПс.
Фізико-механічні і теплофізичні властивості. Вказані властивості для пектинів, отриманих з різної сировини, приведені в табл.1
Таблиця 1
Фізико-механічні і теплофізичні властивості пектинів
Види пектиновмісної сировини і її класифікація
Пектинові речовини існують в декількох формах: нерозчинній (протопектин) і розчинній в воді, вільній галактуроновій кислоті і її солей. Ці форми… Відомо, що пектинові речовини зустрічаються у всіх частинах рослин. Поділяти… До першої групи віднесені овочі:Таблиця 2
Вміст пектинових речовин в петиновмісній сировині
До першої групи віднесено сировину з високим вмістом галактуронової кислоти в… – апельсини (92,4%);Таблиця 3
Технологічні параметри процесу вилучення пектинових речовин з пектиновмісної сировини
Додатково необхідно відмітити, що пектиновмісну сировину класифікують також за такими двома властивостями як комплексоутворююча здатність і…Виробництво пектину з різних видів пектиновмісної сировини
Рис.8 Схема будови цитрусового плоду: 1 – флаведо; 2 – альбедо; 3 – сегменти; 4 – сокові мішечки; 5 – мембрани; 6 – серцевина; 7 – ефіровмісний шарТаблиця 4
Хімічний склад різних зон яблука, мг/г
Вміст пектинових речовин (%, до маси сухих речовин) розподіляється по зонам… – зона А – 4,7 ~ 5,2%;Таблиця 5
Хімічний склад різних зон яблука, мг/г
При цьому суттєво відрізняється також і фракційний склад пектинових речовин в різних зонах плоду. Вміст пектинових речовин в яблуках залежить від сорту і місця проростання.… Для отримання пектину використовують в основному вижимки середньоспілих і пізньоспілих сортів яблук. Встановлено, що й…Використання пектину в харчовій промисловості
На відміну від інших утворювачів студнів пектинові речовини утворюють студні у водних розчинах тільки в присутності цукру і кислоти. кількість… Маси для желейного мармеладу готують уварюванням пектино-цукрового розчину.… На процес утворення студню впливають:КОНТРОЛЬНІ ЗАПИТАННЯ
12. Які сполуки є основною структурною ознакою пектинових речовин? 13. В чому відмінність структури лінійних і розгалужених ділянок пектину? 14. Від яких чинників залежить розчинність пектину?ТЕХНОЛОГІЯ КРОХМАЛЮ ТА КРОХМАЛЕПРОДУКТІВ
Крохмаль, загальна формула якого – (С6Н10О5)n, один з найпоширеніших у природі вуглеводів. у певній кількості він накопичується у коренеплодах, зернах злаків, стовбурах рослин тощо. Крохмаль являє собою полімер глюкози і належить до групи полісахаридів.
У клітинах рослин крохмаль перебуває у вигляді зерен розміром 2 – 150мкм. Найбільші зерна крохмалю у картоплі (до 120мкм).
Кожному виду рослин властиво визначена форма зерен крохмалю. Так, зерна крохмалю з картоплі мають еліптичну форму, а з борошнистої частини кукурудзи – круглу, з рогоподібної частини кукурудзи – форму багатогранника.
Крохмаль має кристалічну структуру. Його зерна мають велику поверхню, зокрема 1кг картопляного крохмалю займає до 11м2 поверхні. Зерна крохмалю сильно адсорбують барвники та інші хімічні речовини.
Структура крохмалю
Крохмаль складається з двох структурно різних фракцій – амілози і амілопектину, а тому не є хімічно індивідуальною речовиною (рис.11).

Рис.11 Схема будови:
а – амілози; б – амілопектину (рисками визначено межі розщеплення β – амілазою)
Амілоза (рис.12) являє собою лінійний ланцюг глюкозидних залишків, зв’язаних α-1-4-глюкозидними зв'язками.

Рис.12 Структура молекули амілози
Ланцюг амілози може мати 100 – 1000 глюкопіранозних залишків, що відповідає молекулярній масі 32000 – 160000.
З йодом амілоза утворює темно-синю комплексну сполуку, де на один атом йоду припадає шість глюкозидних залишків. Найменший ступінь полімеризації, за якого йод дає синє забарвлення, дорівнює 6. За полімеризації менше 6 йод не змінює свій коричневий колір.
Амілоза більш розчинна у воді, ніж амілопектин, і з часом швидко випадає з водного розчину в осад у вигляді стійкого і важкорозчинного гелю. На цьому і ґрунтується метод відокремлення амілози від амілопектину.
Амілопектин ( рис.13) являє собою сильно розгалужену структуру ланцюга глюкозидних залишків. При цьому в лінійних частинах ланцюга глюкозидні залишки зв’язані між собою α-1-4-глюкозидними зв'язками, а в місцях розгалуження - α-1-6-глюкозидними зв'язками.

Рис.13 Структура молекули амілопектину
Ступінь полімеризації амілопектину становить 600 – 6000 глюкозидних залишків, а молекулярна маса може бути від 100000 до 1000000.
З йодом амілопектин дає фіолетове забарвлення. Він погано розчинний у воді. У розчині не випадає в осад і не переходить в гель.
Крохмаль і його фракції є чистими вуглеводами, проте в них можуть міститися деякі ефірнозв’язані речовини. Так, амілопектин картопляного крохмалю містить 0,2 – 0,25% фосфорної кислоти, а в зернах крохмалю кукурудзи завжди присутня незначна кількість фосфоліпідів, що утворюють гідролізний жир.
Властивості крохмалю
Фізичні властивості крохмалю. Питома вага абсолютно сухого картопляного крохмалю в середньому дорівнює 1,64г/см3, кукурудзяного – 1,65г/см3. Теплоємність абсолютно сухого крохмалю – 0,2697ккал/кг. Теплотворна здатність… У процесі нагрівання крохмальних суспензій, вода проникає в їх середину і збільшує об’єм. За збільшення об’єму у 80 –…Таблиця 6
Характеристика проміжних і кінцевих продуктів гідролізу крохмалю
Обробленням крохмалю кислотами в більш м'яких умовах для незначної деструктуризації крохмальної молекули можна одержати декстрини і модифікований…Технологія виробництва крохмалю з різної сировини
В процесі отримання крохмалю з картоплі головна задача полягає у якнайбільшому руйнуванні оболонки клітин картоплі та у подальшому очищенні… Технологічний процес виробництва картопляного крохмалю складається з наступних… - підготовка картоплі до перероблення;Виробництво модифікованих крохмалів і декстринів
Сухий крохмаль не повністю відповідає всім вимогам, які висуваються до нього як до харчової добавки в ряді технологічних процесів виробництва… Крохмалі, властивості яких змінені в результаті спеціальної обробки називають… – розщеплені, властивості яких змінені в результаті деполімеризації поліцукридних ланцюгів;Рис.15 Схема класифікації модифікованих крохмалів
Розщеплені крохмалі. Розщеплені крохмалі одержують термічною і механічною дією, обробленням поліцукриди кислотою, окисниками, амілазами, деякими солями, опромінюванням γ-променями, електронами, ультразвуком та іншими діями, які викликають розщеплення поліцукридних ланцюгів. У результаті відбувається спрямоване або хаотичне розщеплення глюкозидних, а інколи й інших валентних зв’язків. При цьому у поліцукридів зменшується розмір частинок і молекулярна маса, з'являються нові карбонільні й карбоксильні групи та внутрішньо й міжмолекулярні зв’язки. При цьому зерниста форма крохмалю не змінюється, а іноді відбувається часткове руйнування структури зерен крохмалю з утворенням іншої структури, наприклад під час клейстеризації та висушування крохмалю на вальцьових сушарках.
Клейстери розщеплених крохмалів мають нижчу в’язкість, вищу прозорість і підвищену стабільність при зберіганні. За високої концентрації гарячі клейстери розщеплених крохмалів мають низьку в’язкість, тому ці крохмалі називають рідкокиплячими.
Висока концентрація клейстерів з низькою в’язкістю підвищує ефективність їх використання в технологічних процесах хлібобулочних, кондитерських виробів та ін.
Крохмалі, модифіковані кислотою. Для модифікації крохмалю використовують соляну або сірчану кислоту. Суспензію нагрівають до температури нижче температури клейстеризації крохмалю. Витрати кислоти становлять 1 – 3% до маси крохмалю. Температура, за якої проходить реакція, дорівнює 45 – 500С. При цьому відбувається зміна структури крохмалю і його властивостей, знижується в’язкість клейстеру, підвищується розчинність крохмалю і прозорість клейстерів, а після охолодження концентрованих клейстерів утворюються тривкі драглі.
Кукурудзяний крохмаль, модифікований кислотою, використовують у харчовій промисловості для виготовлення желейних цукерок та східних солодощів.
Окиснені крохмалі. Модифіковані крохмалі цього типу виготовляють за допомогою різних окисників. Окислюють крохмаль у визначеній кількості води за різних значень рН. Для окиснення використовують гіпохлорити, перманганати, перекиси, йодну кислоту та її солі та інші сполуки. Під час дії на крохмаль окисників відбувається гідролітичне розщеплення глюкозидних зв’язків, окиснення спиртових у карбонільні, а потім – у карбоксильні. Ступінь окиснення залежить від витрат реагенту і умов проведення реакції. За своїми властивостями окиснені крохмалі подібні до крохмалів, модифікованих кислотою, і відрізняються здатністю утворювати стійкі драглі. Крохмалі, окиснені йодною кислотою, мають по дві альдегідні групи в глюкозному залишку. Такі крохмалі називають діальдегідними. Їм властива висока реакційна здатність. В харчовій промисловості використовують діальдегідні крохмалі низького ступеня окиснення (до 2%).
До окиснених крохмалів належить модифікований желеутворюючий крохмаль, який виготовляють обробленням картопляного чи кукурудзяного крохмалю перманганатом калію в кислому середовищі. Його використовують як желе в кондитерських виробах, як стабілізатор морозива, а також у концентрат ній і молочній промисловості.
Спеціальні види окиснених крохмалів використовують для покращення якості хліба. Як окисники використовують невеликі кількості бромату калію КBrO3, перманганату калію KMnO4 і гіпохлориту кальцію Ca(ClO)2·4H2O. Після завершення реакції відокремлюють крохмаль і рідку фазу; крохмаль промивають, центрифугують і висушують.
Використання окисненого крохмалю в хлібопекарському виробництві сприяє покращенню фізичних властивостей тіста.
Монокрохмалефосфати одержують нагріванням крохмалю з водорозчинними фосфатами, солями орто-, піро- або метафосфорної кислоти.
Для приготування дикрохмалефосфатів використовують триметилфосфат натрію, хлорокис фосфору, п'ятихлористий фосфор або тіохлорид фосфору.
Монокрохмалефосфати утворюють стабільні клейстери, які відрізняються високою прозорістю, стійкістю до заморожування і розморожування.
Дикрохмалефосфати також утворюють стабільні клейстери, стійкі до нагрівання і механічної дії. Ці клейстери мають низьку прозорість і нетягучу короткокраплинну консистенцію.
Фосфатний крохмаль марки А використовують у виробництві борошняних кондитерських виробів, марки Б – для виготовлення майонезів, підлив, кремів, соусів, дитячих і дієтичних харчових продуктів, для стабілізації та згущення харчових продуктів, які зберігаються у замороженому вигляді. Дикрохмалефосфати використовують як загусники і стабілізатори консервованих продуктів, які підлягають стерилізації.
Ацетильовані крохмалі. Для виготовлення ацетильованих крохмалів використовують льодяну оцтову кислоту, оцтовий ангідрид та інші реагенти. Ацетильований крохмаль не є хімічно однорідною сполукою, а являє собою суміш продуктів з різними властивостями. За максимального ступеня ацетилювання в кожному глюкозному залишку три гідроксидні групи утворюють ефірні зв’язки із залишками оцтової кислоти. Введення ацетильованих груп підвищує стабілізуючу дію крохмалю, затримує старіння клейстеру.
Крохмаль можна ацетилювати нагріванням суміші 25 – 100 частин льодяної оцтової кислоти з 100 частинами крохмалю і витримуванням при температурі 1000С протягом 5 – 13 годин. Кількість ацетильованих груп в такому модифікованому крохмалі буде 3 – 6%. Приготовлений ацетат крохмалю – зернистої форми, нерозчинний в холодній, але добре розчинний в гарячій (95 – 1000С) воді. Зайву кислоту відокремлюють від ацетату крохмалю промиванням в холодній воді. Крохмаль просушують.
У харчовій промисловості ацетати крохмалю низького ступеня заміщення використовують як загусники. Вони зберігають свої властивості за низьких значень рН, високих температур, стійкі до механічного впливу. Такі крохмалепродукти утворюють стійкі у зберіганні, заморожуванні і розморожуванні клейстери.
Для покращення структурно-механічних властивостей драглів ацетильовані крохмалі комбінують введенням в поліцукридні ланцюги поперечних зв’язків. Такі крохмалі використовують у виробництві консервованих, заморожених, випечених і сухих продуктів харчування, а також у сухих сумішах кремів і начинках.
Зшиті крохмалі. Поперечні зв’язки між поліцукридними ланцюгами крохмалю утворюють за допомогою таких напівфункціональних реагентів, як формальдегід, хлорокис фосфору, епіхлоргідрин і триметилфосфат натрію. Останні два реагенти використовують для виробництва зшитих крохмалів з метою використання у харчових продуктах. До зшитих крохмалів належить дикрохмалефосфат. Введення поперечних зв’язків сприяє зміцненню тривимірної сітки клейстерів крохмалю, підвищує їх стійкість до механічної дії, теплової обробки, знижує розчинність. Збільшення кількості поперечних зв’язків може зробити крохмаль нерозчинним у воді під час нагрівання.
Виробництво декстринів. Декстрини – це продукт неповного гідролізу крохмалю в процесі термічного оброблення в присутності каталізаторів або без них, коли в крохмалі зменшується довжина ланцюга глюкозних залишків. В результаті кислотного гідролізу розрив ланцюга може бути в будь-якому зв’язку ланцюга, тому декстрини являють собою різноманітну суміш вуглеводів різного ступеня полімеризації. – від глюкози і мальтози до амілодекстринів.
Як сировина для одержання декстринів використовується сухий картопляний або кукурудзяний крохмаль.
Як каталізатори, що прискорюють термічну деструкцію крохмалю, використовують легкі кислоти (наприклад соляну), луги, солі (наприклад алюмінієво-калієві галуни). Під час деструкції відбувається розщеплення α-1,4- і α-1,6-глюкозидних зв’язків поліцукридів крохмалю. Одночасно спостерігається відщеплення молекул води від глюкозидних залишків з утворенням ангідридів, що може призвести до утворення поперечних зв’язків між сусідніми ланцюгами поліцукридів. В процесі розщеплення поліцукридів зростають їх редукувальна здатність, розчинність і знижується в’язкість клейстерів. Утворення поперечних зв’язків стабілізує властивості розчинів декстринів. Залежно від умов оброблення крохмалю можна приготувати декстрини з різними ступенями розщеплення крохмалю: розрізняють білі, палеві (світло-жовті) та жовті декстрини.
У харчовій промисловості декстрини з високою розчинністю у холодній воді використовують як носії активних інгредієнтів харчових порошків і барвників.
КОНТРОЛЬНІ ЗАПИТАННЯ
2. В чому відмінність амілози і амілопектину? 3. Від яких чинників залежить процес клейстеризації крохмалю? 4. Які чинники впливають на ступінь гідролізу крохмалю?КАМЕДІ
Камедь, гумі (від грець. κομμίδιον, κόμμι) – високомолекулярний вуглевод, який є основним компонентом речовин, що виділяються рослинами при механічних пошкодженнях кори. Камедями також називають і екстракти з насіння деяких рослин. Це камедь рожкового дерева (Е410), яку отримують з бобів рожкового дерева, або гуарова камедь (Е412) з гуарових бобів. Кореневі клубні деяких рослин також містять камеді (конжакова камедь Е425). Камедями помилково називають також деякі препарати на основі полісахаридів, які продукуються мікроорганізмами (бактеріями, грибами, дріжджами). Наприклад, ксантанова камедь (Е415), яку отримують в процесі ферментації глюкози або цукрози спеціальними бактеріями. Таким чином, камеді умовно можна поділити на дві основні групи:
– з кори дерев;
– з насіння та інших частин рослин;
Тертю групу, до якої віднесено полісахариди мікробіологічного походження розглянемо в окремому розділі.
Камеді з кори дерев
Камеді, виробляються деякими видами дерев, що ростуть в тропіках і субтропіках. В харчовій промисловості використовують камеді гуміарабіка (Gum… Трагакант (Е413) – полісахарид, що являє собою суміш нейтральних і кислих… Він повільно набрякає у воді з утворенням в’язких колоїдних суспензій або напівгелів; розчиняється в теплій воді з…Полісахариди з насіння та інших частин рослин
Галактоманнани – група гетерополісахаридів, молекули яких складаються з залишків галактози і занози в різних співвідношеннях, при цьому манноза утворює кістяк з приєднаними боковими залишками галактози. Структурний фрагмент молекули галактоманнану з маннозовим кістяком (внизу) і приєднаним залишком галактози (зверху) представлено на рис.16.
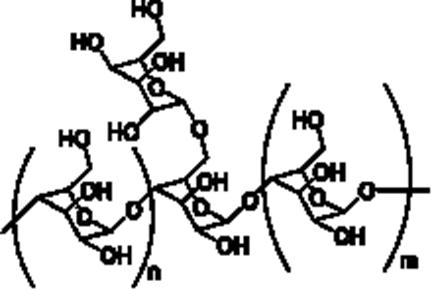
Рис.16 Структурний фрагмент галактоманнану
В залежності від співвідношення галактоза : манноза розрізняють:
- камедь пажитнику сінного (1 : 1);
- гуарова камедь , гуар, гуаран Е412 (1 : 2);
- камедь тари, цезальпінії колючої Е417 (1 : 3)
- камедь рожкового дерева Е410 (1 : 4)
Технічний продукт являє собою подрібнений ендосперм (борошно) насіння відповідної культури, від якого відділені зародок і насіннєва шкірка. Такий продукт містить від 60 до 80% галактоманнанів (інше – волога, білки, жири, мінеральні речовини). За необхідності його очищують хімічними методами.
Галактоманани широко використовуються в харчовій промисловості як стабілізатори і згущувачі у виробництві майонезу, соусів, молочних продуктів, морозива, желе, м'ясних виробів, в хлібопекарському і кондитерському виробництві.
Оскільки в організмі людини відсутні травні соки і кишкові культури, здатні розщеплювати галактоманнани, останні виводяться з кишківника в незмінному вигляді. Це вуглеводні харчові волокна дієтичного призначення.
Гуарова камедь Е412 – натуральний продукт, який отримують з ендосперму насіння Cyamopsis tetraganoloba – рослини, відомої як гуар, або горохове дерево.
Насіння цієї бобової рослини містять близько 70% камеді. Гуарова камедь має нейтральний смак і низьку калорійність.
Головна властивість гуарової камеді – набрякати і створювати дужу в’язкі розчини в гарячій і холодній воді. Це самий економічний згущувач і стабілізатор в сучасній харчовій індустрії.
Гуарова камедь використовується в харчовій промисловості:
– для регулювання в’язкості;
– для стабілізації емульсій;
– для придання продуктам кремоподібної консистенції;
– для підвищення еластичності продуктів;
– в молочних продуктах – для утримання вологи, для придання кремоподібної структури низькокалорійним продуктам;
– в заморожених продуктах – для запобігання росту кристалів льоду;
– для збільшення об’єму продукції при виготовленні сирів;
– в кондитерських виробах – як покращував якості тіста;
– в продуктах швидкого приготування – для придання однорідної консистенції;
– в м'ясних продуктах для збільшення в’язкості фаршу, зменшення втрат вологи, для збільшення терміну зберігання продуктів.
Гуарова камедь входить до складу різних БАДів і лікарських препаратів.
Цей вид камеді має наступний вплив на організм:
- нормалізує кишкову флору,
- очищує організм від токсинів, сприяє зменшенню апетиту;
- зменшує рівень холестерину та ін.
Камедь рожкового дерева Е410 – отримують з стручків середземноморської акації. За хімічним складом камедь рожкового дерева подібна камеді гуару. Це полімер, який складається з неіонних молекул, які представлені у вигляді 2000 залишків простих і складних моносахаридів. Камедь рожкового дерева не розчиняється в холодній воді (крім деяких модифікацій), тому процес розчинення обов’язково потребує нагрівання. Повне розчинення можливе лише за температури 850С. При охолодженні вона уповільнює процес утворення кристалів льоду, створюючи структурований гель. Використовується при виготовленні морозива і різних заморожених десертів (в т.ч. молочних), вершкових сирів, соусів, в хлібопекарському виробництві. Камедь рожкового дерева є сильним синергістам, впливає на функціональні властивості інших колоїдів. Зберігає і передає смак різних ароматів в продукті.
Конжакова камедь або коньячна (Е425). Природна сировина для виробництва – кореневі клубні рослини Amorphophallus. Емпірична формула (С6Н10О5)n, де n = 1200 – 12000. Молекулярна маса 200000 – 2000000.
Це нейтральний полісахарид глюкоманнан, який складається з D-глюкози і D-маннози у співвідношенні від 1:4 до 2 :3. Структурна формула – нерозгалужений ланцюг з мономерів глюкози і манноза, зв’язаних р-(1,4)-глікозидним зв’язком, або слабо розгалужений. Приблизно кожна 9 і 19 мономерна ділянка основного ланцюга ацетильовані.
Отримують конжакову камедь, як правило з трирічного кореневого клубня, вагою понад кілограм, який розрізають, висушують, подрібнюють і просіюють. Потім отримане борошно набрякають у воді, обробляють вапняним молоком і фільтрують. Глюкоманнан осаджують з фільтрату спиртом і висушують.
Конжакова камедь диспергується в холодній і гарячій воді з утворенням високов’язких розчинів з рН 4,0 – 7,0. Розчинність зростає при нагріванні і перемішуванні. Додавання незначної кількості лугу сприяє утворенню термостійкого гелю, який не плавиться навіть при тривалому нагріванні.
Вона використовується для виробництва скловидних макаронних виробів та інших продуктів Південно-Східної кухні в якості в’яжучого агента. За властивостями до згущення і утворення желе конжакова камедь знаходиться між гуаровою і ксантановою. Вона може використовуватися як згущувач і в’яжуча добавка в кондитерських виробах. Камедь можна використовувати як замінник жиру в знежирених і низькожирних м'ясних продуктах. Конжакова камедь сприяє створенню потрібної текстури напоїв, желе, йогуртів.
Конжакове борошно містить алкалоїди, тому потребує спеціальних умов зберігання. Допустима норма камеді в харчових продуктах 10г/кг продукту.
Інулін –полісахарид, який подібно крохмалю, слугує запасним вуглеводом, зустрічається в багатьох рослинах. Клубні і корені жоржини, гіацинту, цикорію і топінамбура містять до 10 – 12% інуліну (до 60% від маси сухих речовин). Разом з інуліном в рослинах присутні й інші вуглеводи (псевдоінулін та ін.), що при гідролізі як і інулін утворюють D-фруктозу. Найчастіше інулін отримують з цикорію або топінамбуру.
Інулін – це поліфруктозан (С6Н10О5)n, який може бути отриманий у вигляді аморфного порошку і у кристалічній формі. Він важкорозчинний у холодній воді, в гарячій – легкорозчинний. Його молекулярна маса 5000 – 6000. Має солодкий смак. При гідролізі під дією кислот і ферменту інулази утворює D-фруктозу і невелику кількість глюкози. Інулін, як і проміжні продукти його ферментативного розщеплення – інуліни, не характеризується відновними властивостями. Молекула інуліну (рис.17) – ланцюг з 30 – 35 залишків фруктози у фуранозній формі.
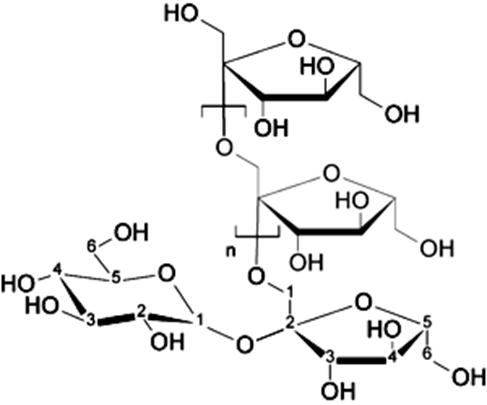
Рис.17 Формула інуліну
Інулін легко засвоюється організмом людини, в зв’язку з чим використовується як замінник крохмалю і цукру при цукровому діабеті. Він слугує вихідною сировиною для промислового отримання фруктози.
КОНТРОЛЬНІ ЗАПИТАННЯ
2. До якої групи харчових добавок відноситься трагакант? 3. Склад і властивості трагаканта? 4. Що слугує сировиною для виробництва гуміарабіку?ПОЛІСАХАРИДИ МІКРОБІОЛОГІЧНОГО ПОХОДЖЕННЯ
Ксантанова камедь, ксантан – природна хімічна сполука (С35Н49О29)n, харчова добавка Е415, відноситься до групи стабілізаторів. За хімічною природою… Головний ланцюг молекули (рис.18) ідентичний молекули целюлози. Відгалуження…Рис.18 Формула ксантану
Виробництво ксантану базується на аеробному бродінні у водному розчині вуглеводів, джерела азоту та ін., після чого середовище пастеризують і осаджують спиртом або очищують методом мікрофільтрації. Властивості ксантану регулюють змінюючи умови життя бактерій. Ксантанова камедь використовується в харчових системах в якості згущувачів, гелеутворювачів і стабілізаторів. Вона добре розчиняється в холодній і гарячій воді, молоці, а також в розчинах солі і цукру. Молекули ксантана адсорбують воду з утворенням тривимірної сітки з подвійних спіралей ксантану. За структурою вона близька структурі гелю, але характеризується меншою в’язкістю. В зв’язку з цим, ксантан зазвичай використовують як згущувач або стабілізатор, а не гелеутворювач. Використання ксантановою камеді дозволяє: збільшити в’язкість фаршу; отримати більш стабільну і пластичну структуру готового продукту; зменшити втрати вологи при термообробці і подальшому зберіганні готових продуктів.
Розчин ксантану стійкий до дії ферментів, спиртів, ПАР, кислот (крім соляної), лугів, до дії високих (до 1200С) і низьких (до -180С) температур. В суміші з іншими камедями ефект згущення вищий, ніж для кожного згущувача окремо. Для розчину ксантану характерні високі значення в’язкості в діапазоні рН від 2 до 12 і псевдопластичності. Завдяки таким властивостям ксантан формує добру структуру, надовго стабілізує продукти і збільшує терміни їх зберігання. Він широко використовується у виробництві соусів, молочних продуктів, морозива, десертів, хлібобулочних виробів, напоїв та ін.
Допустима добова доза споживання ксантану, встановлена комітетом по харчовим добавкам ФАО/ВОЗ 0 – 10 мг/кг маси тіла.
Гелланова камедь (геллан, келкогель) з позаклітинним полісахаридом, що виробляється Pseudomonas elodea. За хімічною будовою геллан являє собою гетеро полісахарид лінійної будови (рис.19) і є продуктом метаболізму бактерій Pseudomonas elodea.
Молекули геллану складаються з тетрасахаридних одиниць, які являють собою зв’язані ангідропіранозні одиниці 1,3-β,D-глюкози, 1,4-β,D-глюкуронової кислоти, 1,4-α,D-глюкози и 1,4-α,L-рамнози.
Геллан утворюється в процесі глибокої ферментації при 300С, рН = 7,0 протягом 2 діб. Середовище має наступний склад: глюкоза – 3,0%; соєвий концентрат – 0,05%; MgSO4 × 7Н2О – 0,01%; NH4NO3 – 0,09%; Na2HPO4 (або К2HPO4) – 0,05%. В середовище додають суміш мікроелементів у кількості 1мг/мл. Виділений препарат містить 50% вуглеводів і 50% нерозчинних речовин, в тому числі 10 – 15% білків.

Рис.19 Формула геллану
Полімер використовують як технічний препарат, що утворює гель. Для повного розчинення його необхідно нагріти до температури вище 900С. при додаванні іонів металів (Са2+, Mg2+, Na+, K+) майже миттєво утворюється гель, міцність якого залежить від концентрації полісахариду і внесеного катіону. Гель, який утворює геллан, переважає за термо– і кислотостійкістю, міцність і стійкістю до бактеріальних ферментів гелі, які утворює агар.
Геллан використовують в харчовій промисловості як харчову добавку Е418 – згущувач, стабілізатор, гелеутворювач. Дозування гелланової камеді в різних продуктах 0,1 – 1%.
Унікальна властивість гелланової камеді полягає тому, що вона здатна формувати гелі майже з усіма іонами. Найбільш міцні студні утворюються з іонами кальцію і магнію. Після додавання до гарячого розчину гелланової камеді кислоти, іонів кальцію і цитрату міцність гелю збільшується.
Рамзан. Основний ланцюг біополімеру складається з D-глюкози, D-глюкуронової кислоти, D-глюкозної и L-рамнозної одиниці с двома глюкозними залишками бокового ланцюга. Хоча основний і боковий ланцюг рамзану відрізняються від відповідних ланцюгів ксантанової камеді, загальна структура біополімеру, яка має вигляд повторюваної одиниці типу «гребня» або «підвіски», є такою ж як і у ксантану. Це пояснює аналогічні функції рамзану. Але розчини камеді рамзан більш в’язкі і більш стійкі до дії температури, ніж розчини ксантанової камеді.
Велан. Основний ланцюг велана ідентичний ланцюгу рамзанової камеді, але боковий ланцюг являє собою або одиничну L-маннозу, або одиничну L-рамнозну.
Велан утворює розчини, які характеризуються більшою в’язкістю, ніж розчини ксантану і камеді рамзан. В'язкість розчинів стабільна при нагріванні до температури 700С і витримуванні при такій температурі протягом 1 години.
Занфло – полісахарид, який отримують з Erwinia tahitica. Він характеризується подібними ксантану властивостями. Відмінність полягає в тім, що за температур вище 600С в’язкість занфло зазнає оборотні термічні зміни.
Занфло складається з залишків фруктози, галактози, глюкози, уронової кислоти і містить деяку кількість ацильних груп.
При отриманні занфло культуру вирощують в середовищах з гідролізованим крохмалем, лактозою або їх суміші. Частіше полімер використовують в лакофарбовій промисловості.
Курдлан – нейтральний бактеріальний гелеутворюючий β-1,3-D-глюкан. Він розчинний в лужному і нерозчинний в нейтральному і кислому середовищах. При нагріванні до температури 540С відбувається безповоротне гелеутворення, міцність гелю постійна в інтервалі температур 60 – 800С і зростає при 80 – 1000С. При температурі 1200С структура полісахариду змінюється.
Полісахарид у великій кількості синтезується мутантом Alcaligenes faecalis var. myxogenes. За 80 годин ферментації в середовищі визначеного складу з вмістом глюкози 8% отримують 40г/л курдлану. Для виділення полімеру додають 0,1Н розчин NаОН до розчинення полісахариду, а потім клітини відділяють фільтруванням. Фільтрат нейтралізують соляною кислотою, а набряклий полімер центрифугують і висушують.
Леван є одним з небагатьох полісахаридів, які в недериватизованому вигляді утворюють рідкокристалічну фазу. Левани синтезують такі мікроорганізми як: Acetobacter, Aerobacter, Arthrobacter (Corynebacterium), Azotobacter та ін. в промисловому масштабі він виробляється з сахарози за допомогою бактерій Aerobacter Levanicum.
В хімічному відношенні батеріальний леван (фруктан) являє собою нейтральний розгалужений полісахарид, побудований із залишків D-фруктофуранози, які в основному ланцюгу з’єднані зв'язками β-2 → 6, а в місця розгалужень — α-2 → 1.
Декстран (С6Н10О5)n – це високомолекулярний полімер з довгим розгалуженим ланцюгом, який складається з глюкози, з’єднаної головним чином α→1,6 глікозидними і в меншій мірі β→1,4 і α→1,3 глікозидними зв'язками. Молекулярна маса декстрину від 20000 до 200000. Він являє собою аморфний світло-жовтий або білий порошок, який у воді утворює колоїдний розчин. Декстран утворюється з сахарози під дією бактерій Leoconostoc mesenteriodei.
Полігалактозамін є лінійним α-1,4-полігалактозаміном (рис.20), який продукується Paecilomyces sp.

Рис.20 Формула полігалактозаміну
Полігалактозамін нерозчинний у воді, лугах і органічних розчинниках, але розчинний в розбавлених органічних кислотах.
Він використовується в харчовій, фармацевтичній промисловості, а також у виробництві косметичних виробів.
Політран (склероглюкан) є нейтральним α-1,3-D-глюканом, який виділяє грибSclerotium glucanicum. До кожного третього або четвертого залишку глюкози в основному ланцюгу полісахариду приєднана α-1,6-зв'язком ще одна ангідроглюкозна одиниця по шостому атому вуглецю.
Максимальна кількість полімеру утворюється на ранній фазі росту клітин (через 48 годин). Зростання на середовищі з глюкозою забезпечує вихід полісахариду до 50%.
Під дією екзоглюканаз полісахарид розщеплюється до глюкози і гентобіози. Склероглюкан у воді утворює гелі за концентрації 1,5%, які характеризуються псевдопластичністю в широкому діапазоні температур і рН. За ступенем в’язкості склероглюкан подібний ксантану.
В діапазоні температур 15 – 900С в’язкість розчину залишається постійною; після витримування протягом короткого періоду часу при більш високій температурі (до 1350С) в'язкість зменшується, але після зниження температури вона знову відновлюється.
Пуллулан являє собою α-D-глюкановий полісахарид, що синтезується дріжджоподібним грибом Aureobasididium pullulans («чорні дріжджі»).
Особливості отримання полісахариду полягають в наступному. Він не накопичується в процесі зростання продуцента, а синтезується в умовах надлишкового вмісту вуглецю, в якості якого використовують 10 – 12% – вий гідролізат крохмалю.
Синтез проходить на сахарозі, мальтозі, фруктозі і глюкозі. Але при концентрації сахарози вище 5% відбувається інгібірування синтезу. В якості джерела азоту можуть бути як органічні , так і неорганічні сполуки, кращими є тартрат амонію і аспарагін. Підвищення вмісту фосфору призводить до зниження молекулярної маси полімеру. Позитивно впливають на біосинтез іони заліза (3+).
Оптимальне значення рН для процесу отримання пуллулану дорівнює 6,0 – 7,0, температури – 260С. біосинтез прискорюється із збільшенням концентрації кисню
Для виділення пуллулану спочатку відділяють клітини продуцента, осаджують полімер метанолом, етанолом або ізопропанолом, механічним шляхом його зневоднюють і висушують.
Пуллулан являє собою нейтральний лінійний гомо полісахарид, який складається з повторюваних мальтотриозних одиниць (α-D-глюкопіранозил-1 → 4-α-D-глюкопіранозил-1 → 4-α-D-глюкоза), з'єднаних α-1→6 зв'язками. У окремих зразках полімеру можна виявити близько 7 мальтотетраозних фрагментів.
Пуллулан легко розчиняється у воді з утворенням в’язких і клейких розчинів, він не розчиняється в метанолі і ацетоні. В порівнянні з іншими полісахаридами водні розчини пуллулану мають відносно низьку в'язкість. Полімер має добру адгезію до скла, металів, деревини і харчовим продуктам.
В харчовій промисловості використовується як наповнювач і стабілізатор емульсій, а також як формоутворювач.
Керкогель R. Біокамедь з комерційною назвою «керкогель R» продукується мікроорганізмами Pseudomonas elogea, зібраними з водоростей, що проростають в озерах штату Пенсільванії. Рентгеноструктурний аналіз показує, що молекулярна структура полісахариду являє собою подвійну спіраль, закручену вліво.
Керкогель R добре розчиняється у воді при температурі 900С (5 хв.). розчин переходить в гель при введенні в нього металів (кальцію, натрію та ін.) або вуглеводів з наступним осадженням. Абсолютно прозорий гель утворюється при концентрації керкогелю R 0,2% та іонів кальцію – 0,008%. Двовалентні метали впливають на процес гелеутворення сильніше ніж одновалентні. Процес гелеутворення відбувається при температурі 30 – 400С. температура плавлення такого гелю 1000С і вище. При збільшенні вмісту катіонів температура гелеутворення також підвищується, при цьому двохвалентні іони дають більший ефект підвищення температури, ніж одновалентні. Крім того, чим вища концентрація керкогелю R та іонів металу, тим вища термостійкість гелю. Гель може витримувати температуру 1210С протягом 10 хв.
Гель стабільний в широкому діапазоні рН (3 – 9), але в кислому середовищі його стабільність унікальна. Про це свідчать дані дослідження міцності гелів різних полісахаридів, які піддавали тепловій обробці протягом 45 хв. при 800С і рН 3,8 – 4,0. Залишковий коефіцієнт міцності гелю для керкогелю R склав 81%, тоді як для карагену – 56%, а для агару – 62,1%.
Керкогель R стійкий до дії ферментів (пептидази, амілази, целюлазам, протеазам, ліпазам).
Керкогель R суміщається з ксантаном, борошном з бобів рожкового дерева, желатином. Його рекомендовано використовувати як гелеутворювач в кількості 0,2 – 0,4%.
КОНТРОЛЬНІ ЗАПИТАННЯ
2. Як регулюють властивості ксантану в процесі їх виробництва? 3. В якій формі (хімічній) ксантан використовують для харчових цілей? 4. Які властивості ксантану визначають його функціональне використання в харчових системах?ЦЕЛЮЛОЗА І ЇЇ ПОХІДНІ
В харчовій промисловості широко використовуються целюлоза і її похідні: Е460і – мікрокристалічна целюлоза; Е460іі – целюлоза порошкоподібна; Е461 – метилцелюлоза; Е462 – етилцелюлоза; Е463 – гідроксипропілцелюлоза; Е464 – гідроксіпропілметилцелюлоза; Е465 – метилетилцелюлоза; Е466 – карбоксиметилцелюлоза; Е467 – етилгідроксицелюлоза; Е468 – кроскамелоза; Е469 – карбоксиметилцелюлоза ферментована.
Целюлоза
Целюлоза (від лат. Cellula – клітина, теж саме, що й клітковина) – полісахарид, який є основною складовою частиною клітинних оболонок вищих рослин.
Молекула целюлози (рис. 21) складається з залишків молекул глюкози, яка й утворюється при кислотному гідролізі целюлози.

Рис.21 Целюлоза у формі полимера β-D-глюкози
Целюлоза є довгими нитками, що містять 300-10 000 залишків глюкози, без бічних відгалужень. Ці нитки сполучені між собою великою кількістю водневих зв’язків, що забезпечує целюлозі велику механічну міцність. У ссавців (як і у більшості інших тварин) немає ферментів, здатних розщеплювати целюлозу. Але деякі травоїдні тварини (наприклад, жуйні) мають в травному тракті бактерії-сімбіонти, які розщеплюють і допомагають засвоїти цей полісахарид.
В кишківнику людини не виділяються ферменти, які б розщеплювали клітковину, тому людський організм фактично не здатний її перетравлювати.
Клітковина відіграє важливе значення в процесах стимулювання перистальтики кишківника, а також сприяє виведенню з організму холестерину. Пояснюється це тим, що клітковина рослинної їжі адсорбує стерини і перешкоджає їх всмоктуванню. Важливе значення клітковини й в процесах нормалізації корисної кишкової мікрофлори.
Зареєстрована в якості харчової добавки Е460.
Окрім целюлози, до складу клітинних оболонок входять й деякі інші вуглеводи, відомі під загальною назвою – геміцелюлози. Їх вилучають з клітинних оболонок 1%–вим розчином соляної або сірчаної кислоти при нагріванні. Одним з віднесених до цієї групи є пара галактан, який утворює при гідролізі галактозу. В клітинних оболонках містяться й інші геміцелюлози, що утворюють маннозу, арабінозу і ксилозу.
Майже чистою клітковиною є бавовна, з якої виготовляють тканину. У бавовняному волокні міститься до 99,5% целюлози. З целюлози деревини виготовляють папір. Целюлозу і її ефіри використовують для одержання штучного волокна (віскозного, ацетатного, мідно-аміачного шовку та штучної шерсті), пластмас кіно- і фотоплівок, лаків та ін.
В промисловості целюлозу отримують з деревини культурних рослин, трав і насіннєвих волосків.
Целюлоза – стійка речовина, яка не руйнується при нагріванні до 2000С. Вона нерозчинна у воді і слабких кислотах, міцна і еластична одночасно. Щоб надати целюлозі розчинності, її піддають хімічній модифікації.
Одним з об’єктів промислового використання є бактеріальна целюлоза, продуцентами якої виступають культури Acetobacter xylinum, A.pasteurianus, A. rances, Sarcina ventriculi, Bacterium xylinside, деякі штами роду Pseudomonas. Бактеріальна целюлоза, як і бавовняна, є чистою речовиною і фактично не потребує очищення. Вона складається з мікрофібрил, характери взаємного розміщення яких визначає її високу динамічну міцність. Для культивування продуцентів не потрібні ніякі специфічні компоненти середовища. При глибинному культивуванні утворюється гель полімеру. Вихід целюлози по субстрату (глюкозі) становить близько 40%. Після закінчення ферментації гель ретельно відмивають від компонентів середовища і пресують. Пресований лист висушують після фіксації на підложці тепловим або сублімаційним методом; товщина листа 1 – 500мкм. Бактеріальна целюлоза використовується в харчовій промисловості як наповнювач або для придання волокнистої структури.
Похідні целюлози
Серед похідних целюлози найбільше значення мають метилцелюлоза і карбоксиметилцелюлоза. Похідні целюлози використовують в якості дієтичних волокон при створенні… Карбоксиметилцелюлозу (Е466) отримують обробкою лужної целюлози монохлороцтовою кислотою. В результаті такого…КОНТРОЛЬНІ ЗАПИТАННЯ
1. До якої групи за хімічним складом і структурою молекули відноситься целюлоза?
2. Які крім целюлози вуглеводи входять до складу клітинних оболонок рослин?
3. Яке функціональне значення целюлози як харчової добавки?
4. Як отримують бактеріальну целюлозу?
5. Як отримують карбоксиметилцелюлозу?
6. Які чинники впливають на процес утворення студнів метилцелюлози?
7. В чому особливість структурної будови мікрокристалічної целюлози?
8. З якої сировини отримують мікрокристалічну целюлозу?
9. Які властивості характерні для мікрокристалічної целюлози?
ПОЛІСАХАРИДИ З МОРСЬКИХ РОСЛИН
Вуглеводний комплекс морських водоростей містить різноманітні прості і складні цукри. Серед простих (низькомолекулярних) присутні моносахариди… З практичної точки зору водоростеві полісахариди доцільно поділити на дві… – полісахариди з червоних водоростей – агар, каррагінан, агароїд;Альгінові кислоти і альгінати
Альгінова кислота вперше була відкрита в складі морських рослин в кінці 19ст. На сьогодні головним джерелом альгінових кислот - бурі морські водорості ламінарії.
Ламінарії утворюють великі за площею зарості в прибережних зонах всіх північних і далекосхідних морів. Водорості мають дворічний цикл зростання. На другий рік проростання ламінарія утворює стрічкоподібну рослину від 1 до 12 метрів (рис.22). в багатьох країнах організовано добування і промислове перероблення ламінарії.

Рис.22 Загальний вигляд бурої морської водорості ламінарії
Цілющі властивості морської капусти пояснюються великим вмістом альгінових кислот і альгінатів.
Хімічна будова альгінової кислоти представлена на рис. 23.

Рис.23 Структурна формула альгінової кислоти морських водоростей
Альгінові кислоти і альгінати – основні представники полісахаридів морських водоростей. Альгінати не містяться в наземних рослинах, їх джерелом можуть бути лише морські водорості (13 – 45% від сухої речовини).
Альгінові кислоти являють собою високомолекулярні полісахариди, молекули яких побудовані з залишків L-гіалуронової и D-маннуронової кислот.
В бурих морських водоростях містяться як альгінові кислоти, так і їх розчинні і нерозчинні солі: альгінати калію, натрію, магнію і кальцію.
Виділені з бурих морських водоростей альгінати, очищені і збагачені кальцієм шляхом спеціального оброблення, слугують субстанцією для виробництва БАД «Альгінат кальцію». Хімічна будова альгінату кальцію представлена на рис.24.

Рис.24 Структурна формула альгінату кальцію
Як видно з структурної будови альгінат вигідно відрізняється від вихідної альгінової кислоти вмістом іонів кальцію.
Альгінові кислоти з водоростей отримують або осадженням з лужних розчинів альгінатів, або виділенням з альгінату кальцію.
Для отримання альгінату натрію (рис. 25) альгінову кислоту змішують з вуглекислим натрієм. Внаслідок нейтралізації карбоксильних груп альгінової кислоти утворюються альгінати. Отриманий в’язкий розчин альгінату натрію висушують до повітряно-сухого стану.
Харчовий альгінат натрію являє собою пластинки неправильної форми або порошок від світло-коричневого до темно-коричневого кольору. Згідно до вимог ТУ він повинен мати: вологість не більше 18%; зольність не більше 29%; вміст солей не більше 4,5%,; речовин, нерозчинних в гарячій воді не більше 0,5%. Вихід альгінату натрію з сухої дворічної японської ламінарії становить 20 – 25%, молекулярна маса 120000 – 200000.
 |
|
|
 |
 Na2CO3
Na2CO3
 | |||
|
H2SO4
 HCl
HCl
 |
|
 | |||
 |
Рис.25 Схема виготовлення альгінату натрію
Альгінати калію, натрію, амонію рочинні в холодній і гарячій воді, альгінат кальцію нерозчинний при нейтральному рН. Альгінати нерозчинні в сольових розчинах, але розчиняються в гарячих розчинах цукру.
Розчини альгінату мають низьку в'язкість при рН вище 5,5, і високу – при рН нижче 5,5. Діапазон розчинності альгінатів 0 – 80%.
Утворення гелю альгінату протікає при рН нижче 4 або в присутності іонів Са2+ в кількості 20 – 70мг/т альгінату. Кислотний альгінатний гель м'який, стійкий і тиксотропний. Кальцієвий гель дуже ламкий і термонеобернений. Міцність гелю збільшується із збільшенням концентрації Са2+ і при рН нижче 3,6.
Механізм утворення альгінатних гелів полягає в зв’язуванні іонів кальцію між ланцюгами полігаларонату, тобто відома модель «решітка для яєць». Ланцюги молекул, що упаковані в такій конфігурації, мають пори і порожнини, які відповідають розміру іонного радіуса Са2+. Утворення гель протікає інтенсивно при заповненні пор іонами кальцію.
Відомо декілька способів утворення альгінатного гелю:
– використання безпосередньо солей кальцію як неорганічних, так і органічних, в т.ч. і альгінату кальцію;
– використання похідних сполук;
– зброджування молочної кислоти;
– використання морської води та ін.
Утворення альгінатного гелю з використанням солей кальцію. Безпосереднє використання солей кальцію полягає в обробленні 1 – 3% – вого водного розчину альгінату натрію неорганічними або органічними сполуками кальцію, які можуть бути у вигляді розчинів або твердих речовин. В якості солей кальцію використовують хлорид кальцію, сульфат кальцію, оцтовокислий кальцій або глюконат кальцію. Суть процесу полягає в тім, що розчин солей кальцію по краплям вводять в розчин альгінату натрію, в результаті чого утворюється гель у вигляді кульок.
По іншому способу на поверхню пластикової стрічки наносять шар альгінату натрію, який потім занурюють в розчин солі кальцію, після чого отримують нерозчинний у воді шар. Якщо солі кальцію додавати безпосередньо в розчин альгінату натрію, то відбувається швидке утворення гелю і дуже важко отримати його однорідним. Але якщо використовувати зерноподібні сполуки лимоннокислого кальцію, то можна уникнути вищезазначеного недоліку і встановлювати визначену форму гелю та регулювати час його отримання.
Утворення альгінатного гелю з використанням похідних сполук.
При використанні похідних сполук, як правило використовують сульфіт кальцію. Розчин альгінату натрію змішують з подрібненим до стану пудри сульфітом кальцію і ретельно перемішують. Реакція протікає повільно, за 24 години не з'являються видимі її ознаки. Після того, як розчин стане однорідним, необхідно додати невелику кількість пероксиду водню. І тоді сульфіт кальцію дає сірчану кислоту, яка безпосередньо вступає в реакцію з альгінатом натрію. Крім того, сульфіт кальцію під дією кисню переходить в сульфат кальцію, який також може перетворювати альгінат кальцію в гель.
Утворення альгінатного гелю способом молочнокислого бродіння. Спосіб молочнокислого бродіння за звичайних умов дає стійкий гель. Але з причини тривалості процесу бродіння даний спосіб потребує багато часу. Крім того, в ході реакції збільшується в'язкість системи тому з часом при утворенні гелю швидкість реакції зменшується. З іншого боку, при цьому способі утворюється вуглекислий газ, який зменшує міцність гелю. Для здійснення даного процесу в розчин альгінату натрію додають цукри, карбонат кальцію і молочнокислі бактерії; створюють необхідні температурні умови. Утворена в процесі бродіння молочна кислота вступає в реакцію з карбонатом кальцію, в результаті чого утворюється молочнокислий кальцій і вуглекислий газ. На початку процесу вуглекислий газ розчиняється в розчині, а молочнокислий кальцій реагує з альгінатом натрію. При цьому утворюється гель альгінату кальцію. Даний спосіб, хоча й дає гель невисокої міцності, але є одним з найбільш безпечних для здоров'я людини.
Утворення альгінатного гелю з використанням морської води.
Альгінатні гелі стійкі до дії як низьких, так і високих температур, що вигідно відрізняє їх від гелів агар-агару, желатину, каррагенану та ін. вони… Реологічні властивості гелю можна змінити в бажаному напрямку шляхом…Таблиця 7
Властивості модифікованих альгінатів
Альгінати не засвоюються організмом людини, сприяють виведенню важких металів та деяких інших сполук. Згідно даних експертного комітету по харчовим добавкам ФАО/ВОЗ альгінова… Альгінати використовують в харчовій промисловості в якості стабілізаторів і утворювачів студнів.Полісахариди з червоних морських водоростей
Агар-агар. Назва цього полімеру має малайзійське походження і означає «желюючий продукт харчування з водоростей». Основу агар-агара складає агароза, молекула якої характеризується повторюваною…Рис.27 Схема виробництва агар-агару
Чисті водорості замочують в 0,2 – 0,5%-ому вапняному молоці для полегшення вилучення з них агар-агару і зменшення забарвлення отримуваних наварів.
Агар-агар вилучають з водоростей шляхом варки їх в кип’ячому розчині оксиду кальцію (рН не нижче 8). В залежності від властивостей сировини, конструкції устаткування встановлюється тривалість і кратність повторних варок, кількість і концентрація розчину оксиду кальцію, температура. Отриманий після варки навар очищують від механічних домішок відстоюванням протягом 4 – 5 годин при температурі 80 – 850C, а потім в гарячому вигляді очищують на сепараторах або центрифугах з наступним охолодженням до утворення студня в спеціальних апаратах.
Студень ріжуть на пластини товщиною 5 – 6 мм або тонкі полоси і бруски, які направляють на очищення від неагарових і забарвлюючих речовин.
Очищення проводять промиванням у воді або шляхом заморожування студня і відтаювання агарольоду в природних умовах. Промивають студень водою з температурою 18 – 200С 10-12-кратно, загальна тривалість промивання складає 30 – 36 годин. При другому способі очищення в результаті зниження температури відбувається виморожування води і концентрування студня до утворення коагелю і розчину, який містить органічні речовини і мінеральні солі. При підвищенні температури вода, яка утворюється в результаті танення льоду, разом з неагаровими речовинами стікає з коагелю і він стає чистим. Отриманий коагель висушують в природних умовах до вмісту вологи не більше 20%.
Студень, отриманий після промивання прісною водою, нагрівають до повного розчинення у воді, упарюють під вакуумом до вмісту сухого агару 2,5 – 2,8% і висушують в розсіювальній або вальцьовій сушарці до вмісту вологи не більше 18%. Вихід агару з анфельції становить в середньому 10% від маси сировини.
Для отримання агару особливого очищення промитий студень плавлять, охолоджують до температури 55 – 600С і при помірному перемішуванні в нього вводять суспензію карбонату кальцію, масу двічі сепарують і желюють. Студень подрібнюють і віджимають на пресі (при цьому разом з водою з нього вилучаються розчинні неагарові домішки), висушують під вакуумом. При цьому способі вихід агару становить 8% від маси анфельції.
Агар-агар розчинний у воді, розчинах солей і цукру, молоці при температурі вище 900С. Розчини агару і гелі сумісні з білками, несумісні з водорозчинними спиртами і кетонами.
Гелеутворення різних видів агарів відбувається в інтервалі температур 30 – 420С. Гелі агар-агару мають сітчасту структуру, яка складається з довгих ланцюгів макромолекул, що утримуються разом в ряду зон двоспіральних з’єднань. Гелі агар-агару термооборотні, крихкі, їх міцність збільшується із зростанням концентрації полімеру, а також рН середовища і вмісту цукру.
Нагрівання агарового розчину, що містить поварену сіль, зменшує міцність студню, сприяє відділенню вологи, підвищує температуру застигання. Із збільшенням тривалості термообробки агарового розчину зменшується міцність отриманого з нього студню. Нагрівання розчину агару в присутності кислоти також впливає на міцність студню. А саме, вона різко зменшується при рН нижче 3, хоча при рН більше 4 проявляється її стійкість до кислотного розкладення. При використанні агару сумісно з кислими спеціями агаровий розчин і розчин кислих спецій готують окремо. Рекомендується змішувати їх при температурі нижче 800С .
Основною характеристикою агару є здатність до гелеутворення, яка визначається міцністю студню, яка визначається на приборі Валента (в г) і повинна бути не менше: для вищого сорту 300, першого – 200, агару особливого очищення – 400. Додавання цукру збільшує міцність агарового гелю. Наприклад, міцність 0,85%-вого студню при додаванні 70% цукру зростає для вищого сорту до 1600, першого - 1000 г. При збільшенні концентрації агару (від 1 до 5%) реологічні параметри гелів зростають.
Другою важливою характеристикою агар-агару є температура застигання розчину і плавлення студню. Перша температура для 0,85%-вого розчину агар-агару повинна бути не нижчою 300С, друга для студню такої ж концентрації – не вища 800С. Температура плавлення агар-агару залежить від його виду і концентрації. Наприклад, студень з агар-агару торгівельної марки S-7 (японська класифікація) плавиться при 840С, в той час як агар марки М-13 має температуру плавлення 930С при одній і тій же концентрації 0,4%. Для всіх видів агар-агару характерна закономірність: із збільшенням температури плавлення зростає концентрація агар-агару.
Щодо харчової цінності агар-агару відомості суперечливі. Так, згідно даних японських дослідників, галактоза, з якої складається агар-агар, не розщеплюється ферментами організму людини, тому він не засвоюється і є некалорійним продуктом. В той же час інші джерела вказують, що організмом людини засвоюється до 1/3 агар-агару.
З гігієнічної точки зору агар-агар нешкідливий, допускається його використання в харчових цілях.
Згідно кодексу харчування ФАО/ВОЗ агар-агар має статус харчової добавки, для якої допустима добова доза не обговорюється, що вказує на відсутність обмежень його харчового використання. При виробництві різних харчових продуктів агар-агар використовується в кількості 0,07 – 1,4%. Його рекомендується використовувати в якості згущувача при виробництві емульсійних продуктів, кремів, заливок, в якості утворювача студня – в кондитерській промисловості і кулінарному виробництві, а також в фармацевтичній і мікробіологічній промисловості.
Іншим структуроутворюючим біополімером, основу якого складає агароза, є агароїд.
До складу молекули агароїду входить 22 – 40% сульфокислотних груп і 3 – 5% карбоксильних груп, тоді як в молекулі агар-агару їх кількість 2 – 5 і 20 – 25% відповідно.
Відмінності в структурі полімерів визначають і різну гелеутворюючу здатність, яка у агароїда виражена в 2 – 3 рази слабкіше. Агароїд, крім того, має нижчі температури плавлення і застигання, меншу хімічну стійкість. Сировиною для отримання агароїду слугує чорноморська філлофора (Phyllophora nervosa), в якій міститься його 20 – 27%.
Технологічна схема отримання агароїду подібна схемі виробництва агар-агару. Але режими проведення технологічних операцій мають суттєві відмінності. При підготовці філлофори до варки її замочують в 0,05%-вому розчині КОН протягом 1 години при гідромодулі 1:9. Варять водорості у воді з використанням багатократної екстракції по принципу протитоку (гідромодуль 1:9). Загальна тривалість варки однієї порції водоростей близько 46 годин. Отримані водоростеві відвари очищують за допомогою активованого вугілля і фільтрують на фільтр-пресах. Висушують агароїд до вологості не більше 18%. Згідно до вимог стандарту 2,5%-вий розчин агароїду повинен мати температуру застигання не менше 200С, температуру плавлення студня – не менше 500С, міцність студня за Валента не менше 180г. Агароїд використовують в якості згущувача і утворювача студня.
Запропонована нова технологія обробки, яка дозволяє отримати структуроутворювач (філлофорин), який проявляє більшу гелеутворюючу здатність, ніж агароїд. Технологія виробництва філлофорин включає обробку водоростей розчином лугу при температурі 80 – 850С, промивання, екстрагування філлофорин водою з додаванням кислоти, фільтрування екстракту і його сушіння. Міцність водного студня, який містить 2,5% філлофорин, за Валента знаходиться в межах 300 – 500г.
Каррагенани. Назва цих полімерів походить від назви ірландського приморського міста Каррик. Іноді їх також називають ірландським мохом. Вони входять до складу червоних водоростей і мають деяку гетерогенність структури. Можна виділити різні типи ідеальних каррагенанів, які позначаються грецькими літерами "лямбда", "ксі", "каппа", "йота", "мю" і "ню".
Каррагенани побудовані із залишків галактози і 3,6 – ангідрогалактози. На відміну від агарози в молекулі каррагенану містяться лише залишки D- галактози, значною мірою сульфітовані. З каррагенанів добре вивчені "лямбда", "ксі" і "йота" – форми, первинні структури яких приведені на рис.28.
Насправді ж не існує полімерів, які б відповідали даним формулам, оскільки в макромолекулі одного типу завжди присутні декілька димерів іншого. Наприклад, у фракціях каппа і йота завжди зустрічаються димери, що відповідають фракціям мю і ню, які є їх біологічними попередниками.
В зв’язки з цим більш точним визначенням каррагенанів є наступне: каррагенани – це полімери, які складаються із різного ступеню сульфатованих ланок галактози і сульфатованих або несульфатованих ланок 3,6-ангідрогалактози, по черзі сполучених 1-3 і 1-4 зв'язками. Складні сульфатні ефіри можуть містити катіони натрію, калію, кальцію, магнію.

Рис.28 Структурні формули каррагенанів:
І – ксі-каррагенан; ІІ - йота-каррагенан; ІІІ – лямбда-каррагенан
Фракціонувати каррагенани можна шляхом розчинення у водних розчинах хлориду калію. Каррагенани можуть бути виділені з наступних видів водоростей: Furcellaria, Chondrus, Gigartina, Hypnea, Hiyllophora, Gymnogongrus, Ahnfeltia, Euchenma, Meristotheca та ін. найбільш широко в якості сировини для виробництва каррагенанів використовують Gigartina, Chondrus, Euchenma.
Вид водоростей впливає на тип отриманого з неї каррагенану. Наприклад, Gigartina adcularis, містить в основному згущуючу фракцію лямбда і небагато ксі, а такі водорості, як Gigartina stellata и Chondrus crispus, що ростуть біля скалистих берегів Північної Атлантики, містять всі фракції каррагенанів. У водоростях хондрус вміст каррагенану досягає 50% сухої речовини.
Технологічна схема виробництва каррагенанів представлена на рис.29.
 |
Рис.29 Схема виробництва каррагенану
Від водоростей, що надходять на обробку, відділяють сторонні домішки, ретельно миють, подрібнюють і направляють на обробку лугом. Температура і концентрація останньої залежать від того, який каррагенан необхідно отримати. Наприклад, для виробництва згущувачів використовують невелику кількість лугу і помірну температуру, для утворювачів студнів – високу температуру і велику кількість лугу, які сприяють утворенню фракцій каппа і йота.
При лужній обробці в розчин, крім каррагенанів переходять мінеральні солі і деякі пігменти. До нерозчинної фракції входять геміцелюлоза і більша частина протеїнів, які вилучають з розчину фільтруванням.
Каррагенани виділяють з екстрактів осадженням в розчині хлориду каляю або спирту. За допомогою першого способу виділяють утворюючу студень фракцію каппа, яку потім з метою очищення заморожують в розчині хлористого кальцію і пресують для видалення сольового розчину.
Другим способом екстракт виливають в ізопропіловим спирт, в якому каррагенан випадає в осад у вигляді волокон. Після пресування осад висушують у вакуумі. Якщо осад під час пресування добре утримує воду, до нього додають невелику кількість хлористого кальцію. Каррагенани висушують до вмісту вологи не більше 10%, потім подрібнюють до частинок діаметром 200 – 300мк.
Каррагенани розчиняються у воді з утворенням в’язких розчинів. Швидкість розчинення залежить від фракційного складу каррагенанів і температури. Лямбда-каррагенан, який містить три складні сульфатні ефіри в двох вуглеводних ділянках, розчиняється при кімнатній температурі і є найбільш гідрофільним. Каппа-каррагенан, який містить один складний сульфатний ефір, розміщений в циклі галактопіранози в положенні 4, є менш гідрофільним і розчиняється при підвищених температурах. Йота-каррагенан з двома складними сульфатними ефірами в двох вуглеводних ланцюгах займає проміжне положення.
Каррагенани несумісні з водорозчинними спиртами, кетонами, високомолекулярними сполуками, макромолекули яких катіонного типу.
Дифракція рентгенівських променів на волокнах йота і каппа-каррагенанів показала, що їх структури являють собою трискладові правосторонні подвійні спіралі. Агрегація цих подвійних спіральних впорядкованих конформацій у водних системах залежить від таких чинників, як вміст сульфату в каррагенані, іонної сили і типу катіону. Формування гелю (рис.30) протікає за таких умов, при яких може відбуватися агрегація подвійних спіралей.
При охолодженні розчинів каррагенану внаслідок міжмолекулярної взаємодії утворюються впорядковані конформації у вигляді «доменових» спіралей, які при нагріванні переходять назад в стан «випадкової» спіралі. З доменових спіралей при подальшому охолодженні формуються домени, які являють тривимірну структуру гелю. Іони лужних металів прискорюють формування структури гелю.
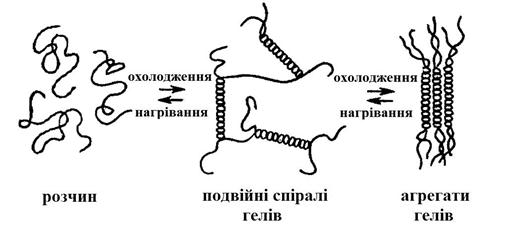
Рис.30 Схема формування гелю каррагенанів
Структуроутворюючі властивості каррагенанів, також як і розчинність у воді, залежать від їх фракційного складу.
Структуроутворюючі властивості каррагенанів, як і їх розчинність у воді, залежить від їх фракційного складу.
Наприклад, дуже гідрофільний лямбда-каррагенан виступає лише в якості згущувача. Його макромолекули знаходяться на значній відстані одна від одної, що заважає утворенню зв'язків.
Макромолекули каппа і йота- каррагенанів, які розчиняються при підвищених температурах, під час охолодження утворюють зони зчеплення, характерні для структурної сітки гелю. Це вказує на те, що вони характеризуються здатністю до утворення студнів.
Оскільки каппа-каррагенан несе менший від'ємний в порівнянні з йота-каррагенаном, він виявляє більший ступінь агрегації подвійних спіралей і, як наслідок, його гелі є більш міцними і непрозорими.
Всі гелі каррагенанів є термооборотними, причому температура плавлення топлення завжди на декілька градусів відрізняється від температури застигання. Крім того, на гелеутворюючу властивості каррагенанів впливають електроліти. Йони металів сприяють формуванню структури гелю. Солі калію в цьому відношенні найбільш активні. Наприклад, майже в 10 разів збільшується еластичність 2%-вого гелю каппа-каррагенану, після додавання хлористого калію в кількості 0,3 моля на 1л. таке збільшення еластичності в присутності іонів лужних металів пояснюється екрануванням радикалів кислоти в молекулах каррагенанів.
Іони кальцію також впливають на гелеутворюючу властивість каррагенанів, але їх дія більш відчутна на фракції йота.
Каррагенани стабілізують міцели казеїну, що дає можливість їх використання в молочній промисловості. Обумовлено це здатністю каррагенанів утворювати зв’язки з казеїном за рахунок електростатичної взаємодії в присутності іонів калію і кальцію.
Гелеутворюючі властивості каррагенанів можна регулювати, комбінуючи їх фракції або додаючи інші гідроколоїди. Наприклад, сумісне використання каппа і йота-каррагенанів робить можливим отримання міцних, але недостатньо еластичних гелів. Додавання до каррагенану камеді рожкового дерева збільшує силу деформації гелю, не змінюючи при цьому інших його показників.
Каррагенани не розщеплюються ферментами в шлунково-кишковому тракті і можуть використовуватися у виробництві енергоредукованих продуктів. Вони використовуються в харчовій промисловості як структуроутворюючі добавки в кількості 0,01 – 3,00%. Експертний комітет по харчовим добавкам ФАО/ВОЗ визначив для каррагенанів допустиму добову норму 0 – 75г на 1 кг маси тіла.
Фурцелларан, або датський агар – це полісахарид, який отримують з червоних водоростей (Furcellaria tastigiata), з властивостями як у каррагенану. В його молекулі присутня ефірно-зв'язана сірчана кислота, в кількості однієї сульфідної групи на три – чотири галактоз них залишки. Молекулярна маса фурцелларану 20000 – 80000. Структурна формула фурцелларану аналогічна формулі каррагенану, але на відміну від нього містить менше сірки. Фурцелларану характерні всі властивості, що й каррагенану.
Експертний комітет по харчовим добавкам ФАО/ВОЗ визначив для фурцелларану допустиму добову норму до 75г на 1 кг маси тіла.
Фурцелларан (вищого сорту) повинен мати вологість не більше 18%, зольність – не більше 14%. Показники фізичних властивостей студнів і розчинів, які містять 2,5% сухого фурцелларану повинні бути наступними: температура топлення не нижче 650С, температура застигання не менше 230С, міцність студня по Валента не менше 350г.
Фурцелларан використовують при виготовленні ароматизованих молочних напоїв, желе та ін.
КОНТРОЛЬНІ ЗАПИТАННЯ
2. З якої сировини отримують альгінові кислоти? 3. З яких структурних елементів побудована молекула альгінової кислоти? 4. Які чинники і як впливають на властивості альгінатів?ПОЛІСАХАРИДИ ТВАРИННОГО ПОХОДЖЕННЯ
Він є компонентом екзоскелету (кутикули) членистоногих і ряду безхребетних, входить до складу клітинної стінки грибів і бактерій та ін. В 1821 француз Генрі Бракон (Braconnot), директор ботанічного саду в Нансі,… Хітин найбільш розповсюджений у природі полісахарид – кожен рік на землі в живих організмах утворююється і…Рис.31 Структурная формула молекулы хитина
У всіх організмах, які виробляють і використовують хітин, він знаходиться не в чистому виді, а в комплексі з іншими полісахаридами, і дуже часто асоційований з білками. Незважаючи на те, що хітин я речовиною, дуже близькою за будовою, фізико-хімічними властивостями і біологічною функцією до целюлози, в організмах, що утворюють целюлозу (рослини, деякі бактерії), хітин не виявлено.
В природних умовах хітини різних організмів відрізняються за складом і властивостями. Молекулярна маса хітину досягає 260000.
Хітин нерозчинний у воді, стійкий до дії розведених кислот, лугів, спирту та ін. розчинний в концентрованих розчинах деяких солей (хлорид цинку, тіоцианат літію, солі кальцію). При нагріванні з концентрованими розчинами мінеральних кислот він гідролізується.
Одним з похідних хітину, який отримують промисловим способом є хітозан. Сировиною для його отримання слугують панцирі ракоподібних (криль, камчатський краб та ін.), а також продукти мікробіологічного синтезу. Спрощена схема виробництва хітину і хітозану хімічним способом приведена на рис.32.
Тривалість, температура, кратність і порядок кислотного і лужного оброблення залежать від виду сировини, ступеню її мінералізації і протеїнизації, потрібної якості хітину, вона встановлюється конкретно для кожного процесу. Наприклад, в Японії панцирі крабів промивають у воді, обробляють 5 – 10%-вою соляною кислотою при кімнатній1 температурі і перемішуванні протягом декількох годин.
Димінералізовану масу промивають у воді, обробляють 5 – 8%-вим розчином натрієвого лугу при нагріванні. Отриманий хітин промивають у воді, висушують і подрібнюють. У висушеному вигляді він являє собою сухі волокна, пластівці або порошок від білого або світло-рожевого до кремового кольору. Вміст в ньому вологи повинен бути не більше 10%, а вміст золи – не більше 2%, рН 6,5 – 7,8.
З хітину шляхом проведення реакції деацетилювання отримують хітозан з вмістом азоту не більше 1%. Для проведення реакції деацетилювання хітин обробляють 40 – 590%-вим натрієвим лугом при високотемпературному нагріванні. Використання такого жорсткого режиму проведення реакції сприяє високому ступеню деацетилювання хітину (до 80 – 93%). Але, деструкція, яка при цьому протікає, призводить до зменшення молекулярної маси полімеру, і погіршення його функціональних властивостей як структуроутворювача. Щоб запобігти цьому проводять деацетилювання хітину в атмосфері азоту при пониженій температурі або обробку гідразингідратом при температурі 120 – 1500С протягом 2 – 42 годин. По закінченню деацетилювання хітозан промивають водою до нейтральної реакції і висушують до повітряно-сухого стану.
 |
Рис.32 Схема виробництва хітину і хітозану
В залежності від призначення отримують хітозан медичний, харчовий, кормовий і технічний, які характеризуються наступними показниками якості (табл.8)
Таблиця 8
Показники якості хітозану
| Показники | Тип хітозану | ||
| харчовий | кормовий | технічний | |
| Зовнішній вигляд | Дрібноволокнисті частинки розміолм не більше 1мм, або порошок | Пластівці різних розмірів або порошок | Пластівці різних розмірів або порошок |
| Колір | Від білого до кремового або рожевого | Від білого до кремового або коричневого | Від білого до кремового або коричневого |
| Смак 1%-вого розчину хітозану в 1%-вому розчині оцтової кислоти | Властивий без стороннього присмаку | ||
| Запах | Властивий без стороннього запаху | Властивий без стороннього запаху | Властивий без стороннього запаху |
| Прозорість 10"^ м, не менше | 8,0 | 5,6 | 7,0 |
| Вміст (% по масі), не более | |||
| вологи | 10,0 | 14,0 | 14,0 |
| мінеральних речовин | 1,0 | - | 1,5 |
| речовин, нерозчинних в 2%-вій оцтовій кислоті | 0,5 | — | 1,0 |
| Кінематична вязкістьь(10'8 м2/с), не менше | 800,0 | 100,0 | 100,0 |
| Наявність солей важких металів | Не допускается | Не допускается | - |
Хітин і хітозан утворюються і розкладаються живими організмами, тому є екологічно чистими високомолекулярними природними сполуками. Шляхи господарського використання хітину і хітозану визначаються їх властивостями. Причому хітин в силу своєї інертності менше знаходить практичне використання ніж хітозан. Хімічна реакційна здатність хітозану обумовлена наявністю в його молекулах вільних аміногруп. Цей полімер характеризується слаболужними і аніонобмінними властивостями, і його можна класифікувати як смолу, що спричиняє утворення хелатних сполук.
Властивість хітозану розчиняться в розведених органічних і мінеральних кислотах з утворенням прозорих в’язких розчинів покладено в основу його використання в різних галузях промисловості, насамперед в харчовій в якості структуроутворювача.
Швидкість розчинення хітозану невисока. Тривалість розчинення порошкоподібного хітозану становить 35 – 40 хв., а при перемішуванні і нагріванні – 15 хв. при температурі 800С хітозан розчиняється втричі швидше, ніж при 200С, що пояснюється збільшенням швидкості дифузійних процесів. Попереднє набрякання хітозану у воді дозволяє скоротити тривалість процесу його розчинення. Водопоглинання хітину, мікрокристалічного хітину і хітозану значно вище, ніж мікрокристалічної целюлози.
Внесення хітозану у воду, яка з ним хімічно не взаємодіє, забезпечує швидке набрякання полімеру. Причому, кожна частинка хітозану набрякає окремо від інших і отримана маса (золь) є однорідною (не містить грудочок). При додаванні в цю масу концентрованої кислоти і наступному перемішуванні остання перш за все розчиняється у воді, а отриманий розчин кислоти вже потім взаємодіє з хітозаном і переводить його в сольову форму (відбувається розчинення). При цьому взаємодія між розчинником і хітозаном протікає по всій поверхні кожної частинки полімеру, що й забезпечує збільшення швидкості процесу розчинення хітозану. Загальна тривалість процесу приготування розчинів хітозану з використанням попереднього набрякання становить 7 – 9 хв.
Мінімальна кількість кислот, введення яких забезпечує розчинення хітозану різна: оцтової кислоти – 0,5%; лимонної – 2,5%; щавлевої – 5%. Це пояснюється різною здатністю кислот до утворення іонного зв’язку з аміногрупою полімеру. Для кожної концентрації кислоти характерна визначена кількість хітозану, що здатна до іонного розчинення в ній. Наприклад, отримати 12%-вий розчин хітозану можна, використовуючи розчин оцтової кислоти не менше 2%-вої концентрації. Збільшення вмісту хітозану в розчині змінює рН до значень, характерних для нейтрального середовища, тому що присутня аміногрупа хітозану має властивості слабкого лугу.
Густина розчинів хітозану зростає із збільшенням в них концентрації полімеру. При концентрації хітозану 0,2 – 1,0%, густина розчинів збільшується з 1000 до 1006кг/м3.
В процесі зберігання розчинів хітозану відмирають мікробні клітини, що пояснюється присутністю в розчині оцтової кислоти, а також бактерицидною дією самого хітозану.
В'язкість розчинів хітозану залежить від типу розчинника, концентрації полімеру і розчинника, температури, молекулярної маси хітозану, Рн і присутністю в розчині визначених солей.
В'язкість розчинів хітозану, як і більшості високомолекулярних сполук, збільшується із зростанням концентрації полімеру. Пояснюється це тим, що в області низьких концентрацій макромолекули хітозану переміщуються незалежно одна від одної. При досягненні визначеної концентрації не можуть розглядатися як незалежні кінетичні одиниці, і переміщення однієї з них призводить до зміни просторового положення інших, що пояснює збільшення вязкісних характеристик системи. В'язкість розчинів зростає із збільшенням концентрації кислоти (відповідно із зниженням рН), що пов’язано з розвертанням хітозанових ланцюгів, зростанням числа аміногруп (зниження рН), в результаті чого ланцюги дуже подовжуються і випрямляються.
При зберіганні розчинів хітозану їх в'язкість зменшується, тому в технологічних процесах рекомендовано використовувати свіжоприготовлені розчини. Найбільша швидкість зниження в’язкості (в середньому на 10,6%) спостерігається в перші 4 години зберігання, що пов’язано із зміною форми і розмірів макромолекул, а також утворенням і розпадом їх асоціатів.
В'язкість розчинів хітозану із збільшенням температури зменшується (особливо інтенсивно при температурах 20 – 600С). пояснюється це тим, що кінетична енергія розчинника і розчиненої речовини зростає, в результаті чого збільшується гнучкість ланцюгів і відстань між їх кінцями. Розчини знову набувають вихідної в’язкості після їх охолодження до початкової температури при умовах нагрівання до помірних температур (до 600С).
Розчини хітозану завдяки присутнім в макромолекулах функціональних аміногруп і гідроксильних груп виявляють високу адгезій ну здатність. Липкість розчинів хітозану збільшується із зростанням його концентрації в розчині і в залежності від матеріалу, до якого він прилипає.
За реологічними властивостями хітозани поділяють на:
– низькоконцентровані, з вмістом хітозану до 2%;
– середньої концентрації, з вмістом хітозану від 2 до 5%;
– висококонцентровані, з вмістом хітозану більше 5%.
В якості структуроутворювачів використовують середньо- і низькоконцентровані розчини хітозану.
Розчини хітозану мають здатність утворювати стійкі гелі. Наприклад, хітозанових гель у водному розчині щавлевої кислоти (10%-вої), прозорий, безбарвний, без запаху, жорсткий, здатний до синерезису. Хітозанові гелі мають схожі властивості (особливо міцність) з кальційальгінатними гелями.
Природа співрозчинника суттєво впливає на процес утворення хітозанового гелю. Додавання 1% метанолу або формаліну до 5%-вої оцтової кислоти забезпечує швидке гомогенне гелеутворення. В той же час n-бутанол сприяє утворенню гелю у вигляді грудочок, а при використанні етиленгліколю гель взагалі не утворюється.
Емульгуючу здатність виявляє лише мікрокристалічний хітин. Ця його здатність виявляється лише при визначеній його концентрації, температурі і рН середовища. Встановлено, що емульсії з вмістом хітозану не менше 0,5% стабільні після центрифугування, нагрівання і охолодження, якщо при емульгуванні підтримується температура 90 – 1000С і рН середовища не вище 4. В’язкісні характеристики емульсій зростають із збільшенням в них концентрації хітозану, що свідчить про його здатність до згущення. Виявлення хітозаном властивостей емульгатора пояснюється наявністю в нього функціональних груп, що взаємодіють з жировою фазою емульсії. Розчини хітозану до того ж виявляють вологоутримуючу здатність.
Таким чином можна вважати перспективним використання хітозану:
– в якості структуроутворювача в технології сировини водного походження;
– в якості емульгатора простих (олія/вода) і складних (томатно-олійна заливка та ін.) емульсій;
– в якості згущувача соусів, приправ, паштетів, паст;
– в якості харчового клею для придання продуктам з широким діапазоном вологості (10 – 80%) визначеної форми і заданої структури;
– в якості добавки, що підвищує водостійкість і міцність гранульованих продуктів та ін.
До групи полісахаридів тваринного походження відносяться також глікогени, гепарин, хондроітинсульфати. На відміну від хітозану вони не знайшли широкого застосування в харчовій промисловості, але їх біологічне значення для організму є важливим.
КОНТРОЛЬНІ ЗАПИТАННЯ
1. З якої сировини отримують хітин?
2. З яких стадій складається процес виробництва хітозану?
3. Які властивості хітозану визначають їх функціональне призначення як харчових добавок?
4. Які чинники і як впливають на розчинність хітозану?
5. Від яких чинників залежить в'язкість розчинів хітозану?
ЛІТЕРАТУРА
2. Нечаев А.П., Траубенберг С.Е., Кочеткова А.А. Пищевая химия. – СПб.: ГИОРД, 2001. – 592 с. 3. Донченко Л.В. Технология пектина и пектинопродуктов. – М.: ДеЛи, 2000. –… 4. Карпович Н.С., Донченко Л.В., Нелина В.В и др. Пектин. Производство и применение. – К.: Урожай, 1989. – 88 с.– Конец работы –
Используемые теги: Конспект, лекцій, дисципліни, технології, полісахаридів, Застосування, харчовій, промисловості0.114
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: КОНСПЕКТ ЛЕКЦІЙ З ДИСЦИПЛІНИ ТЕХНОЛОГІЇ ПОЛІСАХАРИДІВ ТА ЇХ ЗАСТОСУВАННЯ В ХАРЧОВІЙ ПРОМИСЛОВОСТІ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов