рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- З БІОЛОГІЧНОЇ ХІМІЇ
Реферат Курсовая Конспект
З БІОЛОГІЧНОЇ ХІМІЇ
З БІОЛОГІЧНОЇ ХІМІЇ - раздел Философия, Львівський Національний Медичний Університет Імені Данила Галицького...
ЛЬВІВСЬКИЙ НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
імені Данила Галицького
КАФЕДРА БІОлогіЧНОЇ ХІМІЇ
МЕТОДИЧНІ ВКАЗІВКИ для практичних занять
З БІОЛОГІЧНОЇ ХІМІЇ
(для студентів медичного факультету)
Частина ІI
ЛЬВІВ 2013
Методичні вказівки підготували:
Проф. Скляров О.Я., доц. Бондарчук Т.І., доц. Макаренко Т.М., в.о.доц. Федевич Ю. М., ст. викл. Хаврона О.П., ас. Білецька Л.П.., ас. Гринчишин Н.М., ас. Мазур О.Є.
За редакцією акад. УАН, д. мед. н., проф. Склярова О. Я.
Рецензент:
проф. кафедри фармацевтичної, органічної та біоорганічної хімії Львівського національного медичного університету імені Данила Галицького
проф. Музиченко В. О.
Затверджено на засіданні методичної комісії з хімічних дисциплін та фізики фармацевтичного факультету Львівського національного медичного університету ім. Данила Галицького
від „ 7 ” травня 2012 року
протокол № 2
ЗМІСТ
| стор | |
| Загальні правила техніки безпеки при роботі студентів у навчальній хімічній лабораторії | |
| Модуль 4. Молекулярна біологія. Біохімія міжклітинних комунікацій. | |
| Тематичний план практичних занять з модуля 4. | |
| Тематичний план лекцій модуля 4 | |
| Завдання для самостійної роботи студентів (СРС) | |
| Змістовий модуль № 12. Основи молекулярної біології. | |
| Тема № 1. Дослідження біохімічного складу пуринових та піримідинових нуклеотидів. Біохімічні функції нуклеотидів та нуклеїнових кислот. | |
| Тема № 2. Дослідження катаболізму пуринових нуклеотидів. Визначення кінцевих продуктів їх обміну. Спадкові порушення їх обміну. | |
| Тема № 3. Дослідження реплікації ДНК та транскрипції РНК. Аналіз механізмів мутацій, репарацій ДНК. Засвоєння принципів отримання рекомбінантних ДНК, трансгенних білків. | |
| Змістовий модуль № 13. Основи молекулярної генетики. | |
| Тема № 4. Біосинтез білка у рибосомах. Дослідження процесів ініціації, елонгації та термінації в синтезі поліпептидного ланцюга. Інгібіторна дія антибіотиків. Засвоєння принципів генної інженерії та клонування генів, їх застосування в сучасній медицині. | |
| Змістовий модуль № 14. Молекулярні механізми дії гормонів на клітини-мішені. | |
| Тема № 5. Дослідження молекулярно-клітинних механізмів дії гормонів білково-пептидної природи на клітини-мішені. Механізми дії гормонів – похідних амінокислот та біогенних амінів. | |
| Змістовий модуль № 15. Біохімія нейро-гуморальної регуляції метаболізму. | |
| Тема № 6. Дослідження молекулярно-клітинних механізмів дії стероїдних та тиреоїдних гормонів на клітини-мішені. Гормональна регуляція гомеостазу кальцію. | |
| Тема № 7. Дослідження нервової тканини. Патохімія психічних порушень. | |
| Змістовий модуль № 16.Біохімія м’язової тканини і механізми її скорочення. | |
| Тема № 8. Дослідження процесів м’язового скорочення. | |
| Тема № 9. Підсумковий контроль. Модуль 4. | |
| Модуль 5. Біохімія тканин та фізіологічних функцій | |
| Тематичний план практичних занять з модуля 5 | |
| Тематичний план лекцій модуля 5 | |
| Завдання для самостійної роботи студентів (СРС) | |
| Змістовий модуль № 17.Біохімія харчування людини. Вітаміни як компоненти харчування. | |
| Тема № 1. Дослідження процесу перетравлення поживних речовин (білків, вуглеводів, ліпідів) у травному тракті. | |
| Тема № 2. Дослідження функціональної ролі водорозчинних (коферментних) та жиророзчинних вітамінів у метаболізмі та реалізації клітинних функцій. | |
| Змістовий модуль № 18. Біохімія та патобіохімія крові. | |
| Тема № 3. Дослідження кислотно-основного стану крові та дихальної функції еритроцитів. Патологічні форми гемоглобінів. | |
| Тема № 4. Дослідження білків плазми крові: білки гострої фази запалення, власні та індикаторні ферменти. Дослідження небілкових азотовмісних і безазотистих компонентів крові. | |
| Тема № 5. Дослідження згортальної, антизгортальної та фібринолітичної систем крові. Дослідження біохімічних закономірностей реалізації імунних процесів. Імунодефіцитні стани. | |
| Змістовий модуль № 19.Функціональна та клінічна біохімія органів і тканин. | |
| Тема № 6. Дослідження обміну кінцевих продуктів катаболізму гему. Патобіохімія жовтяниць. | |
| Тема № 7. Дослідження процесів біотрансформації ксенобіотиків та ендогенних токсинів. Мікросомальне окиснення, цитохром Р-450. | |
| Тема № 8. Дослідження водно-сольового та мінерального обмінів. | |
| Тема № 9. Сечоутворювальна функція нирок. Нормальні та патологічні компоненти сечі. | |
| Тема № 10. Дослідження біохімічних складників сполучної тканини. | |
| Тема № 11. Підсумковий контроль. Модуль 5. |
ЗАГАЛЬНІ ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПРИ РОБОТІ СТУДЕНТІВ У НАВЧАЛЬНІЙ ХІМІЧНІЙ ЛАБОРАТОРІЇ
1. Перебуваючи в хімічній лабораторії, необхідно суворо дотримуватись загальних правил техніки безпеки, пам’ятаючи, що будь - яке порушення може призвести до нещасного випадку.
2. У хімічній лабораторії працювати тільки в медичних халатах та шапочках. Довге волосся має бути акуратно підібране.
3. На робочому місці залишати тільки необхідні речі (книгу, зошити, ручки), всі інші речі (портфелі, сумки, одяг) зберігати в спеціально відведеному для цього місці, одяг у гардеробі.
4. Кожен студент повинен працювати за закріпленим за ним місцем, перехід на інше робоче місце без дозволу викладача не допускається.
5. Категорично забороняється виконувати в лабораторії роботи, не пов’язані із виконанням навчального практикуму.
6. Реактиви після їх використання необхідно ставити на відведене місце.
7. Роботи з концентрованими кислотами, лугами слід проводити обережно, під витяжною шафою, щоб виключити можливість їх потрапляння в очі, а також появи опіків і пошкодження одягу.
8. Бути обережним при роботі з електроприладами. Працювати тільки із заземленим обладнанням.
9. При запалюванні газу, кран пальника відкривати поступово.
10. Для уникнення нещасних випадків не працювати з леткими та легкозаймистими речовинами поблизу запаленого пальника.
11. Користуватись горючими і токсичними речовинами (галогени, концентровані кислоти, луги, сірководень і т.д.), а також проводити досліди, які супроводжуються виділенням шкідливих парів, газів, дозволяється тільки у витяжній шафі.
12. При нагріванні речовин у пробірці - не направляти її отвір у бік товариша, який працює, або до себе.
13. Не можна залишати в лабораторії без нагляду включені фотоелектроколориметри, водяні бані, газові пальники, центрифуги тощо.
14. У випадку пожежі негайно погасити найближчі пальники і гасити вогонь використовуючи вогнегасник, покривало, пісок.
15. При опіках: а) сильними лугами – необхідно промити уражені ділянки тіла водою і накласти компрес, змочений 1% розчином оцтової кислоти; б) сильними кислотами – необхідно промити уражені ділянки тіла водою і накласти компрес, змочений 1% розчином соди; в) фенолом – необхідно розтерти побілілу від опіку ділянку до нормального стану шкіри, а потім промити водою і накласти пов’язку з гліцерином.
16. У разі потрапляння кислоти або лугу в очі необхідно промити їх великою кількістю води, а потім 2% розчином соди або борної кислоти.
17. Не виливати в раковину вміст пробірок з концентрованими кислотами та лугами.
18. Не кидати папір, сірники, побитий посуд в водостічну раковину, для цього користуватись ящиками для сміття.
19. Після закінчення роботи привести в порядок своє робоче місце, протерти полиці і стіл вологою ганчіркою, поставити посуд з реактивами на відведене місце виключити воду та газ.
20. Під час заняття мобільні телефони повинні бути виключеними.
Електронні версіі навчально-методичної літератури та тести ліцензійного іспиту « Крок -1» студенти можуть отримати на кафедрі біохімії в комп’ютерній кімнаті на робочому столі комп’ютера в папці «Навчально-методична література для студентів» та на університетському web-сайті: www.meduniv.lviv.ua та на сайті кафедри:
http://www.meduniv.lviv.ua/index.php?option=com_content&view=article&id=144&Itemid=182&lang=uk
З тестовими завданнями з біохімії до ліцензійного іспиту «Крок-1» можна ознайомитися на сайті http://www.testcentr.org.ua (база даних Центру тестування).
Модуль 4. Молекулярна біологія. Біохімія міжклітинних комунікацій
Тематичний план практичних занять з модуля 4
| № з/п | Тема | Кіл-сть годин |
| Дослідження біохімічного складу пуринових та піримідинових нуклеотидів. Біохімічні функції нуклеотидів та нуклеїнових кислот. | ||
| Дослідження катаболізму пуринових нуклеотидів. Визначення кінцевих продуктів їх обміну. Спадкові порушення їх обміну | ||
| Дослідження реплікації ДНК та транскрипції РНК. Аналіз механізмів мутацій, репарацій ДНК. Засвоєння принципів отримання рекомбінантних ДНК, трансгенних білків. | ||
| Біосинтез білка у рибосомах. Дослідження процесів ініціації, елонгації та термінації в синтезі поліпептидного ланцюга. Інгібіторна дія антибіотиків. Засвоєння принципів генної інженерії та клонування генів, їх застосування в сучасній медицині. | ||
| Дослідження молекулярно-клітинних механізмів дії гормонів білково-пептидної природи на клітини-мішені. Механізми дії гормонів – похідних амінокислот та біогенних амінів. | ||
| Дослідження молекулярно – клітинних механізмів дії стероїдних та тиреоїдних гормонів на клітини-мішені. Гормональна регуляція гомеостазу кальцію. | ||
| Дослідження нервової тканини. Патохімія психічних порушень. | ||
| Дослідження процесів м’язового скорочення. | ||
| Індивідуальна самостійна робота студентів | ||
| Підсумковий модульний контроль | ||
| Разом (годин, балів) |
Тематичний план лекцій з модуля 4
| Модуль 4: Молекулярна біологія. Біохімія міжклітинних комунікацій | ||
| Біосинтез та катаболізм пуринових та піримідинових нуклеотидів. | ||
| Біосинтез нуклеїнових кислот: реплікація ДНК; транскрипція РНК. Біосинтез білків в рибосомах. Регуляція експресії генів. Молекулярні механізми мутацій. | ||
| Гормони –1: біохімічні та молекулярно-біологічні механізми дії гормонів; гормони білково-пептидної природи. | ||
| Гормони –2: гормони та біорегулятори – похідні амінокислот; гормони та фізіологічно активні сполуки ліпідного походження. | ||
| Разом |
Завдання для самостійної роботи студентів (СРС)
| № п/п | Тема | Кількість годин |
| 1. | Підготовка до практичних занять: | |
| 1.1 | Набути практичні навики з молекулярної біології та генетики: | |
| Малювати схеми послідовних етапів процесів реплікації, транскрипції та трансляції. | ||
| Пояснювати молекулярні механізми регуляції в реалізації генетичної інформації. | ||
| Оцінювати вроджені вади метаболізму (молекулярні хвороби) як наслідок генетичних пошкоджень та точкових мутацій. | ||
| 1.2 | Набути практичні навики з біохімії та молекулярної біології гормональної регуляції: | |
| Писати структурні формули гормонів – похідних амінокислот та стероїдних гормонів. | ||
| Пояснювати молекулярно-клітинні механізми дії пептидних, стероїдних, тиреоїдних, амінних гормонів. | ||
| Оцінювати порушення метаболізму при недостатньому та надлишковому утворенні гормонів. | ||
| Оцінювати зміни гомеостазу кальцію при гормональному дисбалансі. | ||
| 2. | Індивідуальна СРС за вибором (індивідуальне завдання) – за темами рефератів. | |
| 3. | Підготовка до підсумкового контролю засвоєння модуля 4. | |
| Разом |
Вимоги до виконання та перевірки самостійної роботи студентів (СРС)
1. Оформляється у зошитах з самопідготовки.
2. Питання самостійної роботи включені у підсумкові модульні контролі.
3. Наявність та якість самостійної роботи перевіряється викладачами на практичних заняттях з біохімії.
4. В кінці роботи викладач вносить зауваження, ставить дату перевірки і підпис.
Критерії оцінювання поточної навчальної діяльності студента
При засвоєнні теми за традиційною системою студенту присвоюються бали:
Балів, „4” – 12 балів, „3” – 9 балів, „2” – 0 балів.
Максимальна кількість балів за поточну навчальну діяльність студента – 120.
Студент допускається до підсумкового модульного контролю за умов виконання навчальної програми та у разі, якщо за поточну навчальну діяльність він набрав не менше 72 балів (9 × 8 = 72).
Підсумковий тестовий контроль зараховується студенту, якщо він демонструє володіння практичними навичками та набрав за тести і теоретичні питання не менше 50 балів.
Методика проведення та критерії оцінювання підсумкового модульного контролю
І етап - письмова відповідь на тестові завдання формату А (бланковий або комп'ютерний тестовий контроль). Студент відповідає на пакет тестів. Кожний… ІІ етап - письмова відповідь на 4 теоретичні питання; III-етап - перевірка… Теоретичні питання та питання з практичних навичок оцінюються:Теоретичні питання
2. Вільні біологічно активні нуклеотиди та їх біохімічні функції: участь у метаболічних реакціях (АТФ, НАД, НАДФ, ФАД, ФМН, ЦТФ, УТФ) та їх… 3. Нуклеїнові кислоти: структура, властивості, історичні етапи вивчення.… 4. Будова, властивості та біологічні функції ДНК. Експериментальне доведення генетичної ролі ДНК (феномен…Практична робота
Якісні реакції на складові частини нуклеопротеїнів
Принцип методу.Для вивчення хімічного складу нуклеопротеїнів зручно користуватися дріжджовими клітинами. Продукти гідролізу можна виявити в гідролізаті реакціями, специфічними для компонентів нуклеопротеїнів.
Матеріальне забезпечення:500 мг пекарських дріжджів або 100 мг сухих дріжджів, 10% розчин H2SO4, пробірки, піпетки, фільтрувальний папір, водяна баня.
Хід роботи: У велику широку пробірку (15 x 1,5 см) кладуть 500 мг пекарських дріжджів або 100 мг сухих дріжджів, заливають 4 мл 10 % розчину H2SO4. Пробірку закривають корком, у який вставлена трубка довжиною 25-30 см, яка служить холодильником, збовтують і ставлять у киплячу водяну баню.
Через 1 – 1,5 год після початку кипіння рідину охолоджують і фільтрують. У фільтраті виявляють продукти гідролізу нуклеопротеїнів: поліпептиди, пуринові та піримідинові азотисті основи, рибозу, дезоксирибозу і фосфатну кислоту.
Дослід 1. Біуретова проба на поліпептиди.
Принцип методу.Біуретова реакція – характерна на сполуки, що містять у своєму складі не менше двох пептидних зв’язків. Такі речовини у лужному середовищі утворюють з СuSO4 комплекс рожево-фіолетового забарвлення. В утворенні цього комплексу беруть участь пептидні зв’язки поліпептидів і білків.
Матеріальне забезпечення:гідролізат дріжджів, 10 % розчин NaOH, 30 % розчин NaOH, 1% розчин CuSO4, пробірки, піпетки.
Хід роботи:До 5 крапель гідролізату додають 10 крапель 10 % розчину NaOH і 1 краплю 1 % розчину CuSO4. Рідина забарвлюється в рожево-фіолетовий колір.
У висновку пояснити, що в даній реакції виявляються пептидні зв’язки, якими амінокислоти сполучаються між собою.
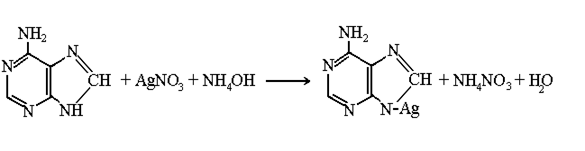
Дослід 2. Срібна проба на пуринові основи.
Принцип методу.Пуринові основи з аміачним розчином аргентуму нітрату утворюють осад, що забарвлюється у світло-коричневий колір.
Матеріальне забезпечення: гідролізат дріжджів, конц. розчин NH4OH, 1% розчин AgNO3, пробірки, піпетки.
Хід роботи:10 крапель гідролізату нейтралізують концентрованим аміаком і додають 5 крапель 1 % розчину AgNO3. При стоянні через 3-5 хв випадає невеликий пухкий осад світло-коричневого кольору срібних солей пуринових основ (аденіну, гуаніну). Реакція відбувається за рівнянням:
 Зробити висновок.
Зробити висновок.
Дослід 3. Проба Тромера на рибозу і дезоксирибозу.
Принцип методу.Моно- і дисахариди, які мають у своєму складі вільний півацетальний гідроксил, здатні у лужному середовищі відновлювати метали (аргентум, купрум, вісмут та інші). Метали у цій реакції відновлюються з одночасним розривом вуглеводневого ланцюга цукрів та полімеризацією.
Матеріальне забезпечення:гідролізат дріжджів, 30 % розчин NaOH, 1% розчин CuSO4, 7 % розчин CuSO4, пробірки, піпетки.
Хід роботи: До 5 крапель гідролізату додають 10 крапель 30 % розчину NaOH і 5 – 10 крапель 7 % розчину CuSO4 до появи муті Cu(OH)2, яка не зникає. Рідину змішують і верхній її шар нагрівають до кипіння. Випадає червоний осад закису міді (внаслідок окиснення рибози і відновлення гідрату окису міді до закису).
У висновку звертається увага на те, що рибоза окислюється, а гідрат окису міді відновлюється до закису міді.
Дослід 4. Молібденова проба на фосфатну кислоту.
Матеріальне забезпечення: гідролізат дріжджів, молібденовий реактив, пробірки, піпетки. Хід роботи: До 10 крапель молібденового реактиву (розчин молібденового амонію…Контроль виконання лабораторної роботи
1. Пояснити механізм утворення подвійної спіралі ДНК.
2. Пояснити механізм утворення шпильок в молекулі тРНК.
3. Які надмолекулярні комплекси утворюють нуклеїнові кислоти? Визначити основні компоненти нуклеопротеїну (білка, азотистої основи, пентози, фосфорної кислоти) в його гідролізаті. Поясніть принципи методів.
4. Що таке повний і неповний гідроліз нуклеопротеїнів?
5. Назвіть продукти гідролізу нуклеопротеїнів?
6. Які продукти гідролізу виявляються пробою Тромера?
7. Які продукти гідролізу дають біуретову реакцію?
8. Новонароджені в період вигодовування не отримують нуклеїнові кислоти з молоком, але вони інтенсивно ростуть, збільшується кількість клітин, безперервно відбувається гемопоез, синтез білків, тобто відбуваються процеси, що потребують iРНК, тРНК, рРНК, ДНК. За рахунок яких сполук підвищується вміст нуклеїнових кислот?
9. У двох препаратах ДНК вміст аденіну становить відповідно 25 і 12 % від загального вмісту азотистих основ. Обчисліть відносний вміст тиміну, цитозину і гуаніну в цих препаратах ДНК.
Приклади тестів „Крок-1”
РНК вірусу СНІДу проникла всередину лейкоцита і за допомогою ензима ревертази спричинила синтез у клітині вірусної ДНК. В основі цього процесу лежить...
A. Зворотня транскрипція
B. Дерепресія оперону
C. Репресія оперону
D. Конваріантна реплікація
E. Зворотня трансляція
2. Із нітратів, нітритів і нітрозамінів в організмі утворюється азотиста кислота, яка зумовлює окисне дезамінування азотистих основ нуклеотидів. Це може призвести до точкової мутації – заміни цитозину на..
А. Тимін
В. Урацил
С. Аденін
D. Гуанін
E. Інозин
3. Нітрозаміни належать до дезамінуючих мутагенів. З якої азотистої основи в результаті їх дії утворюється урацил?
А. Цитозину
B. Аденіну
C. Гуаніну
D. Тиміну
E. Метилурацилу
Індивідуальна самостійна робота студентів
1. Структура, властивості та біологічне значення нуклеопротеїнів, фосфопротеїнів, ліпопротеїнів та глікопротеїнів.
2. Особливості синтезу та розпаду нуклеопротеїнів, глікопротеїнів і протеогліканів.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – 508 с.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – 60 – 77 с.
3. Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. – Тернопіль: Укрмедкнига, 2002. – 744 с.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – К.: Медицина, 2010. – 360 с.
5. Біохімічні показники в нормі і при патології. Довідник / За ред. Склярова О.Я. – К.: Медицина, 2007. – 320 c.
6. Практикум з біологічної хімії / За ред. О.Я. Склярова. – К.: Здоров’я, 2002. – С. 47-50.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 96-113.
2. Вдовенко Н.В. Фізіологічна роль та фармакологічні властивості АТФ і її похідних // Вісн.пробл. біології і медицини. – 2004. – Вип. 1. – С. 3-8.
3. Кольман Я., Рем К.-Г. Наглядная биохимия. – М.: Мир, 2000. – С. 86-93.
4. Кордюм В., Похоленко Я., ДНК- вакцины – расширение возможностей // Вісн. фармакології та фармації. – 2004. – № 10. – С. 2-9.
5. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 5-14, 35-81.
6. Мещишен І.Ф., Пішак В.П., Григор’єва Н.П. Біомолекули: структура та функції. – Чернівці: Медик, 2000. – С. 52-57
Тема № 2. Дослідження катаболізму пуринових нуклеотидів. Визначення кінцевих продуктів їх обміну. Спадкові порушення їх обміну.
Мета заняття: Засвоїти особливості реакцій синтезу та розпаду пуринових і піримідинових нуклеотидів в нормі та за умов природжених ензимопатій цих процесів. Оволодіти методами визначення кількості сечової кислоти у біологічних рідинах та вміти інтерпретувати отримані дані.
Актуальність теми: Порушення процесів біосинтезу і катаболізму пуринових та піримідинових азотистих основ та нуклеотидів можуть приводити до розвитку таких захворювань як синдром Леша-Ніхана, подагра, оротацидурія. Знання основних метаболітів та ензимів цих процесів є необхідним для діагностики і контролю за лікуванням.
Конкретні завдання:
Ø Аналізувати послідовність реакцій біосинтезу та катаболізму пуринових нуклеотидів, порушення синтезу сечової кислоти і біохімічні основи розвитку подагри.
Ø Аналізувати послідовність реакцій біосинтезу та катаболізму піримідинових нуклеотидів.
Ø Кількісно визначити сечову кислоту в біологічних рідинах, вміти інтерпретувати отримані результати.
Теоретичні питання
1. Біосинтез пуринових нуклеотидів:
· cхема реакцій синтезу ІМФ;
· утворення АМФ, ГМФ, АТФ, ГТФ;
· регуляція біосинтезу пуринових нуклеотидів за принципом негативного зворотного зв’язку (ретроінгібування).
2. Біосинтез піримідинових нуклеотидів: реакції; регуляція. Клініко-біохімічна характеристика оротацидурій.
3. Біосинтез дезоксирибонуклеотидів. Утворення тимідилових нуклеотидів; інгібітори біосинтезу дТМФ як протипухлинні засоби (структурні аналоги дТМФ, похідні птерину).
4. Катаболізм пуринових нуклеотидів; cпадкові порушення обміну сечової кислоти. Клініко-біохімічна характеристика гіперурикемії, подагри, синдрому Леша-Ніхана.
5. Катаболізм піримідинових нуклеотидів; метаболізм продуктів їх розпаду.
Практична робота
Дослід 1. Кількісне визначення сечової кислоти в сироватці крові.
Матеріальне забезпечення:сироватка або плазма крові, 10 % розчин натрію дигідрогенвольфрамат дигідрату, 10 % розчин натрію карбонату, 0,35 М розчин… Хід роботи:У центрифугову пробірку вміщують 0,5 мл сироватки крові та 4 мл… Визначення сечової кислоти в сироватці крові Контрольна проба Стандартна проба …Дослід 2. Кількісне визначення сечової кислоти в сечі.
Матеріальне забезпечення:сеча, фосфатвольфраматний реактив Фоліна, 20% розчин натрію карбонату Na2CO3, 0,01н розчин калію фериціаніду K3[Fe(CN)6]… Хід роботи:Паралельно до 1,5 мл сечі та 1,5 мл стандартного розчину сечової… Вміст сечової кислоти (в міліграмах) в добовій сечі вираховують за формулою:Контроль виконання лабораторної роботи
1. Пояснити принцип методу визначення вмісту сечової кислоти в біологічній рідині з реактивом Фоліна. Клініко-діагностичне значення визначення сечової кислоти в крові та сечі.
2. Похідне уридину, фторурацил, перетворюється в клітині на фтордезоксіуридилат – сильний незворотній інгібітор тимідилатcинтази. Як пояснити факт пригнічення фторурацилом швидкого поділу ракових клітин у експериментальних тварин?
Приклади тестів “Крок-1”
У сечі місячної дитини виявлено підвищений вміст оротової кислоти. Дитина погано набирає масу тіла. Які речовини потрібно використати для нормалізації метаболізму?
А. Уридин
B. Аденозин
C. Гуанозин
D.Тимідин
E. Гістидин
2. Утворення тимідилових нуклеотидів, які використовуються для біосинтезу ДНК, відбувається з дУДФ, що спершу гідролізується до дУМФ, а далі метилюється. Яка сполука слугує донором метильних груп?
A. Лецитин
B. Холін
C. Метилентетрагідрофолат
D. Метіонін
E. Карнітин
3. У реакції перетворення рибози на дезоксирибозу під час утворення дезоксирибонуклеотидів, що використовуються для синтезу ДНК, бере участь низькомолекулярний білок тіоредоксин. Він містить дві SH-групи, що можуть переходити в окиснену форму. Який коензим використовується для відновлення тіоредоксину?
А. Коензим Q
B. ПАЛФ
C. НАДФН
D. НАДН
E. АМФ
4. Чоловіка віком 60 років прооперували з приводу раку простати. Через 2 місяці йому призначили курс хіміотерапії. До комплексу лікарських препаратів входив 5-фтордезоксіуридин – інгібітор тимідилатсинтази. Синтез насамперед якої речовини блокується під дією цього препарату?
А. іРНК
B. рРНК
C. тРНК
D. ДНК
E. Білка
Індивідуальна самостійна робота студентів
1. Особливості процесів синтезу та розпаду пуринових і піримідинових нуклеотидів в нормі та при патології.
2. Роль аденілових нуклеотидів в регуляції активності ферментів.
Література
Основна:
1. Губський Ю.І.. Біологічна хімія. Київ-Тернопіль: Укрмедкнига, 2000. - С. 270-283.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 328-343.
3. Гонський Я.І., Максимчук Т.П. Біохімія людини.-Тернопіль: Укрмедкнига, 2001.- С. 448-462.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Львів: Світ, 2006. – 271 с.
5. Біохімічний склад рідин організму та їх клініко-діагностичне значення /За ред. проф. Склярова О.Я.- Київ: Здоров’я, 2004.-191с.
6. Практикум з біологічної хімії. / За ред О.Я.Склярова .-К.: Здоров’я, 2002.-180-189 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия.- М.: Медицина, 1998. – С. 469-508.
2. Кольман Я., Рем К.-Г. Наглядная биохимия. - М.: Мир, 2000. - С. 188-193.
3. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 15-34.
4. Мещишен І.Ф., Яремій І.М. Особливості обміну речовин у дітей. – Чернівці: БДМА, 2003. - С.18-25.
Тема № 3. Дослідження реплікації ДНК та транскрипції РНК. Аналіз механізмів мутацій, репарацій ДНК. Засвоєння принципів отримання рекомбінантних ДНК, трансгенних білків.
Мета заняття: Знати закономірності матричного синтезу нуклеїнових кислот, етапи цих процесів, механізми мутацій, репарацій та виникнення і розвитку спадкових захворювань. Засвоїти механізм дії антибіотиків та інших інгібіторів синтезу нуклеїнових кислот. Вміти кількісно визначити вміст ДНК у біологічному матеріалі.
Актуальність теми: В процесі біосинтезу нуклеїнових кислот можливі різноманітні порушення нуклеотидної послідовності під впливом фізичних (нагрівання, іонізуючі, корпускулярні опромінення), хімічних (мутагени) та біологічних (віруси) факторів. У медичній практиці широко використовуються фармацевтичні препарати, що інгібують біосинтез нуклеїнових кислот у прокаріотичних організмах та гальмують поділ клітин пухлин у онкологічних хворих.
Конкретні завдання:
Ø Оволодіти методом кількісного визначення ДНК в біологічному матеріалі з метою оцінки інтенсивності реплікаційних та біосинтетичних процесів.
Ø Трактувати молекулярно–біологічні закономірності збереження та передачі генетичної інформації, роль ферментних систем, що забезпечують напівконсервативний механізм реплікації ДНК у прокаріотів та еукаріотів.
Ø Пояснювати механізми функціонування ферментної системи транскрипції РНК.
Ø Трактувати механізми регуляції експресії генів на рівні транскрипції оперонів, які включають структурні та регуляторні гени, промотор та оператор.
Ø Трактувати біохімічні механізми генетичних рекомбінацій, ампліфікації генів, особливості регуляції експресії генів у еукаріотів.
Ø Аналізувати наслідки геномних, хромосомних та генних мутацій, механізми дії найбільш поширених мутагенів, біологічне значення та механізми репарації ДНК (репарація УФ–індукованих генних мутацій).
Теоретичні питання
1. Реплікація ДНК: біологічне значення; напівконсервативний механізм реплікації (схема експерименту М.Мезелсона та Ф.Сталя).
2. Загальна схема біосинтезу ДНК. Ферменти реплікації ДНК у прокаріотів та еукаріотів (розплітаючі білки, праймаза, ДНК-полімерази, ДНК-лігаза). Етапи синтезу дочірніх ланцюгів молекул ДНК (значення антипаралельності ланцюгів ДНК; фрагментів Оказакі).
3. Транскрипція РНК. РНК–полімерази прокаріотів та еукаріотів. Будова транскриптона (оперона). Сигнали транскрипції: промоторні, ініціаторні, термінаторні ділянки генома. Етапи синтезу РНК. Значення зворотної транскриптази. Антибіотики – інгібітори транскрипції.
4. Процесинг – посттранскрипційна модифікація РНК; етапи процесінгу.
5. Регуляція експресії генів прокаріотів: схема регуляції за Ф. Жакобом та Ж. Моно. Будова Lac–оперону E.сoli, принципи його функціонування (репресія, індукція).
6. Регуляція експресії генів еукаріотів на рівні транскрипції; cистема транскрипційних сигналів – промоторні послідовності, енхансери, атенюатори, сайленсери.
7. Особливості молекулярної організації та експресії геному в еукаріотів. Ядерний хроматин еукаріотів; ковалентна модифікація гістонів та НГБ як один з механізмів контролю експресії генів.
8. Генетичні рекомбінації; транспозони. Рекомбінації геному прокаріотів (трансформація, трансдукція, кон’югація). Процеси рекомбінації у еукаріотів на прикладі утворення генів H– та L–ланцюгів молекул імуноглобулінів.
9. Ампліфікація генів (гени металотіонеїну, дигідрофолатредуктази): визначення, біологічне значення.
10. Мутації: геномні, хромосомні, генні (точкові); роль у виникненні ензимопатії та спадкових хвороб людини. Біохімічні механізми дії хімічних мутагенів – аналогів азотистих основ, дезамінуючих, алкілуючих агентів, ультрафіолетового та іонізуючого випромінювання.
11. Біологічне значення та механізми репарації ДНК. Репарація УФ-індукованих генних мутацій; пігментна ксеродерма; репарація дезамінування цитозину.
Практична робота
Дослід 1. Визначення ДНК за фосфором.
Матеріальне забезпечення:Тканина печінки щурів, 1 н розчин натрію гідроксиду (NaOH), 30 % розчин натрію гідроксиду (NaOH), насичений розчин натрію… Хід роботи: 1. Оброблення тканин основою. Наважку тканини печінки масою 100 мг нагрівають з 1 мл 1 н розчину натрію гідроксиду у…Дослід 2. Аналіз екстрактів антибіотиків методом тонкошарової рідинної хроматографії (ТШХ).
Матеріальне забезпечення:посудина з розчинниками, силікагелеві пластинка, суміш антибіотиків, мікропіпетки. Хід роботи: 1. Приготувати силікагелеві хроматографічні пластинки на алюмінієвій основі (Merck UV259). Відступивши 1–1,5 см від…Контроль виконання лабораторної роботи
1. Пояснити протипухлинну дію антибіотиків. Чи всі антибіотики можуть бути використаними як протипухлинні? Поясніть механізм дій афідиколіну, актиноміцину D.
2. 7. Пояснити молекулярні механізми мутацій. Які найбільш поширені мутагени ви знаєте?
3. На чому грунтується метод отримання ДНК?
4. Який принцип визначення ДНК за фосфором?
5. З мінералізатом ДНК провели реакцію з розчином амонію молібдату і отримали позитивну реакцію – молібденову синь. Який складник ДНК дає позитивну реакцію?
А. Пуринові основи
В. Піримідинові основи
С. Пуринові нуклеозиди
D. Піримідинові нуклеозиди
Е. Фосфатні залишки
6. Похідне уридину – фторурацил, який перетворюється в клітині в фтордезоксиуридилат – сильний незворотній інгібітор тимідилатсинтази. Як пояснити… 7. У пацієнта діагностовано пігментну ксеродерму. Його шкіра є надзвичайно…Індивідуальна самостійна робота студентів
1. Сучасні методи дослідження ДНК і РНК, їх клінічне значення.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – С. 469–544.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 344 - 360.
3. Гонський Я.І., Максимчук Т.П. Біохімія людини. – Тернопіль: Укрмедкнига, 2001. – С. 448–506.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Львів: Світ, 2006. – 271 с.
5. Біохімічний склад рідин організму та їх клініко-діагностичне значення. Довідник / За ред. Склярова О.Я. – Київ: Здоров’я, 2004. – 191 с.
6. Клінічна біохімія. Курс лекцій для студентів вищих навчальних медичних закладів / За ред. проф. Склярова О.Я. – Львів, 2004. – 295 с.
7. Практикум з біологічної хімії / За ред. О.Я. Склярова. – К.: Здоров’я, 2002. – 297 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 469–502, 511–544.
2. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 64-93.
3. Мушкамбаров Н.Н., Кузнецов С.Л. Молекулярная биология. – М.: ООО «Медицинское информационное агенство», 2003. – 544 с.
4. Фаллер Д.М., Шилдс Д. Молекулярная биология клетки. Руководство для врачей. Пер с англ. М.: БИНОМ-Пресс, 2003.- 272 с.
Змістовий модуль № 13. Основи молекулярної генетики.
Тема № 4. Біосинтез білка у рибосомах. Дослідження процесів ініціації, елонгації та термінації в синтезі поліпептидного ланцюга. Інгібіторна дія антибіотиків. Засвоєння принципів генної інженерії та клонування генів, їх застосування в сучасній медицині.
Мета заняття:Знати загальні закономірності синтезу білків, етапи цього процесу, можливі механізми виникнення та розвитку спадкових захворювань. Засвоїти механізм дії антибіотиків та інших інгібіторів синтезу білків. Знати принципи генної інженерії та клонування генів, їх застосування в сучасній медицині. Засвоїти принцип методу полімеразної ланцюгової реакції в експрес-діагностиці.
Актуальність теми:Білки – це генетично детермінована система, яка генетично запрограмована специфічним набором для кожного індивідуума притаманних тільки йому білкових молекул і з якими пов’язана сутність життя.При вивченні даної теми акцентувати увагу на сучасних досягненнях генної інженерії, в тому числі клонуванні генів, що важливо для вивчення як нуклеотидної послідовності досліджуваного гена, так і послідовності мРНК і білка, які кодуються цим геном. Завдяки генній інженерії здійснено синтез інтерферону людини, людських інсуліну, соматотропіну, соматостатину, білкових препаратів для діагностики СНІДу тощо. Зокрема, в останні роки в діагностиці багатьох захворювань та виявленні бацилоносіїв використовують експрес-метод – полімеразну ланцюгову реакцію.
Конкретні завдання:
Ø Трактувати поняття білок–синтезуючої системи в рибосомах.
Ø Пояснювати механізми функціонування білок-синтезуючої системи за участю ферментів активації амінокислот, ініціації, елонгації та термінації біосинтезу поліпептидних ланцюгів.
Ø Пояснювати біохімічні процеси посттрансляційної модифікації пептидних ланцюгів.
Ø Пояснювати вплив фізіологічно активних сполук й антибіотиків на процеси трансляції.
Ø Пояснювати біохімічні та молекулярно–біологічні принципи методів генної інженерії, технології рекомбінантних ДНК, трансплантації генів та отримання гібридних молекул ДНК.
Ø Пояснювати принципи клонування генів з метою отримання біотехнологічних лікарських засобів.
Теоретичні питання
1. Генетичний (біологічний) код; його властивості. Характеристика таблиці генетичного коду.
2. Рибосомальна білоксинтезуюча система. Компоненти білоксинтезуючої системи рибосом.
3. Будова транспортних РНК та механізм активація амінокислот. Аміноацил–тРНК–синтетази.
4. Етапи та механізми трансляції: ініціація, елонгація, термінація. Ініціюючі та термінуючі кодони мРНК; роль білкових факторів рибосом в трансляції.
5. Регуляція трансляції. Молекулярні механізми контролю трансляції на прикладі біосинтезу глобіну.
6. Механізми посттрансляційної модифікації пептидних ланцюгів.
7. Вплив фізіологічно активних сполук на процеси трансляції. Антибіотики – інгібітори транскрипції та трансляції у прокаріотів та еукаріотів, їх біомедичне застосування.
8. Біохімічні механізми противірусної дії інтерферонів. Блокування біосинтезу білка дифтерійним токсином (АДФ–рибозилювання факторів трансляції).
9. Генна інженерія, або технологія рекомбінантних ДНК: загальні поняття, біомедичне значення. Технологія трансплантації генів та отримання гібридних молекул ДНК; застосування рестрикційних ендонуклеаз. Клонування генів з метою отримання біотехнологічних лікарських засобів та діагностикумів (гормонів, ферментів, антибіотиків, інтерферонів та ін.).
10. Ланцюгова полімеразна реакція; її біомедичне застосування в діагностиці інфекційних та спадкових хвороб людини, ідентифікації особини ("ДНК–діагностика").
Практична робота
Дослід № 1. Полімеразна ланцюгова реакція (ПЛР).
Принцип методу. ПЛР базується на багатократному повторюванні циклів синтезу (ампліфікації) специфічної ділянки ДНК–мішені з… Матеріальне забезпечення:1) Обладнання: прилад ампліфікатор (забезпечує… 2) Реактиви: Для виділення ДНК з досліджуваних зразків застосовують фенольний або гуанідиновий методи. Використовують…Схема проведення ПЛР
1. підготовка клінічних зразків (біоптати тканин, крапля крові, сперма, слиз жіночих статевих органів, осад сечі, волосся людини, зішкреби епітеліальних клітин тощо);
2. виділення ДНК зі зразків (ДНК–матриці генів клітин, вірусів і бактерій більш стійкі, ніж РНК, і тому вони придатні для ПЛР після тривалого часу, навіть після тисячолітньої давності їх існування);
3. проведення циклів полімеразної ланцюгової реакції (реакції ампліфікації) – кожний цикл складається з трьох стадій з різними температурними режимами.
На першій стадії при 94˚С проходить розділення ланцюгів ДНК (денатурація ДНК), на другій при 50–65˚С – приєднання (відпалювання) праймерів до гомологічних послідовностей на ДНК–мішені і на третій при температурі 72˚C – синтез нових ланцюгів ДНК, тобто комплементарна добудова ДНК шляхом подовження праймера у напрямку 5’–3’ з участю ДНК–полімерази в присутності іонів магнію.
Таким чином, у першому циклі ампліфікації синтезуються продукти, які стають матрицями для другого циклу ампліфікації, в результаті якого, власне, і утворюється досліджуваний специфічний фрагмент ДНК – амплікон. Починаючи з третього циклу, амплікони стають матрицями для синтезу нових ланцюгів, тобто у кожному циклі здійснюється подвоєння кількості копій, що дозволяє за 25–40 циклів напрацювати фрагмент ДНК, обмежений парою відібраних праймерів, у кількості, якої достатньо для її детекції за допомогою електрофорезу;
4. розділення продуктів ампліфікації методом горизонтального електрофорезу в агарозному або поліакриламідному гелі; виявляють смуги фрагментів ДНК (ампліконів) за допомогою флуоресцентного барвника (хромофора) – бромистого етидія;
5. перенесення геля на скло трансілюмінатора;
6. аналіз результатів при ввімкнутому трансілюмінаторі, а саме виявлення фрагментів аналізованої ДНК у вигляді оранжево-червоних смуг при УФ–випромінюванні з довжиною хвилі 310 нм; кількість апмпліконів визначають за інтенсивністю їх флуоресценції. Отримані результати можна документувати фотографуванням гелів з використанням оранжевого або інтерференційного (594 нм) світлового фільтру.
Практична робота студентів передбачає вирішення теоретичної задачі з полімеразної ланцюгової реакції. Для запропонованої ділянки ДНК необхідно написати продукти першого, другого і третього циклів ампліфікації (приєднання нуклеотидів відбувається за принципом комплементарності) і написати структуру амплікону.
Приклад задачі
Контроль виконання лабораторної роботи
1. Обґрунтувати механізм дії антибіотиків – інгібіторів ініціації: стрептоміцину, ауринтрикарбоксилової кислоти, рифаміцину, рифампіцину.
2. Обґрунтувати механізм дії антибіотиків – інгібіторів елонгації: аміцетину, хлорамфеніколу, еритроміцину, циклогексиміду, пуроміцину, тетрациклінів.
3. Обґрунтувати механізм дії антибіотиків – інгібіторів термінації: анізоміцину, хлорамфеніколу, еритроміцину, лінкоцину, стрептоміцину.
4. Пояснити механізм дії інтерферонів.
5. Пояснити механізм дії дифтерійного токсину.
6. Пояснити, які методи генної інженерії можуть бути використані в біології та медицині.
7. У сучасних біохімічних дослідженнях для діагностики спадкових захворювань, виявлення присутності в організмі певних вірусів (в тому числі ВІЛ), ідентифікації особини (генна дактилоскопія у судовій медицині) використовується так звана “ДНК–діагностика”. Який метод використовується з цією метою?
А. Електрофорезу
В. Хроматографії
С. Ланцюгової полімеразної реакції
D. Рентгеноструктурного аналізу
E. Електронної мікроскопії
8. Тетрацикліни – це антибіотики широкого спектру дії, які є інгібіторами синтезу білків на 70 S рибосомах прокаріот, не впливаючи при цьому на 80 S рибосоми еукаріот. Рибосоми мітохондрій еукаріот за структурою подібні до рибосом прокаріот (70 S). Використовуючи ці дані, поясніть токсичний ефект тетрациклінів.
9. Що розуміють під поняттям ”клінічний зразок” для ПЛР?
10. На чому грунтується полімеразна ланцюгова реакція? Назвіть склад реакційної суміші для проведення ПЛР.
11. Охарактеризуйте три стадії циклу синтезу (ампліфікації) специфічної ділянки ДНК–мішені.
12. З якою метою при проведенні ПЛР використовують затравку– праймер? На чому ґрунтується підбір системи праймерів для діагностики кожної інфекції?
13. Яке клініко-діагностичне та практичне значення ПЛР як методу експрес-діагностики?
Приклади тестів „Крок–1”
1. При захворюванні на дифтерію спостерігається інгібування процесу трансляції у клітинах людини за рахунок втрати фактором елонгації еEF-2 властивості здійснювати транслокацію пептидного залишку з А- на П-сайт рибосом. Який фермент є причиною блокування еEF-2?
A. АДФ-рибозилтрансфераза
B. еIF-2-Протеїнкіназа
C. Пептидилтрансфераза
D. Пептидилтранслоказа
E. Гіпоксантингуанінфосфорибозилтрансфераза
2. Для лікування інфекційних бактеріальних захворювань використовують антибіотики (стрептоміцин, неоміцин, канаміцин). Який етап синтезу білків мікробної клітини вони інгібують?
A. Реплікацію
B. Транскрипцію
C. Трансляцію
D. Процесинг
E. Сплайсинг
3. За допомогою якого ферменту здійснюється шлях синтезу різних генів з матричних РНК та ДНК в генній інженерії (цей фермент каталізує процес, відкритий у деяких РНК–вмісних вірусів)?
А. Ревертази
В. Екзонуклеази
С. Ендонуклеази
D. ДНК–лігази
Е. Хелікази
4. Пацієнтові, що проживає на специфічній геохімічній території, встановлено діагноз – ендемічний зоб. Який вид посттрансляційної модифікації тиреоглобуліну порушений в організмі хворого?
А. Фосфорилювання
В. Метилювання
С. Ацетилювання
D. Йодування
Е. Глікозилювання
5. Спадкова інформація зберігається в ДНК, хоч безпосередньо у синтезі білка в клітині вона не бере участі. Який процес забезпечує реалізацію спадкової інформації у поліпептидний ланцюг?
А. Транскрипція
В. Трансляція
С. Транслокація
D. Реплікація
Е. Трансформація
Тема самостійної індивідуальної роботи для студентів
1. Характеристика процесів транскрипції в нормі та при патології. Програмована загибель клітини. Апоптоз та його біохімічні механізми.
2. Генна інженерія. Клонування. Застосування методів генної інженерії у сучасній медицині.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – С. 300-329.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 361 - 395.
3. Гонський Я.І., Максимчук Т.П. Біохімія людини. – Тернопіль: Укрмедкнига, 2001. – С. 448 – 506.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – К.: Медицина, 2010. – 360 с.
5. Біохімічні показники в нормі і при патології. Довідник / За ред. Склярова О.Я. – К.: Медицина, 2007. – 320 c.
6. Клінічна біохімія. Курс лекцій для студентів вищих навчальних медичних закладів / За ред. проф. Склярова О.Я. – Львів, 2004. – 295 с.
7. Практикум з біологічної хімії / За ред. О.Я. Склярова. – К.: Здоров’я, 2002. – 297 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 469–498, 509–544.
2. Баранов В.С. Генная терапия – медицина ХХІ века // Соросовский образовательный журнал. – 1999. – № 3. – С. 63–68.
3. Жиравецький М.І. Методи детекції нуклеїнових кислот в діагностиці статевих трансмісивних хвороб // Лаб. діагностика. – 2001. – № 1. – С. 28–34.
4. Кінах М.В., Луцик Б.Д., Захарія К.А. Лабораторна діагностика захворювань, які передаються статевим шляхом. – Львів, 2004. – 176 с.
5. Кольман Я., Рем К. Наглядная биохимия. – М.: Мир, 2000. – С. 234–259.
6. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 94 – 126.
Змістовий модуль № 14. Молекулярні механізми дії гормонів на клітини-мішені.
Тема № 5. Дослідження молекулярно-клітинних механізмів дії гормонів білково-пептидної природи на клітини-мішені. Механізми дії гормонів – похідних амінокислот та біогенних амінів.
Мета заняття: Вивчити молекулярні механізми дії гормонів білково-пептидної природи та похідних амінокислот (на прикладі катехоламінів) на клітини-мішені за участю сигнальних молекул-посередників. Засвоїти методи якісного визначення інсуліну, адреналіну в біологічних рідинах.
Актуальність теми: Розуміння біохімічних механізмів впливу гормонів білково-пептидноїприроди на активність внутрішньоклітинних систем дозволяє проаналізувати причини, які лежать в основі розвитку порушень, викликаних розладами у функціонуванні ендокринних залоз, що здійснюють синтез цих гормонів, а також формує у студентів підходи до можливості корекції патологічних станів, що виникають при гіпо- або гіперфункцій відповідних залоз внутрішньої секреції.
Конкретні завдання:
Ø Трактувати біохімічні та фізіологічні функції гормонів та біорегуляторів у системі міжклітинної інтеграції життєдіяльності організму людини.
Ø Аналізувати та пояснювати відповідність структури гормонів білково–пептидної природи, похідних амінокислот виконуваній функції та механізму дії на клітини мішені.
Ø Трактувати молекулярні механізми дії гормонів білково–пептидної природи та похідних амінокислот (на прикладі катехоламінів) на клітини мішені за участю сигнальних молекулярних посередників.
Теоретичні питання
2. Регуляція гормональної секреції за прямим та зворотнім зв’язком в організмі людини ( навести приклади ). Фактори, що впливають на секрецію та… 3. Мішені гормональної дії; типи реакцій клітин на дію гормонів. Рецептори… 4. Мембранний і мембранно-цитозольний механізми дії гормонів ( похідних амінокислот, пептидних, білкових ) за участю…Практична робота
Реакції, що виявляють особливості хімічної структури гормонів
Інсуліну та адреналіну.
Гормони – біологічно активні органічні речовини різної хімічної природи. Інсулін є простим білком, що містить сірковмісні амінокислоти; адреналін – похідний амінокислоти тирозину.
Дослід 1. Біуретова реакція.
Принцип методу. Інсулін є простим білком і дає характерні кольорові реакції на білок.
Матеріальне забезпечення: 10 % розчин NaOH, СuSO4, інсулін.
Хід роботи: До 10 крапель інсуліну додають 5 крапель 10 %-го розчину NaOH і краплю розчину CuSO4. Рідина забарвлюється у фіолетовий колір.
Зробити висновок.
Дослід 2. Реакція Фоля.
Принцип методу.Сірковмісні амінокислоти, особливо цистеїн і цистин, при кип’ятінні з лугом втрачають сірку, яка відщеплюється у вигляді сірководню. Сірководень, взаємодіючи з лугом, утворює сульфіди, які можна виявити при додаванні плюмбуму ацетату (реактиву Фоля). Сульфіди утворюють з ним коричневий або чорний осад плюмбуму сульфіду.
Матеріальне забезпечення:реактив Фоля, інсулін.
Хід роботи: До 5 крапель інсуліну додають 5 крапель реактиву Фоля і кип’ятять. Через 1-2 хвилини після відстоювання утворюється бурий або чорний осад сульфіду свинцю.
Зробити висновок.
Дослід 3. Реакція з хлорним залізом.
Матеріальне забезпечення: хлорне залізо, аміак, адреналін. Хід роботи: До 3 крапель розчину адреналіну додають 1 краплю розчину хлорного… Зробити висновок.Контроль виконання лабораторної роботи
1. Пояснити хімічну природу інсуліну за реакцією осадження сульфосаліциловою кислотою. Пояснити специфічність цієї реакції.
2. За допомогою яких реакцій можна виявити білково-пептидні гормони? Які гормони білкової та пептидної природи ви знаєте?
3. Виявлення адреналіну хлоридом заліза (III). Поясніть принцип методу. Яка хімічна природа адреналіну? Напишіть його формулу.
4. Що лежить в основі зміни забарвлення реакційної суміші у біуретовій реакції, реакції Фоля?
5. Що спричинює збільшення екскреції катехоламінів із сечею?
6. Час життя більшості гормонів у крові порівняно невеликий. Так, якщо ввести тварині радіоактивно мічений інсулін, то половина введеного гормону інактивується у крові протягом 30 хв. Чому важлива відносно швидка інактивація циркулюючих гормонів? Як може підтримуватися постійний рівень гормону в крові за нормальних умов, якщо врахувати його швидку інактивацію? Якими шляхами організм здійснює швидкі зміни концентрації циркулюючих гормонів в організмі?
7. Вазопресин і окситоцин знаходяться в задній долі гіпофізу. Вкажіть, де вони синтезуються і як потрапляють в задню долю гіпофізу?
8. Які переваги надає організму синтез гормонів у вигляді прегормонів і прогормонів?
Приклади тестів “Крок-1”
1. Продуктами гідролізу та модифікації деяких білків є біологічно активні речовини – гормони. З якого із наведених білків у гіпофізі утворюються ліпотропін, кортикотропін, меланотропін та ендорфіни?
A. Тиреоглобулін
B. Нейростромін
C. Проопіомеланокортин ( ПОМК)
D. Нейроальбумін
E. Нейроглобулін
2. Хворий 40-ка років скаржиться на сильне серцебиття, пітливість, нудоту, порушення зору, тремор рук, підвищення артеріального тиску. З анамнезу було встановлено діагноз феохромоцитома. Гіперпродукція яких гормонів зумовлює цю патологію?
A. Альдостерон
B. Катехоламіни
C. Глюкокортикоїди
D. Тироксин
E. АКТГ
3. Інозитолтрифосфати утворюються в тканинах організму в результаті гідролізу фосфатидилінозитолдифосфатів і відіграють роль вторинних посередників (месенджерів) в механізмі дії гормонів. Їхній вплив у клітині спрямований на:
A. Активацію протеїнкінази
B. Вивільнення іонів кальцію з клітинних депо
C. Гальмування протеїнкінази
D. Гальмування фосфодієстерази
E. Активацію аденілатциклази
4. Для передачі гормонального сигналу у фосфоінозитидній системі неохідно активувати протеїкіназу С, яка фосфорилює білки. Вкажіть сполуку, яка активує даний фермент?
A. Моноацилгліцерол
B. Триацилгліцерол
C. Гліцерол
D. Фосфоетаноламін
E. Діацилгліцерол
5. Вкажіть, яким гормоном регулюється водний баланс і осмотичний тиск у плазмі крові, а також стимулюється скорочення гладких м’язів?
А. Пролактин
В. Соматостатин
С. Кортиколіберин
D. Вазопресин
Е. Кініни
6. Хворий скаржиться на поліурію (5 л сечі на добу) і спрагу. Біохімічні показники: вміст глюкози в крові 5,1 ммоль/л, питома густина сечі 1,010. Глюкоза та кетонові тіла відсутні. Яка можлива причина такого стану?
А. Мікседема
В. Стероїдний діабет
С. Цукровий діабет
D. Тиреотоксикоз
Е. Нецукровий діабет
Індивідуальна самостійна робота студентів
1. Ендокринні функціїї підшлункової залози в нормі та при патології.
Література
Основна:
1. Губський Ю.І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – С. 330-385.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 396 - 463.
3. Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. – Тернопіль: Укрмедкнига, 2002. – С. 154-168, 175-191, 203-209.
4. Вороніна
5. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Львів: Світ, 2006. – 271 с.
6. Біохімічний склад рідин організму та їх клініко-діагностичне значення. Довідник / За ред. Склярова О.Я. – Київ: Здоров’я, 2004. – 191 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1990. – С. 170 – 203.
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 248 – 297.
3. Кулинский В.И., Колесниченко Л.С. Молекулярные механизмы действия гормонов. Рецепторы, нейромедиаторы.Системы со вторыми посредниками // Биохимия. – 2005. – Т. 70, вып. 1. – с. 33-50.
4. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 147 – 273.
Змістовий модуль № 15. Біохімія нейро-гуморальної регуляції метаболізму.
Тема № 6. Дослідження молекулярно-клітинних механізмів дії стероїдних та тиреоїдних гормонів на клітини-мішені. Гормональна регуляція гомеостазу кальцію.
Мета заняття: Вміти аналізувати зміни обміну речовин та біохімічних показників, які характеризують обмін вуглеводів, білків і ліпідів при порушеннях функціонування ендокринних залоз, що відповідають за синтез стероїдних та тиреоїдних гормонівта узагальнювати прогностичну оцінку цих порушень. Знати механізми гормональної регуляції гомеостазу кальцію: розподіл Са2+ в організмі, форми кальцію в плазмі крові людини, вклад кісткової тканини, тонкої кишки та нирок в гомеостаз кальцію.
Актуальність теми: Стероїдним та тиреоїднимгормонам належить важлива роль у механізмі підтримки гомеостазу організму. Шляхом впливу на генетичний апарат клітини вони здатні змінювати інтенсивність обміну речовин в клітинах-мішенях і в організмі в цілому. Усвідомлення механізмів нейрогуморальної регуляції обміну речовинстероїдними та тиреоїдними гормонами дає основу для діагностики правильної та раціональної терапії при ендокринопатіях.
Конкретні завдання:
Ø Аналізувати зміни обміну речовин та біохімічних показників, які характеризують обмін вуглеводів, білків і ліпідів при порушеннях функціонування ендокринних залоз та узагальнювати прогностичну оцінку цих порушень.
Ø Трактувати молекулярні механізми прямої регуляторної дії на геном клітин – мішеней гормонами стероїдної природи.
Ø Пояснити біохімічні механізми виникнення та розвитку патологічних процесів та типових проявів порушень ендокринної системи організму.
Ø Трактувати механізми гормональної регуляції гомеостазу кальцію: розподіл кальцію в організмі, форми кальцію в плазмі крові людини, вклад кісткової тканини, тонкої кишки та нирок в гомеостазі кальцію.
Теоретичні питання
2. Тиреоїдні гормони щитоподібної залози: · структура та біосинтез тиреоїдних гормонів; · біологічні ефекти Т4 та Т3;Практична робота
Дослід 1. Якісна реакція на 17-кетостероїди сечі.
Принцип методу. Метод базується на реакції 17-кетостероїдів з m-динітробензолом у лужному середовищі з утворенням продуктів конденсації… Матеріальне забезпечення: 30 % розчин їдкого натру, розчин м-динітробензолу,… Хід роботи: В пробірку наливають 5 крапель сечі, 5 крапель 30 % розчину їдкого натрію, обережно нашаровують 0,5 мл…Дослід 2. Якісна реакція на йод в розчині тироксину.
5 КІ + КІО3 + 3 H2SO4 ® 3 І2 + 3 K2SO4 + 3 H2O I2 + крохмаль ® синє забарвлення Матеріальне забезпечення: тироксин, 10 % розчин H2SO4, 10 % розчин йодноватого калію, крохмаль, лакмус.Контроль виконання лабораторної роботи
1. Виявлення йодовмісних гормонів. Поясніть принцип методу. Які гормони відносяться до цієї групи.
2. Яким методом можна виявити метаболіти гормонів стероїдної природи? Які гормони відносяться до цієї групи? Поясніть принцип методу.
3. Чим пояснити виникнення синього забарвлення розчину у якісній реакції на тироксин?
4. Хворий довгий час отримував кортикостероїдні гормони, а потім різко припинив їх приймати. Які зміни в обміні речовин можливі?
5. При захворюванні жінок на рак молочної залози, одним із засобів лікування є усунення яєчників. Крім цього додатково вводять чоловічі статеві гормони. Поясніть біохімічні основи такого лікування.
6. При ураженні наднирників розвивається характерна пігментація шкіри, м’язова слабість, різке порушення водно-сольового обміну, обмін білків і вуглеводів. Чим це пояснити?
7. 33-річна пацієнтка скерована до Консультації Тиреоїдної Патології сімейним лікарем. Протягом 6 місяців відчувала неспокій, швидку втому, підвищену чутливість до тепла, втрату ваги тіла при збереженому апетиті, серцебиття та підвищену пітливість. При обстеженні встановлено: пульс 130 уд/хв, теплі і вологі долоні, тремтіння, сповільнене закриття повік і екзофтальм, а також м’який, збільшений зоб. Результати тестування: тироксин – 260 нмоль/л (норма 50 – 150).
Приклади тестів “Крок-1”
1. Який основний представник мінералокортикостероїдів?
А. Кортикостерон
В. Гідрокортизон
С. Дигідрокортикостерон
D. Альдостерон
Е.Синестрол
2. Як впливають глюкокортикоїди на обмін вуглеводів у печінці?
А. Стимулюють глікогенез із глюкози
В. Стимулюють глюконеогенез
С. Стимулюють гідроліз глікогену
D. Стимулюють фосфороліз глікогену
3. В організмі людини деякі амінокислоти перетворються у гормони. Вкажіть, у… А. ГістамінІндивідуальна самостійна робота студентів
1. Перетворення арахідонової кислоти в організмі людини та вплив її продуктів на біохімічні процеси.
Література
Основна:
1. Губський Ю.І. Біологічна хімія.- Київ-Тернопіль: Укрмедкнига, 2000. – С.330-385.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 396- 463.
3. Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. – Тернопіль: Укрмедкнига, 2002. – С.154-174, 180-182, 191-203.
4. Вороніна
5. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Львів: Світ, 2006. – 271 с.
6. Біохімічний склад рідин організму та їх клініко-діагностичне значення. Довідник / За ред. Склярова О.Я. – Київ: Здоров’я, 2004. – 191 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1990. – С. 170 –182, 184-197.
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 248 – 297.
3. Кулинский В.И., Колесниченко Л.С. Молекулярные механизмы действия гормонов. Рецепторы, нейромедиаторы. Системы со вторыми посредниками. // Биохимия. – 2005. – том 70, вып. 1. – с. 33 – 50.
4. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 147 – 273.
Тема №7. Дослідження нервової тканини. Патохімія психічних порушень.
Мета заняття: Знати склад і біохімічні особливості обміну речовин у нервовій тканині, її функціонування в нормі і при деяких захворюваннях.… Актуальність теми: Головний і спинний мозок є основними органами, через які… Конкретні завдання:Теоретичні питання
· хімічний склад головного мозку; · нейроспецифічні білки та ліпіди ( гангліозиди, цереброзиди, холестерол ); … · особливості амінокислотного складу мозку;Практична робота
Дослід 1. Визначення активності холінестерази в сироватці крові титраметричним методом Мішеля.
Матеріальне забезпечення:1,5% ацетилхолін, 1% фенолфталеїн, 0,01М натрію гідроксид, термостат, пробірки. Хід роботи. В дві пробірки вносять по 1мл ацетилхоліну 1,5%, далі в одну з них… Розрахунок. Вираховують різницю V=Vд - Vк ,Контроль виконання лабораторної роботи
1. У чому полягає принцип методу Мішеля визначення активності холінестерази у сироватці крові? Клініко-діагностичне значення визначення холінесттерази крові.
2. Вказати нормальні значення активності холінестерази в сироватці крові:
A. 10 – 15 мкмоль/(с-л)
B. 12 – 30 мкмоль/(с-л)
C. 45 – 95 мкмоль/(с-л)
D. 98 – 115 мкмоль/(с-л)
E. 105 – 145 мкмоль/(с-л)
3. Для хворих з недостатністю тіаміну характерний ряд неврологічних симптомів: втрата рефлексів, збудливість, спутаність свідомості. Поясніть, чому нестача тіаміну відбивається на функції мозку?
4. Відомо, що глікоген, який складає енергетичний запас організму, відкладається про запас у печінці та м‘язах, але не створює резерву у такій важливій тканині як мозок, яка у великій кількості використовує глюкозу. Поясніть, чому глікоген не запасається у мозку?
Приклади тестів „Крок-1”
1. Токсин правцю викликає тонічне напруження скелетних м’язів і судин тому, пригнічує секрецію із нервового закінчення нейромедіатора:
А. ГАМК
В. Норадреналіну
С. Ацетилхоліну
Д. Гліцину
Е. Глутамату
2. При хворобі Паркінсона порушується дофамінергічна передача і тому ДЛЯ лікування застосовують попередник дофаміну – L-ДОФА. Для зменшення побічного впливу і дози L-ДОФА вживають у комбінації з:
А. Інгібітором декарбоксилази ароматичних амінокислот
В. Активатором декарбоксилази ароматичних амінокислот
С. Інгібітором моноамінооксидази
Д. Активатором моноамінооксидази
Е. Блокаторами дофамінових рецепторів
3. У мозку хворих на шизофренію підвищується кількість рецепторів:
А. Дофамінових
В. Серотонінових
С. Адренорецепторів
Д. Холінорецепторів
Е. ГАМК-рецепторів
4. Порушення процесу мієлінізації нервових волокон призводить до важких неврологічних розладів і розумової відсталості. Така клінічна картина характерна для спадкових порушень обміну:
А. Нейтральних жирів
В. Холестерину
С. Сфінголіпідів
Д. Гліцерофосфоліпідів
Е. Ліпопротеїнів
Література
Основна :
1. Губський Ю.І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – 508 с.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. С. 625 – 644.
3. Гонський Я.І.,Максимчук Т.П. Біохімія людини.-Тернопіль:Укрмедкнига, 2002. – 744с.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Львів: Світ, 2006. – 271 с.
5. Клінічна біохімія / За ред. Склярова О.Я. – Київ: Медицина, 2006. -432 с.
6. Клінічна біохімія. Курс лекцій для студентів вищих навчальних медичних закладів / За редакцією проф. Склярова О.Я., Львів, 2004.
7. Практикум з біологічної хімії / За ред. проф. О.Я. Склярова. – К.: Здоров’я, 2002. – 298 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1990. – 542 с.
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 620 – 639.
3. Біохімічний склад рідин організму та їх клініко-діагностичне значення /За ред. проф. Склярова О.Я., Київ: Здоров’я, 2004. – 191с.
4. Біохімія ензимів. Ензимодіагностика. Ензимопатологія. Ензимотерапія / Скляров О., Сольскі Я., Великий М., Фартушок Н., Бондарчук Т., Дума Д. – Львів: Кварт.- 2008. – 218 с.
5. Бородкина Л.Е., Тюренков И.Н., Ковтун В.В. Хроническая алкоголизация и ГАМК-ергическая система. (Обзор литературы) // Экспер. и клин. фармакология. – 2002. – Т.65, № 3. – С.75 – 79.
6. Вільм Ф. Ганонг. Фізіологія людини.- Львів: БаК, 2002. – 767с.
7. Скочій П.Г. Нервові хвороби. - Львів: ЛДМУ ім. Д. Галицького, ч.1,2. – 1050 с.
Змістовий модуль № 16. Біохімія м’язової тканини і механізм її скорочення.
Тема № 8. Дослідження процесів м’язового скорочення.
Мета заняття:Знати склад і біохімічні особливості метаболізму м’язової тканини, її функціонування в нормі і при деяких патологіях. Вміти кількісно визначати креатинін і креатин у сечі для діагностики захворювань.
Актуальність теми: У м’язовій тканині є специфічні риси метаболізму в залежності від віку людини, патологічних станів в них, викликаних як ендогенними, так і екзогенними факторами.Тому в клініці особливе місце займають біохімічні методи діагностики її функціонування.
Конкретні завдання:
Ø Аналізувати біохімічний склад м’язів і роль білків в побудові їх структури.
Ø Пояснити біохімічні механізми скорочення і розслаблення м’язового волокна.
Ø Аналізувати шляхи енергетичного забезпечення м’язового скорочення і розслаблення. Роль АТФ і креатинфосфату в даних процесах.
Теоретичні питання
2. Екстрактивні речовини м’язів, азотисті і безазотисті, їх хімічна природа і роль. Роль іонів Са2+ в регуляції скорочення та розслаблення скелетних… 3. Молекулярні механізми м'язового скорочення: сучасні уявлення про взаємодію… 4. Сучасні уявлення про енергетичне забезпечення скорочення і розслаблення м’язового волокна. Макроергічні сполуки…Практична робота
Дослід 1. Кількісне визначення креатиніну в сечі за методом Фоліна:
Принцип методу. Метод базується на кольоровій реакції (реакція Яффе) креатиніну з пікриновою кислотою в лужному середовищі з подальшим визначенням інтенсивності забарвлення на ФЕКу. Концентрацію креатиніну в сечі знаходять за калібрувальним графіком.
 А
А
 |
 0,4
0,4
 0,3
0,3
 0,2
0,2
 0,1
0,1
 |
0,5 1,0 1,5 c (мг)
Крива залежності оптичної густини розчину креатиніну від його концентрації
Матеріальне забезпечення: насичений розчин пікринової кислоти, 10% розчин гідроксиду натрію, ФЕК, мірні циліндри на 100 мл, мірні піпетки, скляні палички.
Хід роботи:В один мірний циліндр відміряють 0,5 мл сечі (дослід), а в другий – 0,5 мл дистильованої води (контроль). В обидва циліндри добавляють по 0,2 мл 10% гідроксиду натрію і по 3 мл насиченого розчину пікринової кислоти, перемішують вміст циліндрів, залишають на 5 хв, потім доводять дистильованою водою до 100 мл, перемішують скляною паличкою і вимірюють на ФЕКу екстинкцію досліду проти контролю в кюветах товщиною шару 1 см із зеленим світлофільтром.
Знаючи екстинкцію, за калібрувальним графіком визначають вміст креатиніну в досліді і розраховують кількість креатиніну, виділеного з сечею за добу за формулою:
а х Vдоб
 Х = ;
Х = ;
Vдосл
де а – кількість креатиніну, знайдена за калібрувальним графіком;
Vдоб – добовий об’єм сечі, мл;
Vдосл – об’єм сечі, взятий для аналізу, мл;
(коефіцієнт перерахунку в одиниці СІ (ммоль/доб) дорівнює 8,84)
Пояснити отриманий результат. Зробити висновки.
Клініко-діагностичне значення.В середньому за добу з сечею виділяють креатиніну у чоловіків 8,8-17,7 ммоль/добу (1,0-2,0 г/добу), а у жінок – 7,1-15,9 ммоль/добу (0,8-1,8 г/добу). Збільшення виділення креатиніну спостерігається при надмірному вживанні м’ясної їжі (екзогенний креатинін), при розпаді білків протоплазми, при посиленій фізичній роботі, акромегалії, при цукровому і нецукровому діабетах, інфекційних та інших захворюваннях (ендогенний креатинін). Виділення креатиніну значно зменшується при захворюваннях нирок, м’язовій дистрофії, гіпертиреозі, анемії, лейкемії, у старшому віці, при хронічному нефриті з уремією (при цьому вміст його в крові збільшується). Креатинін, на відміну від багатьох інших низькомолекулярних речовин, не реабсорбується і через те за його екскрецією з сечею можна оцінювати стан клубочкової фільтрації.
Дослід 2. Кількісне визначення креатину в сечі.
Принцип методу.Креатин у сечі визначають тим самим методом, що й креатинін, попередньо перетворивши креатин у креатинін у кислому середовищі при нагріванні.
Матеріальне забезпечення:сеча з попереднього досліду, насичений розчин пікринової кислоти, 10% розчин гідроксиду натрію, концентрована соляна кислота, ФЕК, мірні циліндри на 100 мл, мірні піпетки, скляні палички, водяна баня.
Хід роботи:В одну пробірку відмірюють 0,5 мл сечі (дослід), а в другу - 0,5 мл дистильованої води (контроль). В обидві пробірки добавляють по 0,1 мл концентрованої соляної кислоти і ставлять їх в киплячу водяну баню на 3 хв Після охолодження в обидві пробірки добавляють по 0,2 мл 10% гідроксиду натрію і по 3 мл насиченого розчину пікринової кислоти, перемішують вміст пробірок і залишають на 5 хв. Потім вміст пробірок кількісно переносять у мірні циліндри на 100 мл, змиваючи пробірки тричі по 10 мл дистильованою водою. Доводять об’єми до мітки - 100 мл. Вимірюють екстинкцію на ФЕК у кюветі з товщиною шару 1 см із зеленим світлофільтром проти контролю. За калібрувальним графіком визначають вміст креатиніну в досліді і розраховують його кількість у сечі за добу за формулою (див. Дослід 1).
Цей креатинін складає суму креатину і власне креатиніну. При визначенні кількості креатину знаходять різницю між показниками креатиніну з досліду 2 і досліду 1. Цю різницю множать на 1,16 – коефіцієнт перерахунку відповідності рівня креатиніну кількості креатину, тобто це відношення молекулярних мас креатину і креатиніну – 131 : 113 = 1,16.
Пояснити отриманий результат. Зробити висновки.
Клініко-діагностичне значення.Нормальна екскреція креатину з сечею становить у чоловіків 0 – 0,3 ммоль/добу, у жінок 0 – 0,61 ммоль/добу. У сечі здорової дорослої людини при нормальному фізичному навантаженні креатину, як правило, немає. Поява його в сечі – креатинурія – спостерігається при підвищеному м’язовому навантаженні, у період росту дітей (до 14 – 17 років), у період вагітності, у ранньому післяродовому періоді, при вуглеводному і білковому голодуванні, у осіб похилого віку, при загоюванні значних переломів, оперативних втручаннях. Креатинурія спостерігається при посиленому розпаді тканин (опіки, рак, туберкульоз), авітамінозі Е, цукровому діабеті, паренхіматозному гепатиті.
Контроль виконання лабораторної роботи
1. Клініко-діагностичне значення визначення креатину і креатиніну в сечі? Пояснити принцип методу визначення.
2. В яких одиницях вимірюють кількість креатиніну в сечі?
3. Про що свідчить збільшення чи зменшення креатиніну в сечі?
4. Чим пояснити, що за кількістю креатиніну в сечі оцінюють стан клубочкової фільтрації?
5. Назвіть причини креатинурії.
6. Відомо, що характерною ознакою бронхіальної астми є спазм гладкої мускулатури бронхіол. Які причини появи такого симптому?
7. У хворого виявлено гіповітаміноз Е. Як це вплине на функцію м’язів?
8. Для хворих з недостатністю тіаміну характерний ряд неврологічних симптомів: втрата рефлексів, збудливість, плутаність свідомості. Поясніть, чому нестача тіаміну впливає на функції мозку?
Приклади тестів “Крок-1”
1. Для ранньої діагностики м’язових дистрофій найбільш інформативним є підвищення активності в плазмі крові певного ферменту. Вкажіть його?
А. Лактатдегідрогеназа
В. Аланінамінотрансфераза
С. Аспартатамінотрансфераза
D. Креатинкіназа
Е. Альфа-амілаза
2. Хворому з прогресуючою м’язовою дистрофією було проведено біохімічне дослідження сечі. Поява якої речовини у великій кількості в сечі може підтвердити захворювання м’язів у даного хворого?
А. Гіпурової кислоти
В. Креатину
С. Порфіринів
D. Сечовини
Е. Креатиніну
3. У людей, які тривалий час перебували в стані гіподинамії, після фізичного навантаження виникають інтенсивні болі в м’язах. Яка найбільш вірогідна причина цього явища?
А. Зменшення ліпідів в м’язах
В. Підвищення вмісту АДФ в м’язах
С. Накопичення креатиніну в м’язах
D. Посилений розпад м’язових білків
Е. Накопичення в м’язах молочної кислоти
4. Для синтезу АТФ скелетні м’язи і міокард використовують як субстрати окиснення різноманітні речовини. Яка із них утилізується в міокарді, але не використовується скелетними м’язами?
А. Глікоген
В. Глюкоза
С. Молочна кислота
D. Жирні кислоти
Е. Кетонові тіла
5. Найбільш швидким механізмом утворення АТФ для термінового включення процесу м’язового скорочення є :
А. Генерація АТФ із креатинфосфату
В. Аеробний гліколіз
С. Глікогеноліз у м’язах
D. Анаеробний гліколіз
Е. Окиснення тригліцеридів
Індивідуальна самостійна робота студентів
1. Зв’язок метаболізму м’язової тканини серця з обміном у нервовій, ендокринній системах, печінці, легенях, судинах.
2. Ушкодження серця та біохімічна діагностика при деяких захворюваннях (тиреотоксикоз, гіпотеріоз, гіперкортицизм, цукровий діабет, захворювання паращитовидної залози, вплив радіації, порфірія, подагра, порушення харчування, алкогольне ушкодження серця).
3. Використання біохімічних показників для оцінки активності ендоміокарду. Біохімічна діагностика захворювань міокарда (міокардит, міокардіопатія). Захворювання перикарда. Порушення обміну речовин коронарних судин. Біохімічна діагностика стенокардії, мікроінфаркту.
Література
Основна:
1. Губський Ю.І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – С. 468 – 477.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 585 – 595.
3. Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. – Тернопіль: Укрмедкнига, 2002. – С. 300 – 308/ 669-687.
4. Біохімічні показники в нормі і при патології. Довідник / За ред. Склярова О.Я. – К.: Медицина, 2007. – 318с.
5. Біологічна хімія. Тести та ситуаційні задачі / За ред. Склярова О.Я. –К.: ВСВ «Медицина», 2010. – С. 62 – 84
6. Біохімія ензимів. Ензимодіагностика. Ензимопатологія. Ензимотерапія: Посібник / Скляров О.,Сольскі Я.,Великий М. та ін. – Львів:Кварт. – 2008. –С. 38 -46.
7. Клінічна біохімія/ За ред. проф. Склярова О.Я.- К.: «Медицина », 2006. – С. 101 – 103
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 645 – 660.
2. Клиническая биохимя: Учебник для студентов мед.вузов /А.Я.Цыганенко , В.И. Жуков, В.В. Леонов и др. – Харьков: Факт, 2005. – 456с.
3. Клиническая биохимия: Учебное пособие для вузов / В.Н. Бочков, А.Б. Добровольский, Н. Е. Кушлинский и др. – ГЭОТАР-МЕД , 2004. – 521с.
4. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 332 – 351.
Тема № 9. Підсумковий контроль. Модуль 4.
Теоретичні питання
2. Вільні біологічно активні нуклеотиди та їх біохімічні функції: участь у метаболічних реакціях (АТФ, НАД, НАДФ, ФАД, ФМН, ЦТФ, УТФ) та їх… 3. Нуклеїнові кислоти: структура, властивості, історичні етапи вивчення.… 4. Будова, властивості та біологічні функції ДНК. Експериментальне доведення генетичної ролі ДНК (феномен…РНК вірусу СНІДу, проникла всередину лейкоцита і за допомогою ензима ревертази спричинила синтез у клітині вірусної ДНК. В основі цього процесу лежить...
А. Зворотня транскрипція
B. Дерепресія оперону
C. Репресія оперону
D. Конваріантна реплікація
E. Зворотня трансляція
2. Із нітратів, нітритів і нітрозамінів в організмі утворюється азотиста кислота, яка зумовлює окисне дезамінування азотистих основ нуклеотидів. Це може призвести до точкової мутації – заміни цитозину на..
А. Тимін
В. Урацил
С. Аденін
D. Гуанін
E. Інозит
У сечі місячної дитини виявлено підвищений вміст оротової кислоти. Дитина погано набирає масу тіла. Які речовини потрібно використати для нормалізації метаболізму?
А. Уридин
B. Аденозин
C. Гуанозин
D.Тимідин
E. Гістидин
4. Утворення тимідилових нуклеотидів, які використовуються для біосинтезу ДНК, відбувається з дУДФ, що спершу гідролізуються до дУМФ, а далі метилюються. Яка сполука слугує донором метильних груп?
A. Лецитин
B. Холін
C. Метилентетрагідрофолат
D. Метіонін
E. Карнітин
5. Чоловіка віком 60 років прооперували з приводу раку простати. Через 2 місяці йому призначили курс хіміотерапії. До комплексу лікарських препаратів входив 5-фтордезоксіуридин – інгібітор тимідилатсинтази. Синтез насамперед якої речовини блокується під дією цього препарату?
А. іРНК
B. рРНК
C. тРНК
D. ДНК
E. Білка
6. Для лікування урогенітальних інфекцій використовують хінолони – інгібітори ензима ДНК–гірази. Який процес порушується під дією хінолонів насамперед?
А. Ампліфікація генів
В. Реплікація
С. Зворотна транскрипція
D. Репарація
E. Рекомбінація генів
7. В організм людини потрапили іони ртуті. Це призвело до збільшення частоти транскрипції гена, необхідного для детоксикації важких металів. Ампліфікація гена якого білка лежить в основі цього процесу?
А. Металотіонеїну
B. Церулоплазміну
С. Інтерферону
D. Трансферину
E. Феритину
8. При захворюванні на дифтерію спостерігається інгібування процесу трансляції у клітинах людини за рахунок втрати фактором елонгації еEF-2 властивості здійснювати транслокацію пептидного залишку з А- на П-сайт рибосом. Який фермент є причиною блокування еEF-2?
A. АДФ-рибозилтрансфераза
B. еIF-2-Протеїнкіназа
C. Пептидилтрансфераза
D. Пептидилтранслоказа
E. Гіпоксантингуанінфосфорибозилтрансфераза
9. Для лікування інфекційних бактеріальних захворювань використовують антибіотики (стрептоміцин, неоміцин, каноміцин). Який етап синтезу білків мікробної клітини вони інгібують?
A. Реплікацію
B. Транскрипцію
C. Трансляцію
D. Процесинг
E. Сплайсинг
10. Пацієнт звернувся до лікаря зі скаргами на тремор і гіпокінезію. Біохімічний аналіз крові показав знижену кількість дофаміну. Вкажіть з якого метаболіта-попередника він утворюється?
А. Диоксифеніламіну
В. Тирозину
С. Тираміну
D. Фенілаланіну
Е. Фенілпірувату
11. Хворий скаржиться на поліурію (5 л сечі на добу) і спрагу. Біохімічні показники: вміст глюкози в крові 5,1 ммоль/л, питома густина сечі 1,010. Глюкоза та кетонові тіла відсутні. Яка можлива причина такого стану?
А. Мікседема
В. Стероїдний діабет
С. Цукровий діабет
D. Тиреотоксикоз
Е. Нецукровий діабет
12. Який основний представник мінералокортикостероїдів?
А. Кортикостерон
В. Гідрокортизон
С. Дигідрокортикостерон
D. Альдостерон
Е. Синестрол
13. Токсин правцю викликає тонічне напруження скелетних м’язів і судин тому, пригнічує секрецію із нервового закінчення нейромедіатора:
А. ГАМК
В. Норадреналіну
С. Ацетилхоліну
D. Гліцину
Е.Глутамату
14. Для ранньої діагностики м’язових дистрофій найбільш інформативним є підвищення активності в плазмі крові певного ферменту. Вкажіть його?
А. Лактатдегідрогеназа
В. Аланінамінотрансфераза
С. Аспартатамінотрансфераза
D. Креатинкіназа
Е. Альфа-амілаза
Приклади тестів та ситуаційних задач по засвоєнню практичних навичок
1. З мінералізатом ДНК провели реакцію з розчином амонію молібдату і отримали позитивну реакцію – молібденову синь. Який складник ДНК дає позитивну реакцію?
А. Пуринові основи
В. Піримідинові основи
С. Пуринові нуклеозиди
D. Піримідинові нуклеозиди
2. У сучасних біохімічних дослідженнях для діагностики спадкових захворювань,… А. ЕлектрофорезуЛітература
1. Губський Ю.І.. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – 508 с.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – 664 с.
3. Гонський Я.І., Максимчук Т.П. Біохімія людини. – Тернопіль: Укрмедкнига, 2001. – 744 с.
4. Біохімічний склад рідин організму та їх клініко-діагностичне значення // За ред. проф. Склярова О.Я., Київ: Здоров’я, 2004. – 191 с.
5. Практикум з біологічної хімії // За ред. Склярова О.Я. – Київ: Здоров’я, 2002. – 298 с.
6. Ситуаційні задачі та тести з біологічної хімії: Посібник для студентів // За ред. проф. Склярова О.Я. – Львів: Світ, 2006. – 272 с.
Модуль 5. Біохімія тканин та фізіологічних функцій
Тематичний план практичних занять з модуля 5
Тематичний план лекцій з модуля 5
Завдання для самостійної роботи студентів (СРС) № п/п Тема Кіль-сть годин 1. …Критерії оцінювання поточної навчальної діяльності студента
При засвоєнні теми за традиційною системою студенту присвоюються бали:
Балів, “4” – 10 балів, “3” – 7 балів, “2” – 0 балів.
Максимальна кількість балів за поточну діяльність студента – 120.
Студент допускається до підсумкового модульного контролю при виконанні умов навчальної програми та в разі, якщо за поточну навчальну діяльність він набрав не менше 70 балів
Times; 10 = 70).
Підсумковий тестовий контроль зараховується студенту, якщо він демонструє володіння практичними навичками та набрав при виконанні тестового контролю теоретичної підготовки не менше 50 балів.
Методика проведення та критерії оцінювання підсумкового модульного контролю
І етап - письмова відповідь на тестові завдання формату А (бланковий або комп'ютерний тестовий контроль). Студент відповідає на пакет тестів. Кожний… ІІ етап - письмова відповідь на 4 теоретичні питання; III-етап - перевірка практичних навичок – 1 питання.Теоретичні питання
2. Характеристика процесу травлення в шлунку: механізм активації та специфічність дії ферментів (пепсин, гастриксин, ренін). Біохімічні аспекти… 3. Механізм утворення та роль хлоридної кислоти. Кислотність шлункового соку… 4. Травлення білків у тонкій кишці: протеолітичні ферменти підшлункової залози та тонкої кишки, механізм їх…Практична робота
Дослід 1. Визначення загальної кислотності, загальної хлоридної кислоти, вільної хлоридної кислоти та зв’язаної хлоридної кислоти в одній порції шлункового соку.
Принцип методу.Шлунковий сік титрують 0,1 н розчином NaОН у присутності змішаних індикаторів за принципом суміші сильної та слабкої кислот. Сильною кислотою в шлунковому соку є хлоридна кислота, точка еквівалентності якої при титруванні лежить у нейтральному середовищі. Слабкою кислотою є зв’язана хлоридна кислота, групи-СООН білків, органічні кислоти, кислі фосфати, точка еквівалентності яких при титруванні з сильною кислотою лежить у слабо лужному середовищі.
Матеріальне забезпечення: профільтрований шлунковий сік, 0,1 н розчин їдкого натру, 0,5 % розчин п-диметиламіноазобензолу, 0,5 % розчин фенолфталеїну, бюретки, колбочки, піпетки.
Хід роботи. У колбочку відмірюють 5 мл профільтрованого шлункового соку, додають 1 краплю п-диметиламіноазобензолу та 2 краплі фенолфталеїну. При наявності в шлунковому соку вільної хлоридної кислоти він забарвлюється в червоний колір, а при її відсутності відразу з’являється жовте або оранжеве забарвлення. Титрують вільну хлоридну кислоту 0,1 н розчином NaОН з бюретки до появи оранжевого забарвлення і записують результат (І позначка). Не додаючи лугу в бюретку, продовжують титрування до появи лимонно-жовтого забарвлення і записують результат (ІІ позначка). Продовжують титрування до появи рожевого забарвлення (ІІІ позначка від нуля).
Розрахунок.
ІІІ позначка відповідає загальній кислотності. Середнє арифметичне значення між ІІ і ІІІ позначками відповідає загальній… Зв’язану хлоридну кислоту визначають за різницею між вмістом загальної хлоридної кислоти та вільної.Дослід № 3. Бензидинова проба на кров.
Принцип методу:реакція базується на окисненні бензидину до п-хінондііміду киснем, який утворюється при розкладі гідрогену пероксиду під дією гемоглобіну крові.
Матеріальне забезпечення:патологічний шлунковий сік, 10 % розчин бензидину в оцтовій кислоті, 3 % H2O2, піпетки, пробірки, штатив.
Хід роботи:До 1 – 2 мл патологічного шлункового соку з підвищеною кислотністю додають 4 – 5 крапель 10 % розчину бензидину в оцтовій кислоті та 2 – 3 краплі 3 % розчину гідрогену пероксиду. У присутності крові утворюється синє або зелене забарвлення внаслідок окиснення бензидину.
Зробити висновок.
Клініко-діагностичне значення.У шлунку кров може з’являтися внаслідок кровотечі з його стінок при виразковій хворобі шлунка, з варикозно розширених вен стравоходу, при легеневих і носових кровотечах, екстирпації зуба, а також може потрапляти в шлунок з їжею.
Дослід № 4. Уреазний метод виявлення в шлунковому соку Helicobacter pylori.
Матеріальне забезпечення:патологічний шлунковий сік, 0,5 % спиртовий розчин фенолфталеїну, 1 % розчин сечовини, піпетки, пробірки, штатив. Хід роботи:До 1 – 2 мл патологічного шлункового соку додають 1 – 2 мл сечовини… Зробити висновок.B. Дегідрогеназа
C. АлАТ
D. АсАТ
E. Карбоксипептидаза
6. Під час дослідження секреторної функції шлунка виявлено гіпохлоргідрію. Активність якого ензиму при цьому знижена?
A. Дипептидази
B. Гексокінази
C. Ліпази
D. Амілази
E. Пепсину
7. Під час комплексного обстеження у шлунковому соку пацієнта виявлена речовина, наявність якої свідчить про надмірну інтенсивність процесів молочнокислого бродіння в шлунку (непрямий доказ відсутності чи низької концентрації хлоридної кислоти). Яка це речовина?
A. Пепсин
B. Молочна кислота
C. Пепсиноген
D. Ренін
E. Внутрішній фактор касла
8. у шлунковому соку пацієнта при дослідженні виявлена молочна кислота. Для її виявлення використали...
A. Бензидинову пробу
B. Реакцію Уффельмана
D. Реакцію з резорцином E. Пробу ФелінгаІндивідуальна самостійна робота студентів
1. Сучасні вимоги до компонентів раціонального харчування. Роль харчових добавок.
Література
Основна:
1. Губський Ю.І. Біологічна хімія: Підручник. – Київ: Нова книга, 2009. – С. 464 – 480.
2. Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. Підручник. – Тернопіль: Укрмедкнига, 2002. – С. 288 – 290, 357 – 363, 397 – 403.
3. Біологічна хімія: тести та ситуаційні задачі: навч. посібник. / Т.І.Бондарчук, Н.М.Гринчишин, Л.І.Кобилінська та ін.; за ред. О.Я.Склярова.– К.: ВСВ «Медицина», 2010. С. 175 – 188.
4. Біохімічні показники в нормі і при патології / За ред. О.Я. Склярова – К.: Медицина, 2007. – С. 137 – 167.
5. Клінічна біохімія / За ред. О.Я. Склярова. – К.: Медицина, 2006. – С. 201 – 227.
Додаткова:
1. Березов Т.Т., Коровкин Б. Ф. Биологическая химия. -.М.: Медицина, 1998. – С. 319 – 321, 363 – 370, 409 – 430.
2. Біохімія ензимів. Ензимодіагностика. Ензимопатологія. Ензимотерапія: Посібник / Скляров О., Сольскі Я., Великий М., Фартушок Н., Бондарчук Т., Дума Д. – Львів: Кварт. – 2008. – 335 с.
3. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 274 – 298.
4. Практикум з біологічної хімії. За ред. О.Я.Склярова. – К.”Здоров’я”, 2002, С.209 – 219.
5. Скляров О.Я., Косий Є.Р., Скляров Є.Я. «Основи гастроентерології».- Львів, Кварт, 2011. – 289 с.
6. Современные подходы к молекулярной диагностике и типированию клинических изоляторов Helicobacter pylori / Говорун В.М., Момыналиев К.Т., Смирнова О.В. и др.// РЖГГК. – 2002. - № 3. – С.57 – 64.
Тема № 2. Дослідження функціональної ролі водорозчинних (коферментних) та жиророзчинних вітамінів у метаболізмі та реалізації клітинних функцій.
Актуальність теми:Водорозчинні та жиророзчинні вітаміни беруть участь в обміні речовин як коферменти і активатори багатьох ферментативних та не… Конкретні завдання: Ø Трактувати роль водорозчинних та жиророзчинних вітамінів та їх попередників як компонентів харчування у…Теоретичні питання
2. Екзо- і ендогенні гіпо- та авітамінози, їх причини та наслідки. Гіпервітамінози: можливі причини та наслідки. 3. Вітаміни В1 і В2, їх будова, коферментна роль, джерела для людини, добова… 4. Будова, властивості вітаміну Н та пантотенової кислоти. Роль коферментів карбоксибіотину і КоАSH в обмінних…Практична робота
Дослід 1. Відновлення метиленової синьки аскорбіновою кислотою.
Принцип методу.Аскорбінова кислота здатна відновлювати метиленовий синій, який переходить при цьому у безколірну лейкосполуку.
Матеріальне забезпечення: 0,01 % розчин метиленового синього, 10 % розчин Na2CO3, 1 % витяжка з шипшини, дистильована вода, пробірки.
Хід роботи:У дві пробірки додають по одній краплі 0,01 % розчину метиленової синьки і 10 % розчину Na2CO3. В першу пробірку додають 5 крапель 1 % витяжки з шипшини, в другу – стільки ж дистильованої води. Пробірки одночасно нагрівають. У пробірці з витяжкою з шипшини рідина знебарвлюється.
Зробити висновок. Пояснити отриманий результат.
Дослід 2. Реакція з феруму хлоридом на виявлення вітаміну Е.
Матеріальне забезпечення:токоферол (0,1 % спиртовий розчин), 1 % розчин феруму хлориду, пробірки. Хід роботи:В суху пробірку вливають 4-5 крапель 0,1 % спиртового розчину… Зробити висновок. Пояснити отриманий результат, вказати на причини появи червоного кольору.Контроль виконання лабораторної роботи
1. Виявлення вітаміну С реакцією з метиленовим синім. Поясніть принцип методу.
2. Виявлення вітаміну Е реакцією з феруму хлоридом. Поясніть принцип методу.
3. У пацієнтки спостерігається порушення перебігу вагітності, існує загроза викидня. Дефіцит якого вітаміну може спостерігатися та якою якісною реакцією це можна виявити ?
A.Реакція з нітратною кислотою
B. Реакція з феруму хлоридом
C. Реакція з дихлорфенол-індофенолом
D.Реакція із феруму сульфатом
E. Біуретова реакція
4. Які з наведених лікарських препаратів, що є аналогами вітамінів мають антигеморагічну дію:
A. Синкавіт
B. Вікасол
C. Глутамінова кислота
D. Кокарбоксилаз
E. Гепарин
1. У хворого дистрофія скелетної мускулатури. При якому гіповітамінозі це спостерігається ? A. Вітамін Е B. Вітамін В1Індивідуальна самостійна робота студентів
1. Ендогенні гіповітамінози. Причини та механізми розвитку при захворюваннях травної та серцево-судинної систем.
2. Біологічно-активні добавки до їжі. Їх роль у профілактиці патологічних станів та збалансованому харчуванні людини.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – С. 106-114.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – C. 481-501.
3. Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. – Тернопіль: Укрмедкнига, 2002. – С. 71-74, 98-102.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – К: Медицина, 2010. – 360 с.
5. Біохімічні показники в нормі і при патології / За ред. О.Я. Склярова – К.: Медицина, 2007. – 320 с.
6. Клінічна біохімія / За ред. Склярова О.Я. – Київ: Медицина, 2006. – C.162-221.
7. Практикум з біологічної хімії / За ред. О.Я. Склярова. – К.: Здоров’я, 2002. – С. 167-179.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1990. – С. 126-129, 145-157, 165-168.
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 204 – 247.
3. Кольман Я., Рем К.-Г. Наглядная биохимия. – М.: Мир, 2000. – 470 с.
4. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 278 – 279.
Змістовий модуль № 18. Біохімія та патобіохімія крові.
Тема № 3. Дослідження кислотно-основного стану крові та дихальної функції еритроцитів. Патологічні форми гемоглобінів.
Актуальність теми:Дихальна функція еритроцитів здійснюється за рахунокгемоглобіну. Завдяки здатності приєднувати кисень при його високому… У діагностиці невідкладних станів важлива роль належить визначенню… Конкретні завдання:Теоретичні питання
2. Гомеостатичні, фізико-хімічні і біологічні властивості крові. 3. Гемоглобін, його структура (особливості первинного, вторинного, третинного… 4. Фізіологічні типи гемоглобіну різних етапів розвитку організму. Похідні гемоглобіну, їх значення.Практична робота
Дослід 1. Виявлення оксигемоглобіну (НbО2)Fе2+.
Матеріальне забезпечення: спектроскоп, натрію дитіоніт, розчин крові. Хід роботи: У мірний циліндр на 50 мл вливають 1 мл дефібринованої крові і… Зробити висновок. Звернути увагу на те, що вивчення спектрів поглинання дає можливість виявити оксигемоглобін.Дослід 3. Визначення геміну (Fе3+).
Хід роботи:1. Визначення лужного геміну (ОН). До розчину оксигемоглобіну додають 2 – 3 краплі 5 % розчину натрію гідроксиду і нагрівають до зміни кольору. Спостерігають зникнення спектра оксигемоглобіну.
2. Визначення кислого геміну. До розчину оксигемоглобіну додають 2 – 3 краплі 5 % розчину хлоридної кислоти. Спостерігають зміну кольору і зникнення спектру оксигемоглобіну.
Зробити висновок. Звернути увагу на вплив кислот і лугів на властивості гемоглобіну.
Клініко-діагностичне значення.У судово-медичних експертизах ідентифікацію крові проводять за утворенням геміну.
Дослід 4. Колоїдна (осадова) проба Вельтмана на визначення стану білків крові.
Принцип методу. Реакція ґрунтується на флокуляції білків у сироватці крові, яку нагрівають до однократного закипання після додавання її до розчину певної (залежить від колоїдної стабільності системи) кількості кальцію хлориду.
Матеріальне забезпечення:пробірки, 0,5 % розчин кальцію хлориду, сироватка крові.
Хід роботи: До 4,9 мл дистильованої води додають 0,1 мл сироватки крові, вміст пробірки перемішують шляхом її перевертання і потім приливають 0,1 мл 0,5 % розчину хлориду кальцію. Вміст пробірки струшують і нагрівають над газовим пальником до закипання суміші. Потім пробірку охолоджують і дивляться крізь неї на світло.
Якщо пластівці в пробірці не з’являються, то до розчину додають ще 0,1 мл СаСl2 і знову нагрівають до кипіння. Процедуру повторюють до випадання пластівчастого осаду.
Результати оцінюють за загальною кількістю кальцію хлориду в цій реакції.
Клініко-діагностичне значення. Використання осадових проб з діагностичною метою базується на зміні розчинності білків плазми крові при деяких захворюваннях. Сольові розчини викликають преципітацію білків, що проявляється помутнінням розчинів або утворенням пластівців. Результати осадових проб можуть бути показовими при захворюваннях печінки, а також при інших захворюваннях, які супроводжуються диспротеїнеміями з переважанням грубодисперсних глобулінових фракцій. До колоїдних проб відносяться тимолова, сулемова, Вельтмана. Норма для проби Вельтмана становить 0,4 – 0,5 мл кальцію хлориду. Утворення пластівців при додаванні СаСl2 менше норми спостерігається при паренхіматозному ураженні печінки, малярії, більше норми – при ревматизмі, туберкульозі легень.
Контроль виконання лабораторної роботи
1. Клініко-діагностичне значення визначення концентрації гемоглобіну крові, похідних гемоглобіну. гемінової групи гемоглобіну. Поясніть принцип методу.
2. Клініко-діагностичне значення використання колоїдних (осадових) проб.
3. Де переважно синтезуються порфірини та їх ізомери?
А. Селезінка
В. Печінка
С. Лімфовузли
D. Нирки
Е. М’язи
4. Яка залежність між рН і концентрацією Н+?
А. Немає залежності
В. Прямо пропорційна
С. Обернено пропорційна
D. Однакові поняття
Е. Змінюється відповідно до умов
5. Які відомі найважливіші причини метаболічного ацидозу?
А. Затримка нелетких кислот
В. Затримка летких кислот
С. Затримка фосфатів
D. Виведення сульфатів
Е. Втрата гідрокарбонатів
6. Таласемії відносяться до вроджених дефектів синтезу гемоглобінів, при яких у мутантних формах гемоглобінів відсутні α- або β-ланцюги. b-таласемію характеризує:
А. Зменшення кількості гемоглобіну F
В. Збільшення кількості гемоглобіну F
С. Серпоподібна форма еритроцитів
D. Збільшення кількості гемоглобіну А
Е. Гемолітична анемія
7. До складу гемоглобіну S входять:
А. Два a- і два g-ланцюги
В. Два a- і два b-ланцюги
С. Два a- і два d-ланцюги
D. Конденсовані з аміногрупами b-ланцюгів залишки глюкози
Е. В b- ланцюгах у 6 положенні є залишок валіну
8. Концентрація гемоглобіну в крові 90 г/л. Назвіть можливі наслідки для організму.
9. При яких захворюваннях можуть відбутися зміни первинної структури молекули гемоглобіну?
10. Хворий віком 34 роки поступив у клініку з температурою тіла 38оС, запах ацетону з рота (рН 7,56, рСО2 17 мм. рт. ст., НСО3- 9 мекв/л). Яка можлива причина такого стану?
Приклади тестів „Крок-1”
1. Для транспортування СО2 із тканин до легень необхідна участь ферменту:
А. Декарбоксилази
В. Карбоангідрази
С. Карбоксилази
D. Каталази
Е. Цитохромоксидази
2. Людина тривалий час перебувала в умовах високогір’я. Які зміни в її крові будуть спостерігатися?
А. Збільшення кількості лейкоцитів
В. Зменшення кількості лейкоцитів
С. Збільшення спорідненості гемоглобіну до кисню
D. Зменшення частоти пульсу
Е. Зменшення спорідненості гемоглобіну до кисню
3. У хворого при аналізі крові виявлено, що еритроцити мають форму півмісяця. Концентрація гемоглобіну - 78 г/л, кількість еритроцитів - 3,5· 1012. Які зміни в структурі гемоглобіну призводять до такої форми еритроцитів?
А. Глутаміну на гліцин
В. Серину на валін
С. Метіоніну на тирозин
D. Глутамінової кислоти на валін
Е. Лейцину на лізин
Індивідуальна самостійна робота студентів
1. Оцінка стану системи крові та її біохімічних функцій.
2. Порушення кислотно-основного стану: ацидози, алкалози. Причини і способи корекції.
Література
Основна:
1. Губський Ю.І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – 508 с.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 502 - 517.
3. Гонський Я.І., Максимчук Т.П. Біохімія людини. – Київ-Тернопіль: Укрмедкнига, 2001. – С. 553 – 556.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Львів: Світ, 2006. – 271 с.
Додаткова:
1. Березов Т.Г., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1990. – С. 65 – 71.
2. Березов Т.Г., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 567 – 598.
3. Бишевський А.Ш., Терсенов О.А., Біохімія для лікаря. – Київ, Укр. центр духовної культури, 2001. – 395 с.
4. Клиническая биохимия: Учебник для студентов мед. вузов / А. Я. Цыганенко, В.И. Жуков, В.В. Леонов и др. – Харьков: Факт, 2005. – 456 с.
5. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 319 – 331.
Тема № 4. Дослідження білків плазми крові: білки гострої фази запалення, власні та індикаторні ферменти. Дослідження небілкових азотовмісних і безазотистих компонентів крові.
Мета заняття: Знати основні білки плазми крові та вміти використовувати їх кількісні показники для діагностики гіпер- і гіпопротеїнемій, диспротеїнемій, парапротеїнемій, спадкових захворювань, пов’заних з недостатнім синтезом тих чи інших білків крові. Знати небілкові азотовмісні сполуки крові, що складають залишковий азот та засвоїти методи визначення залишкового азоту і середніх молекул крові та вміти застосовувати отримані показники в діагностиці захворювань.
Актуальність теми:У плазмі крові виявлено і описано понад 100 білків, які відрізняються між собою за фізико-хімічними та функціональними властивостями. Серед них є транспортні білки, ферменти, інгібітори ферментів, гормони, фактори коагуляції, антитіла, антикоагулянти, антиоксиданти та інші.
Білки плазми визначають її властивості: колоїдно-осмотичний тиск і, тим самим, постійний об’єм крові, в’язкість крові, підтримання постійного рН крові та функції, а саме: захисну, регуляторну, терморегуляторну, дихальну, трофічну тощо.
Залишковий азот є важливим показником стану білкового обміну. Значення небілкового азоту і його окремих компонентів проводиться з метою діагностики порушень функції нирок, печінки, ендогенної інтоксикації при ряді захворювань та оцінки ступеня ниркової недостатності.
Конкретні завдання:
Ø Провести розділення білків на фракції методом висолювання.
Ø Знати діагностичне значення зростання в крові вмісту білків „гострої фази” запальних процесів.
Ø Розуміти молекулярно-біохімічні механізми змін вмісту в плазмі крові секреторних та тканинних ферментів.
Ø Охарактеризувати основні азотовмісні небілкові сполуки, їх метаболічне походження.
Ø Вміти визначити залишковий азот крові.
Ø Оволодіти спектрофотометричним методом визначення середніх молекул.
Ø Дати оцінку отриманим результатам і використати їх у клініко - діагностичних цілях.
Теоретичні питання
2. Альбуміни і глобуліни. Суть методу електрофорезу білків плазми крові. Електрофореграми при різних захворюваннях. 3. Глікопротеїни крові, їх будова, біологічна роль, зміна складу при… 4. Білки гострої фази запалення: С-реактивний білок, церулоплазмін, гаптоглобін, кріоглобулін, α1-антитрипсин,…Практична робота
Принцип методу.Білки можна виділити з розчинів у вигляді осадів. Існує багато різних способів осадження білків. Осадження білків концентрованими… Якщо до розчинів білків додавати солі лужних і лужноземельних металів, то їх… Білки осаджують за різних концентрацій солей. Деякі з них вже випадають в осад за концентрації амонію сульфату…Дослід 2. Визначення залишкового азоту крові (метод Боданського).
Матеріальне забезпечення:кров, 10 % розчин трихлорацетатної кислоти, сульфатна кислота концентрована, гідрогену пероксид концентрований, 12,5 М… Хід роботи: 1. Отримання безбілкового фільтрату.Дослід 3. Визначення рівня середніх молекул (СМ).
Спектрофотометричний метод належить до експрес-методів. Принцип методу. Полягає у вимірюванні на спектрофотометрі при λ=254 і… Матеріальне забезпечення:сироватка крові, 10 % розчин трихлорацетатної кислоти, 10 % розчин натрію гідроксиду,…Контроль виконання лабораторної роботи
1. Клініко-діагностичне значення визначення альбумінів і глобулінів крові.
2. Принцип методу визначення залишкового азоту крові. Клініко-діагностичне значення його визначення.
3. При гепатиті, інфаркті міокарда в плазмі крові різко зростає активність аланін- і аспартатамінотрансфераз. Які причини зростання активності цих ферментів?
А. Підвищення активності ферментів гормонами
В. Зростання швидкості синтезу амінокислот у тканинах
С. Збільшення швидкості розпаду амінокислот у тканинах
D. Нестача піридоксину
Е. Пошкодження мембран клітин і вихід ферментів у кров
4. При аналізі крові хворого визначені залишковий азот і сечовина.Частка сечовини в залишковому азоті значно зменшена. Для захворювання якого органа характерний даний аналіз?
А. Нирки
В. Серце
С. Кишечник
D. Печінка
Е. Шлунок
5. У хворого на гломерулонефрит спостерігається азотемія. На яку речовину припадає найбільше азоту?
А. Креатинін
В. Амінокислоти
С. Сечова кислота
D. Сечовина
Е. Амонійні солі
6. Вміст альбумінів у плазмі крові – 15 г/л. Як називається такий стан та які його наслідки для організму?
7. У хворих з постійною протеїнурією можуть з’явитися набряки. Пояснити причину такого стану.
8. Дитина перехворіла на інфекційне захворювання. Які зміни в білкових фракціях сироватки крові можна при цьому очікувати?
Як за вмістом залишкового азоту крові та загального азоту сечі диференціювати ретенційну і продукційну азотемії?
Приклади тестів „Крок-1” 1. У пацієнта вміст загального білка в плазмі крові в межах норми. Які серед… А. 35-45 г/лІндивідуальна самостійна робота студентів
1. Роль білків та індикаторних ферментів плазми крові в нормі та при патології.
2. Оцінка показників азотистого обміну та зміни вмісту азотовмісних небілкових компонентів крові
3. Кількісні зміни залишкового азоту крові при парентеральному харчуванні, переливанні крові, застосуванні плазми, сироватки чи плазмозамінників.
4. Біохімічні аспекти використання деяких лікарських препаратів при азотемії.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – 508 с.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 502 - 512.
3. Гонський Я.І., Максимчук Т.П. Біохімія людини. – Тернопіль: Укрмедкнига, 2001. – 736 с.
4. Гонський Я. І., Максимчук Т.П., Калинський М.І. Біохімія людини. – Тернопіль: Укрмедкнига, 2002. – 744 с.
5. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Львів: Світ, 2006. – 271 с.
6. Клінічна біохімія (лекції для студентів мед., стомат. та фарм. факультетів) / За ред. проф. Склярова О.Я. – Львів, 2004. – 295 с.
7. Практикум з біологічної хімії / За ред. О.Я. Склярова. – К.: Здоров’я, 2002. – 297 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1990. – 528 с.
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 567 – 598.
3. Бишевський А.Ш., Терсенов О.А., Біохімія для лікаря. – Київ, Укр. центр духовної культури, 2001. – 395 с.
4. Камышников В.С. Клинические лабораторные тесты от А до Я и их диагностические профили / МЕДпрессинформ – Москва, 2005. – 320 с.
5. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 319 – 331.
Тема № 5. Дослідження згортальної, антизгортальної та фібринолітичної систем крові. Дослідження біохімічних закономірностей реалізації імунних процесів. Імунодефіцитні стани.
Мета заняття: Знати роль компонентів згортальної, антизгортальної та фібринолітичної систем в підтриманні агрегатного стану крові. Давати характеристику біохімічним компонентам імунної системи, знати біохімічні механізми виникнення імунодефіцитних станів.
Актуальність теми: Згортання крові є складним фізіологічно-біохімічним процесом, захисною реакцією організму на крововтрату. Знання біохімічної характеристики згортальної, антизгортальної та фібринолітичної систем крові є необхідними для розуміння механізмів підтримання агрегатного стану крові за умов норми та при численних захворюваннях, а також для їх своєчасної корекції фармпрепаратами.
Конкретні завдання:
Ø Трактувати біохімічні механізми функціонування згортальної, антизгортальної та фібринолітичної систем крові.
Ø Оволодіти методами дослідження системи згортання крові та фібринолізу, вміти трактувати отримані результати.
Ø Знати роль компонентів загортальної, антизгортальної та фібринолітичної систем крові в патохімії синдрому дисемінованого внутрішньо судинного зсідання крові, атеросклерозу та гіпертонічної хвороби.
Ø Характеризувати клітинні та біохімічні компоненти імунної системи.
Ø Пояснювати механізми виникнення імунодефіцитних станів.
Теоретичні питання
2. Згортальна система крові; характеристика компонентів (факторів) згортання. Механізми активації та функціонування каскадної системи згортання… 3. Роль вітаміну К у реакціях коагуляції (карбоксилування глутамінової… 4. Спадкові та набуті порушення судинно-тромбоцитарного та коагуляційного гемостазу.Практична робота
Дослід 1. Реакція з цистеїном на вікасол.
Матеріальне забезпечення:0,05 % розчин вікасолу, 0,025 % розчин цистеїну (зберігають у холодильнику), 20 % розчин їдкого натру, пробірки, піпетки. … Хід роботи.У пробірку наливають 5 – 10 крапель 0,05 % спиртового розчину… Зробити висновок. Пояснити отриманий результат.Дослід № 2. Визначення циркулюючих імунних комплексів (ЦІК).
Матеріальне забезпечення:сироватка крові, 0,1 М боратний буфер (рН = 8,4), 4 % розчин поліетиленгліколю-6 000, спектрофотометр, пробірки. Хід роботи.Уконтрольну пробірку вносять 2,7 мл 0,1 М боратного буферу (рН 8,4)… Зробити висновок.Індивідуальна самостійна робота студентів
1. Система протеїну С – біохімічний механізм антикоагулянтної дії.
2. СНІД – молекулярний механізм виникнення, патохімічні зміни.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 518 - 527.
2. Губський Ю.І. Біологічна хімія: Підручник. – Київ: Нова книга, 2007. – С. 518 – 527.
3. Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. Підручник. – Т.: Укрмедкнига, 2002 – С. 288 – 290, 357 – 363, 397 – 403.
4. Біологічна хімія: тести та ситуаційні задачі: навч. посібник. / Т.І.Бондарчук, Н.М.Гринчишин, Л.І.Кобилінська та ін.; за ред. О.Я.Склярова.– К.: ВСВ «Медицина», 2010. С. 262 – 269 с.
5. Біохімічні показники в нормі і при патології / За ред. О.Я. Склярова – К.: Медицина, 2007. – С. 61 – 65.
6. Клінічна біохімія / За ред. Склярова О.Я. – Київ: Медицина, 2006. – С. 279 – 303, 347 – 371.
7. Практикум з біологічної хімії. За ред. О.Я.Склярова. – К.: Здоров’я. – 2002. – С. 249 – 255.
Додаткова:
1. Березов Т.Т., Коровкин Б. Ф. Биологическая химия. - М.: Медицина, 1998. – С. 509 – 607.
2. Виговська Я.І. Дисеміноване внутрішньосудинне зсідання крові. Український журнал гематології та трансфузіології. 2002, № 3, с. 60 – 65.
3. Галяутдинов Г.С., Корнилова Ю.Л. Антитормбин ІІІ: физиология и клиническоское значение. Гематология и трансфузиология, 2002, т. 47, № 6, С. 31 – 35.
4. Лаповець Л.Є., Луцик Б.Д. Посібник з лабораторної імунології. – Львів. – 2002. – 173 с.
5. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 319 – 331.
6. Северин Е.С. Биохимия: учебник. – 2-е изд., испр. – М.:ГЭОТАР-МЕД, 2004. – С 667 – 682.
Змістовий модуль № 19. Функціональна та клінічна біохімія органів і тканин.
Тема № 6. Дослідження обміну кінцевих продуктів катаболізму гему. Патобіохімія жовтяниць.
Мета заняття: Засвоїти біохімічні основи метаболізму гему. Навчитися за біохімічними показниками крові та сечі проводити диференційну діагностику жовтяниць. Знати основні біохімічні функції печінки в обміні вуглеводів, ліпідів, простих і складних білків, у знешкодженні токсичних речовин.
Актуальність теми: У печінці відбувається метаболізм білірубіну – продукту розпаду гему. Порушення процесів метаболізму білірубіну викликають захворювання жовтяниці, діагностика яких проводиться за біохімічними показниками крові та сечі. Печінка займає центральне місце в обміні речовин, підтримуючи гомеостаз внутрішнього середовища організму. З цим органом пов’язані найголовніші детоксикаційні реакції речовин ендогенного та екзогенного походження.
Конкретні завдання:
Ø Трактувати біохімічні закономірності функцій печінки: вуглеводної, ліпідрегулюючої, білоксинтезуючої, сечовиноутворювальної, пігментної, жовчоутворювальної.
Ø Аналізувати диференційні зміни біохімічних показників крові та сечі (вільний та кон’югований білірубін) з метою оцінки патобіохімії жовтяниць.
Ø Пояснювати роль печінки в забезпеченні нормоглікемії (синтез і катаболізм глікогену, глюконеогенез) та при патологічних змінах – гіпо-, гіперглікемії, глюкозурії.
Ø Пояснювати біохімічні основи розвитку недостатності функцій печінки за умов хімічного, біологічного та радіаційного ураження.
Ø Визначити білірубін у сироватці крові. Дати оцінку проведеним дослідженням і зробити висновок.
Теоретичні питання
2. Порушення біохімічних процесів в печінці при окремих захворюваннях (цитолітичний, холестатичний та інші синдроми). Діагностика біохімічних… 3. Роль печінки в обміні жовчних пігментів. Хімізм реакцій розриву… 4. Патобіохімія жовтяниць: гемолітична (передпечінкова), паренхіматозна (печінкова), обтураційна (післяпечінкова), їх…Практична робота
Дослід 1. Визначення вмісту білірубіну в сироватці крові.
Принцип методу. Білірубін взаємодіє з діазореактивом з утворенням азобілірубіну рожевого кольору. Інтенсивність забарвлення розчину пропорційна концентрації білірубіну і може бути визначена фотометрично при зеленому світлофільтрі (довжина хвилі 530-560 нм). Кон’югований білірубін дає швидку (пряму) реакцію. Реакція некон’югованого білірубіну значно повільніша. Додаванням акселераторів (кофеїн та ін.) вільний білірубін можна перевести в розчинний стан і визначити кількість загального білірубіну. При використанні буферного розчину без акселераторів визначається кон’югований білірубін, а при використанні буферного розчину з акселераторами – загальний білірубін. Кількість некон’югованого білірубіну дорівнює різниці між кількістю загального і прямого білірубіну.
Визначення вмісту білірубіну рекомендують виконувати відразу ж після отримання проб, щоб попередити його окиснення на світлі; вплив прямого сонячного світла може бути причиною 50% зниження вмісту білірубіну вже через одну годину. Проби повинні бути проаналізовані протягом 2 год з момента забору крові, якщо вони зберігаються при кімнатній температурі, і в темряві, або протягом 12 год при умові зберігання при температурі 2-8 °С в темряві. Гемоліз еритроцитів прямо пропорційно знижує показники кількості білірубіну, який визначається у сироватці крові; виражена ліпемія обумовлює підвищені показники білірубіну.
Матеріальне забезпечення:сироватка крові; реагент 1 без акселератора; реагент 1 з акселератором; реагент 2; пробірки; дистильована вода; піпетки; ФЕК.
Хід роботи:
Визначення проводять за схемою:
| Реактиви | Дослід | Контроль | Дослід | Контроль |
| Зв’язаний білірубін | Зв’язаний білірубін | Загальний білірубін | Загальний білірубін | |
| реагент 1 без акселератора | 3 мл | 3 мл | - | - |
| реагент 1 з акселератором | - | - | 3 мл | 3 мл |
| реагент 2 | 0,075 мл | 0,075 мл | 0,075 мл | 0,075 мл |
| сироватка крові | 0,4 мл | - | 0,4 мл | - |
| вода дистильована | - | 0,4 мл | - | 0,4 мл |
Суміші швидко перемішують і точно через 5 хв визначають оптичну густину при зеленому світлофільтрі (560 нм) проти контрольних проб з дистильованою водою. Кількість білірубіну визначають за калібрувальною кривою.
Крива залежності оптичної густини розчину білірубіну від його концентрації
Пояснити отримані результати. Зробити висновок.
Клініко-діагностичне значення.У нормі вміст загального білірубіну становить 1,7-20,5 мкмоль/л (0,1-1,2 мг/100 мл), некон’югованого – 1,7-17,1 мкмоль/л (0,1-1,0 мг/100 мл), кон’югованого 0,86-4,30 мкмоль/л(0,05-0,25 мг/100 мл). Токсична дія високих концентрацій білірубіну крові проявляється ураженням центральної нервової системи, виникненням некротичних ділянок в паренхіматозних органах, пригніченням клітинного імунітету, розвитком анемії внаслідок гемолізу еритроцитів. Важливу роль в токсичній дії білірубіну відіграє його фотосенсибілізуюча дія. Білірубін, як метаболіт протопорфірину, одного з найбільш активних фотосенсибілізаторів, здатний, використовуючи квантову енергію світла, переводити хімічно інертний молекулярний кисень у надзвичайно активну, синглетну форму. Синглетний кисень руйнує будь-які біологічні структури, окиснює ліпіди мембран, нуклеїнові кислоти, амінокислоти білків. У наслідок активації ним перекисного окиснення ліпідів і відщеплення глікопротеїнів, а також високомолекулярних пептидів мембран виникає гемоліз еритроцитів. Нагромадження в крові білірубіну вище 27,4-34,2 мкмоль/л призводить до відкладання його в тканинах і появи жовтяниці. В залежності від причини жовтяниця може бути надпечінкова (гемолітична), печінкова (паренхіматозна), підпечінкова (обтураційна).
При гемолітичній жовтяниці печінка не встигає зв’язувати велику кількість вільного білірубіну, що утворюється внаслідок підсиленого гемолізу еритроцитів. У результаті в плазмі крові спостерігається підвищений вміст білірубіну (до 90-100 мкмоль/л) за рахунок вільного білірубіну. Така форма жовтяниці спостерігається при гемолітичній, перніціозній анемії.
При паренхіматозній жовтяниці внаслідок пошкодження гепатоцитів знижується кон’югаційна здатність печінки, знижується синтез жовчі, кон’югований білірубін частково попадає назад у кров. Білірубінемія різного ступеня, яка при цьому спостерігається, розвивається за рахунок фракції як зв’язаного, так і вільного білірубіну. Паренхіматозна жовтяниця виникає при жирових гепатозах (стеатозах), гепатитах (вірусних, токсичних), цирозах печінки.
При обтураційній жовтяниці внаслідок закупорки (камінцями, пухлиною) жовчних протоків жовч переповнює їх і попадає в русло крові. Білірубінемія, яка при цьому розвивається, характеризується значною вираженістю (до 170-700 мкмоль/л) в основному за рахунок фракції зв’язаного білірубіну.
У новонароджених внаслідок стерильності кишки білірубін не перетворюється у похідні (метаболіти), але активно всмоктується у кров, зумовлюючи гіпербілірубінемію. Крім того, у новонароджених часто спостерігається тимчасова понижена активність білірубінглюкуронілтрансферази, що є причиною жовтяниці новонароджених, яка характеризується високим вмістом у крові некон’югованого білірубіну.
Захворювання, що викликають зростання некон’югованого білірубіну: гемолітична анемія, перніціозна анемія, жовтяниця новонароджених, хвороба Жільбера, синдром Криглера-Найяра, синдром Ротора.
Контроль виконання лабораторної роботи
1. Поясніть принцип методу визначення вмісту білірубіну та його фракцій в сироватці крові колориметричним діазометодом. Клініко-діагностичне значення визначення фракцій білірубіну.
2. Яка концентрація білірубіну в крові здорової людини?
3. У хворого на гепатит показник де Рітіса (відношення активності АсАТ до активності АлАТ) становить 0,50. Про що це свідчить? Як внутрішньоклітинна локалізація цих ензимів впливає на зростання їх активності у крові при цитолітичних процесах різного ступеня?
4. У хворого вміст альбумінів у крові становить 15 г/л при нормі 32-55 г/л, протромбіновий час – 40 с при нормі 12-20 с. Про які біохімічні порушення це свідчить і до яких наслідків може призвести?
Приклади тестів “Крок-1”
1. У жінки віком 46 років із жовчнокам’яною хворобою, розвинулась жовтяниця. При цьому сеча стала темно-жовтого кольору, кал – знебарвлений, у плазмі крові виявлено підвищений вміст кон’югованого (прямого) білірубіну. Який вид жовтяниці можна запідозрити?
А. Гемолітичну
B. Паренхіматозну
C. Обтураційну
D. Жовтяницю новонароджених
E. Хворобу Жільбера
2. У малюка, що народився недоношеним, спостерігається жовте забарвлення шкіри та слизових оболонок. Причиною цього стану є тимчасова нестача ензиму:
А. Порфобілінгенсинтази
B. δ-Амінолевулінатсинтази
C. Гемоксигенази
D.УДФглюкуронілтрансферази
E. Білівердинредуктази
3. У хворого із жовтяницею виявлено: підвищення у плазмі крові вмісту загального білірубіну за рахунок непрямого (вільного), у калі і сечі – вмісту стеркобіліну, вміст прямого (зв’язаного) білірубіну в плазмі крові – в межах норми. Який вид жовтяниці можна запідозрити?
А. Жовтяницю новонароджених
B. Паренхіматозну
C. Механічну
D. Гемолітичну
E. Хворобу Жільбера
Індивідуальна самостійна робота студентів
1. Клініко-біохімічна характеристика недостатності функцій печінки за умов хімічного, біологічного та радіаційного ураження; біохімічні механізми розвитку печінкової енцефалопатії.
2. Зміни біохімічних показників при гострому гепатиті, викликаному вірусами чи алкогольною інтоксикацією, їх діагностична оцінка.
3. Зміни біохімічних показників при хронічному гепатиті, цирозі, жовчно-кам’яній хворобі, дискинезії та холециститі, їх діагностична оцінка. Зв’язок порушень екскреторної функції печінки з порушеннями процесів травлення в кишці, діагностика цих порушень.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – 508 с.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 560 -584.
3. Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. – Тернопіль: Укрмедкнига, 2002. – 744 с.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Львів: Світ, 2006. – 271 с.
5. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – К.: Медицина, 2010. – 360 с.
6. Біохімічні показники в нормі і при патології. Довідник / За ред. Склярова О.Я. – К.: Медицина, 2007. – 320 c.
7. Біохімічний склад рідин організму та їх клініко – діагностичне значення. Довідник / За ред. Склярова О.Я. – Київ: Здоров’я, 2003. – 192 c.
8. Практикум з біологічної хімії / За ред. О.Я. Склярова. – К.: Здоров’я, 2002. – С. 3 – 46.
Додаткова:
1. Березов Т. Т., Коровкин Б. Ф. Биологическая химия. – М.: Медицина, 1998. – С. 551 - 565.
2. Кольман Я., Рем К.-Г. Наглядная биохимия. – Москва: Мир, 2000. – 470 с.
3. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 366 – 371.
Тема № 7. Дослідження процесів біотрансформації ксенобіотиків та ендогенних токсинів. Мікросомальне окиснення, цитохром Р-450.
Актуальність теми: У печінці знешкоджуються ендотоксини та ксенобіотики, які є чужорідними для нормальних метаболічних шляхів, можуть змінювати і… Конкретні завдання: Ø Трактувати роль процесів метаболізму та біотрансформації ксенобіотиків.Теоретичні питання
1. Детоксикаційна функція печінки; біотрансформація ксенобіотиків та ендогенних токсинів.
2. Типи реакцій біотрансформації чужорідних хімічних сполук у печінці.
3. Реакції мікросомального окиснення; індуктори та інгібітори мікросомальних монооксигеназ.
4. Електронно-транспортні ланцюги ендоплазматичного ретикулуму. Генетичний поліморфізм та індуцибельність синтезу цитохрому Р-450.
5. Реакції кон’югації в гепатоцитах: біохімічні механізми реакцій з глюкуроновою кислотою, сульфатною кислотою, гліцином, метилювання, ацетилування; їх функціональне значення.
6. Виникнення і природа розвитку толерантності до лікарських засобів.
Практична робота
Методи якісного визначення фенацетину та його метаболітів
Метаболізм.Фенацетин метаболізується шляхом дезалкілування і гідроксилювання. При дезалкілуванні в якості метаболітів утворюються парацетамол,… Виявлення фенацетину за продуктами його гідролізу.Більшість реакцій виявлення… Дослід 1. Утворення індофенолового барвника.Дослід 2. Виявлення фенацетину в сечі.
Принцип методу. Ця проба полягає в тому, що в організмі фенацетин і його метаболіт парацетамол підлягають біотрансформації, в результаті чого утворюється – амінофенол. При його наявності в сечі роблять висновок про те, що людина прийняла фенацетин або парацетамол.
Матеріальне забезпечення: 10 % розчин хлоридної кислоти, 1 % розчин нітриту натрію, 1 % розчин свіжоприготовленого розчину α-нафтолу в 10 % розчині гідроксиду натрію.
Хід роботи:До 1 мл сечі додають 2-3 краплі 10 %-го розчину хлоридної кислоти і охолоджують. Потім до охолодженої суміші додають 2-3 краплі 1 %-го розчину нітриту натрію і 2-3 краплі 1 % свіжоприготовленого розчину α-нафтолу в 10 % розчині гідроксиду натрію. Поява червоного забарвлення вказує на наявність n-амінофенолу в сечі. Великий надлишок α-нафтолу заважає цій реакції.
Дослід 3. Виявлення саліцилової кислоти в крові та сечі за реакцією із феруму нітратом (III).
Матеріальне забезпечення:0,55% розчин заліза нітрату (III), 0,04 н розчин нітратної кислоти. Хід роботи. До 0,5 мл сечі або плазми крові додають 4,5 мл 0,55% -го розчину… Зробити висновок. Пояснити отриманий результат.Контроль виконання лабораторної роботи
1.Пояснити спосіб оцінювання детоксикаційної функції печінки за утворенням гіпурової кислоти (Проба Квіка). Написати реакцію кон’югації.
2. Фенацетин метаболізується в організмі людини шляхом:
А. Дезалкілування і гідроксилювання
В. Дезалкілування
С. Гідроксилювання
D. Метилювання
Е. Декарбоксилювання
3. Субстрати мікросомальних гідроксилаз індукують синтез молекул цитохрому Р-450 в печінці. Висока індукуюча здатність властива фенобарбіталу (снодійному препарату). Як можна пояснити механізм звикання до снодійних засобів (барбітуратів) і до інших лікарських речовин, які окиснюються монооксигеназною системою ендоплазматичного ретикулуму гепатоцитів ?
Приклади тестів “Крок-1”
1. При біотрансформації лікарських засобів з класу барбітуратів (гексобарбіталу, фенобарбіталу, пентобарбіталу) реакції протікають за типом:
A. Окиснювального гідроксилювання алкільних бічних ланцюгів циклічних сполук
B. Окиснювального гідроксилювання за типом гідроксилювання бензолу
C. Реакції окиснювального дезалкілування, зокрема N-дезалкілування
D. Реакції відновлення, зокрема відновлювального дегалогенування
E. Реакції відновлення, зокрема відновлення нітросполук та азосполук
2. Біотрансформація моноциклічних вуглеводнів (анілін, ацетанілід) відбувається за типом:
A. Окиснювального гідроксилювання за типом гідроксилювання бензолу
B. Окиснювального дезалкілування, зокрема N-дезалкілування
C. Реакції відновлення, зокрема відновлювального дегалогенування
D. Окиснювального дезалкілування, зокрема О-дезалкілування
E. Реакції відновлення, зокрема відновлення нітросполук та азосполук
3. Біотрансформація хлорованих циклічних вуглеводнів (пестицидів гептахлору, альдрину) відбувається за типом:
A. Окиснювального гідроксилювання за типом гідроксилювання бензолу
B. Реакції окиснювального дезалкілування, зокрема N-дезалкілування
C. Реакції відновлення, зокрема відновлювального дегалогенування
D. Реакції окиснювального дезалкілування, зокрема О-дезалкілування
E. Реакції відновлення, зокрема відновлення нітросполук та азосполук
4. Біотрансформація поліциклічних вуглеводнів, що мають канцерогенні властивості відбувається за типом:
A. Окиснювального гідроксилювання за типом гідроксилювання бензолу
B. Окиснювального дезалкілування, зокрема N-дезалкілування
C. Реакції відновлення, зокрема відновлювального де галогенування
D. Окиснювального дезалкілування, зокрема О-дезалкілування
E. Реакції відновлення, зокрема відновлення нітросполук та азосполук
5. Біотрансформація тетрахлоретану відбувається за типом:
A. Реакції відновлення (без участі кисню), зокрема відновлювального дегалогенування
B. Окиснювального дезалкілування, зокрема N-дезалкілування
C. Окиснювального гідроксилювання за типом гідроксилювання бензолу
D. Окиснювального дезалкілування, зокрема О-дезалкілування
E. Реакції відновлення, зокрема відновлення нітросполук та азосполук
6. У клінічній практиці як індикатор активності гниття білків у кишечнику та функціонального стану печінки розглядається величина екскреції тваринного індикану, який утворюється в печінці в результаті реакції кон’югації:
А. Сульфування
В. Глюкурування
С. Метилювання
D. Ацетилювання
Е. З гліцином
7. Показником активності біотрансформації лікарських засобів в організмі людини є інтенсивність реакції:
А. Ацетилювання сульфаніламідів
В. Ацетилювання пеніциліну
С. Ацетилювання аспірину
D. Метилювання сульфаніламідів
Е. Метилювання пеніциліну
8. Визначення інтенсивності реакції (кількості екскретованої з сечею гіпурової кислоти після введення per os стандартної дози бензоату), яка лежить в основі дослідження антитоксичної функції печінки, є так звана:
А. Проба Квіка
В. Реакція Фоля
С. Реакція Мілона
D. Реакція Тромера
Е. Нінгідринова реакція
Індивідуальна самостійна робота студентів
1. Реакції мікросомального окиснення та кон’югації в біотрансформації ксенобіотиків та ендогенних токсинів.
Література
Основна:
1. Губський Ю.І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – 508 с.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 567 -576.
3. Гонський Я.І. Біохімія людини. – Тернопіль: Укрмедкнига, 2001. – 735 с.
4. Біологічна хімія. Тести та ситуаційні задачі. / За ред. О.Я. Склярова. – Львів: Світ, 2006. – 271 с.
5. Біохімічний склад рідин організму та їх клініко – діагностичне значення. Довідник / За ред. Склярова О.Я. – Київ: Здоров’я, 2003. – 192 c.
6. Практикум з біологічної хімії / Під ред. проф. О.Я. Склярова. – Київ: Здоров’я, 2002. – 298 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 551 – 565.
2. Справочник по лабораторным методам исследования / Под ред. проф. Л.А. Даниловой. – М. – С.-Петербург – Ниж. Новгород – Воронеж – Ростов-на-Дону – Екатеринбург – Самара – Киев – Харьков – Минск: Питер, 2003. – 733 с.
Тема № 8. Дослідження водно-сольового та мінерального обмінів.
Мета заняття:Вивчити процеси обміну води і мінеральних речовин в організмі людини. Оволодіти методами якісного та кількісного визначення неорганічних речовин у сироватці крові та вміти інтерпретувати отримані результати при діагностиці та лікуванні деяких захворювань.
Актуальність теми:У зв’язку з тим, що для життєдіяльності організму людини присутність води і неорганічних речовин є обов’язковою і вони можуть змінюватись при різних захворюваннях, знання і розуміння процесів їх обміну, а також їх якісне і кількісне визначення є необхідним для оцінки водно-мінерального обміну.
Теоретичні питання
2. Регуляція водно-сольового обміну, його порушення. Дегідратація і гіпергідратація (гіперволемія та гіповолемія), біохімічні механізми… 3. Мінеральний обмін. Класифікація мінеральних елементів, шляхи їх надходження… 4. Метаболічна роль Nа+, К+ ; гормональна регуляція їх обміну. Механізм дії Nа+, К+-АТФ-ази та її регуляція.Практична робота
Принцип методу.Іони калію в присутності іонівPb2+, Cu2+ і NО-2 утворюють нерозчинний у воді осад К2Pb[Cu(NО2)6] – купрогексанітрит калію-плюмбуму,… Матеріальне забезпечення:1) 5 % розчин ацетату натрію СН3СООNа · 3 Н2О; 2)… Хід роботи:У центрифужну пробірку вносять 0,5 мл розчину ацетату натрію, 0,1 мл досліджуваної сироватки крові і 0,5 мл…Контроль виконання лабораторної роботи
1. При визначенні калію колориметричним методом за Лазаревим Н. утворюється нерозчинний у воді осад К2Pb[Cu(NО2)6] – купрогексанітрит калію-плюмбуму – в присутності:
А. Pb 2+
В. Cu 2+
С. NО-2
D. Са 2+
Е. Nа+
2. Летальність може наступити при концентрації калію вище:
А. 10,5 ммоль/л
В. 8,5 ммоль/л
С. 7,5 ммоль/л
D. 6,5 ммоль/л
Е. 2,12 ммоль/л
3. При нормальній концентрації кальцію в сечі за методом Сульковича через 30 секунд спостерігається:
А. Молочно-біле помутніння сечі
В. Синьо-фіолетове забарвлення
С. Жовто-оранжеве забарвлення
D. Випадає оранжевий осад
Е. Сеча залишається прозорою
4. Раптова зупинка серця може наступити при концентрації загального кальцію в сироватці крові:
А. 3,75 ммоль/л
В. 3,00 ммоль/л
С. 2,75 ммоль/л
D. 2,55 ммоль/л
Е. 2,25 ммоль/л
Приклади тестів “Крок-1”
1. Хворий, який проживає на півночі і вживає в надлишковій кількості печінку риб (містить вітамін D), звернувся в медичний центр зі скаргою на підвищений тиск. Рентгенологічне обстеження підтвердило відкладання каменів у сечових шляхах. У хворого виявлено:
А. Гіперкальціємію
B. Гіпокальціємію
C. Гіперкуприємію
D. Гіпокуприємію
E. Гіперкаліємію
2. Турист у спекотний день довго знаходився без питної води. Нарешті він дістався до джерела і вгамував спрагу. Це призвело до:
А. Підвищення осмоляльності позаклітинної рідини
B. Зниження осмоляльності позаклітинної рідини
C. Підвищення осмоляльності внутрішньоклітинної рідини
D. Зниження осмоляльності внутрішньоклітинної рідини
E. Підвищення внутрішньочерепного тиску
3. До лікаря звернувся хворий, який протягом тривалого часу приймав лікарський засіб – спіронолактон (антагоніст альдостерону) в зв’язку з тахікардією і гіпотензією. Причиною такого стану може бути:
А. Гіпонатріємія
B. Гіпернатріємія
C. Гіперкальціємія
D. Гіпокальціємія
E. Гіперкаліємія
4. У приймальне відділення стаціонару поступив хворий у якого виявлено гіпотензію, порушення свідомості, сухість слизових оболонок. Причиною такого стану може бути:
А. Гіпонатріємія
B. Гіпернатріємія
C.Гіперкуприємія
D. Гіпокуприємія
E. Гіперкаліємія
5. У хворого, який тривалий час приймає тіазидні діуретики може виникнути:
А. Гіпокаліємія
B. Гіперкаліємія
C. Гіперкуприємію
D. Гіпокуприємію
E. Гіперкальціємія
6. Хворому, в якого виявлено клінічні ознаки, зв’язані з гіпернатріємією (збільшений венозний тиск, набряк легень) необхідно здійснити корекцію шляхом введення:
А. Води
B. Антибіотиків
C. Сульфаніламідів
D. Вітамінів
E. Незамінних амінокислот
Індивідуальна самостійна робота студентів
1. Мікроелементози людини.
2. Діагностика водно-електролітного складу організму.
3. Вплив радіоактивних ізотопів, рентгенівського опромінення та інших видів опромінення на порушення мінерального балансу.
4. Методи визначення показників водно-сольового та мінерального обмінів (метод полуменевої фотометрії, іонометричне визначення, хімічні методи).
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 545 - 550.
2. Гонський Я.І.,Максимчук Т.П. Біохімія людини. – Тернопіль: Укрмедкнига, 2002. – 744 с.
3. Біологічна хімія. Тести та ситуаційні задачі. / За ред. проф. О.Я. Склярова. – Медицина, 2010. – 360 с.
4. Біохімічні показники в нормі і при патології. Навчальний довідник / За ред. Склярова О.Я. – Київ: Медицина, 2007. – 320 с.
5. Клінічна біохімія: Підручник / За ред. проф. Склярова О.Я. – Київ: Медицина, 2006. – 432 с.
6. Практикум з біологічної хімії / Під ред. проф. О.Я. Склярова. – Київ: Здоров’я, 2002. – 298 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – 704 с.
2. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Т.2. – М.: Мир; Бином. Лаборатория знаний, 2009. – С. 280 – 281.
3. Справочник по лабораторным методам исследования / Под ред. проф. Л.А. Даниловой. – М. – С.-Петербург – Ниж. Новгород – Воронеж – Ростов-на-Дону – Екатеринбург – Самара – Киев – Харьков – Минск: Питер, 2003. – 733 с.
Тема № 9. Сечоутворювальна функція нирок. Нормальні та патологічні компоненти сечі.
Мета заняття: Знати фізико–хімічні властивості сечі; основні біохімічні показники нормальних і патологічних компонентів та шляхи їх проникнення в… Актуальність теми:Біохімічний аналіз сечі є обов’язковим в амбулаторних і… При біохімічному дослідженні виявляють як нормальні, так і патологічні компоненти сечі. Біохімічний аналіз сечі дає…Практична робота
Для лабораторних досліджень використовують ранішню сечу. Забір сечі повинен проводитись в стерильних умовах, щоб уникнути попадання бактерій та грибів. Забір сечі, особливо добовий, вимагає консервації такими речовинами, як тимол, толуол, формальдегід, хлороформ. Сеча для дослідження ферментів не має містити консервантів; її потрібно охолодити або заморозити. Для наших досліджень проводимо забір середньої порції сечі під час першого ранкового сечовипускання.
Аналіз сечі проводять, починаючи з оцінки фізико-хімічних властивостей: кількість, колір, запах, прозорість, реакція (рН) і густина сечі.
Дослід 1. Фізико-хімічні властивості сечі.
Визначення кількості сечі. Виділення сечі за певний проміжок часу (за день, ніч або повністю за добу) називається діурезом. Об’єм сечі вимірюють… Клініко-діагностичне значення:У нормі доросла людина за добу виділяє в… 1.1. Колір сечі.Колір сечі визначають у склянці з безбарвного скла у відбитому світлі на білому фоні.Хімічне дослідження на розрізнення організованих осадів від неорганізованих.
Матеріальне забезпечення:пробірки, 10 % розчин ацетатної кислоти, 5 % розчин гідроксиду натрію. Хід роботи:У 2 пробірки наливають по 5 мл сечі і додають у першу пробірку 1 мл… За результатами проведеного експерименту зробити висновки.Реакція сечі. Визначення рН сечі за допомогою індикаторного паперу.
За результатами проведеного експерименту зробити висновки. Точніше визначають рН сечі потенціометричним методом. Клініко-діагностичне значення.Реакція сечі (рН) у здорової людини коливається… Великий вплив на реакцію сечі має характер харчування. При посиленому білковому харчуванні (м’ясо) сеча стає більш…Дослід 2. Виявлення патологічних компонентів сечі.
2.1. Виявлення білку в сечі.
Принцип методу.Для виявлення білку в сечі найчастіше застосовують реакцію осадження за допомогою сульфосаліцилової кислоти.
Матеріальне забезпечення: сеча, що містить білок (патологічна) і нормальна сеча, 20 % розчин сульфосаліцилової кислоти, пробірки, піпетки.
Хід роботи:У першу пробірку наливають 2 мл нормальної сечі, у другу пробірку – 2 мл патологічної. У обидві пробірки добавляють по 5 крапель 20 % розчину сульфосаліцилової кислоти. При наявності білка у сечі утворюється білий осад або муть.
За результатами проведеного експерименту зробити висновки.
Кількісне визначення вмісту білка у сечі за методом Робертса-Стольнікова-Брандберга.
Матеріальне забезпечення:нормальна сеча і патологічна сеча, 50 % розчин нітратної кислоти (або розбавлена водою концентрована нітратна кислота 1:1),… Хід роботи: В 6 пробірок наливають по 2 мл води. В першу добавляють 2 мл сечі,… За результатами проведеного експерименту зробити висновки.Проба Фелінга
У пробірку вносять по 10 крапель розчинів Фелінга І (сульфату міді) і ІІ (лужний розчин сегнетової солі), перемішують, додають 20 крапель сечі, нагрівають до кипіння. При наявності глюкози в сечі випадає жовтий або червоний осад.
Проба Барфуда
До 2 мл сечі добавляють 1 мл реактиву Барфуда (ацетат міді розчинений в оцтовій кислоті) і нагрівають на водяній бані 5 хв. При наявності глюкози з’являється осад закису міді.
За результатами проведеного експерименту зробити висновки.
Ця окисно-відновна реакція відрізняється від інших (Троммера, Ніландера, Фелінга, Бенедикта, срібного дзеркала) тим, що окиснення моносахаридів відбувається не в лужному середовищі, а в близькому до нейтрального. У цих умовах дисахариди, що мають також відновні властивості, на відміну від моносахаридів, не окиснюються, завдяки чому їх можна відрізнити. Проба Барфуда з лактозою негативна.
Виявлення крові в сечі (Бензидинова проба).
Принцип методу. Реакція базується на окисненні бензидину до п-хінондиіміну киснем, який утворюється внаслідок розкладу гідрогену пероксиду за присутності крові.
Матеріальне забезпечення:сеча, 10 % розчин бензидину в ацетатній кислоті, 3 % розчин гідрогену пероксиду, піпетки, пробірки, штатив.
Хід роботи: До 3 мл сечі добавляють 2-3 краплі 3 % пероксиду водню і 2 – 3 краплі свіжоприготовленого розчину бензидину в ацетатній кислоті. При наявності крові в сечі з’являється синьо-зелене забарвлення.
За результатами проведеного експерименту зробити висновки.
Клініко-діагностичне значення.Сеча при гематурії каламутна і має червоний відтінок, інтенсивність якого залежить від кількості форменних елементів крові. В осаді під мікроскопом виявляються еритроцити і лейкоцити. Гемоглобінурія спостерігається при захворюваннях, пов’язаних з гемолізом (розпадом) еритроцитів. Сеча при цьому буває червоного або кофейно-бурого кольору. У випадку гематурії і гемоглобінурії в сечі міститься білок.
Виявлення жовчних кислот (Проба Петтенкофера).
Принцип методу. Метод базується на здатності жовчних кислот давати яскраво-червоне забарвлення з оксиметилфурфуролом, який утворюється при дії концентрованої сульфатної кислоти на сахарозу.
Матеріальне забезпечення: концентрована сульфатна кислота, 10 % розчин сахарози, пробірки, піпетки.
Хід роботи: У пробірку наливають 2-3 мл сечі, додають 1-2 краплі 10 % розчину сахарози, суміш струшують. Потім обережно по стінці пробірки нашаровують 1-2 мл концентрованої сульфатної кислоти. При наявності жовчних кислот з’являється яскраво-червоне забарвлення на межі двох рідин.
За результатами проведеного експерименту зробити висновки.
Клініко-діагностичне значення.При механічній жовтяниці внаслідок закупорки загальної жовчної протоки каменем або пухлиною жовчні капіляри переповнюються жовчю. Внаслідок цього печінкові клітини стискаються і жовч проникає у кров. У цих випадках відбувається посилене виділення жовчних пігментів (білірубін, білівердин) і жовчних кислот з сечею.
Контроль виконання лабораторної роботи
1. Сеча хворого на подагру при нанесенні на індикаторний папірець „Ріфан” показує сильно кислу реакцію? Про наявність якого складника сечі це свідчить?
А. Гомогентизинової кислоти
В. Параамінобензойної кислоти
С. δ–Амінолевуленової кислоти
D. Пангамової кислоти
Е. Сечової кислоти
2. З сечею немовляти провели реакцію з FeCl3 і отримали позитивну реакцію. Яке захворювання можна припустити?
А. Фенілкетонурію
В. Тирозиноз
С. Галактоземію
D. Алкаптонурію
Е. Аміноацидурію
3. Для діагностики захворювання мутну сечу, що має лужну реакцію, підкислили і підігріли. При цьому осад зник. Чим зумовлена каламуть сечі? А. Слизом із сечовидільних шляхів В. Мікрофлорою, що розкладає сечовину з утворенням NН3Індивідуальна самостійна робота студентів
1. Патобіохімія нирок. Клініко–біохімічні зміни при гломерулонефриті, амілоїдозі, пієлонефриті, гострій та хронічній нирковій недостатності.
2. Біохімічні механізми регуляції водно-сольового обміну та роль нирок в утворенні сечі.
Література
Основна:
1. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 551 - 559.
2. Гонський Я.І., Максимчук Т.П. Біохімія людини. – Тернопіль: Укрмедкнига, 2001. – С. 588 – 592, 595 – 604.
3. Біологічна хімія. Тести та ситуаційні задачі. / За ред.проф. О.Я. Склярова. –Медицина, 2010. – 360 с.
4. Біохімічні показники в нормі і при патології. Довідник / За ред. Склярова О.Я. – Київ: Медицина, 2007. – 320 с.
5. Клінічна біохімія: Підручник / За ред. проф. Склярова О.Я. – Київ: Медицина, 2007. – 432 с.
6. Обмін вуглеводів: Біохімічні та клінічні аспекти. / Скляров О.Я., Сергієнко О.О., Фартушок Н.В. та ін. – Львів: Світ, 2004. – 113 с.
7. Практикум з біологічної хімії / За ред. О.Я. Склярова. – К.: Здоров’я, 2002. – 298 с.
Додаткова:
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 1998. – С. 608 - 624.
2. Дядик О.І. Роль дослідження сечового синдрому у клінічній практиці // Лаб. діагностика. – 2002. – № 2. – С. 61 – 68.
3. Клінічна біохімія. Навчальний посібник / За ред. проф. О.П. Тимошенко. – Київ: Професіонал, 2005. – 292 с.
Тема № 10. Дослідження біохімічних складників сполучної тканини.
Мета заняття:Знати склад і біохімічні особливості метаболізму сполучної тканини, її функціонування в нормі і при патології. Уміти кількісно визначати гідроксипролін (оксипролін) у сечі для діагностики захворювань сполучної тканини.
Актуальність теми:Однією з важливих проблем сучасної медицини є дослідження порушення метаболізму в сполучній тканині при набутих та спадкових захворюваннях, для чого необхідно володіти біохімічними тестами з метою своєчасної діагностики та правильного лікування.
Конкретні завдання:
Ø Давати морфологічну та біохімічну характеристику компонентам сполучної тканини (фібрилярні структури, основна міжклітинна речовина).
Ø Пояснювати біохімічні зміни в сполучній тканині при старінні та деяких патологічних станах (мукополісахаридозах, колагенозах).
Ø Оволодіти методом кількісного визначення гідроксипроліну та якісною реакцією виявлення глікозамінгліканів (мукополісахаридів) у сечі, давати оцінку отриманим результатам.
Теоретичні питання
1. Загальна характеристика біохімічного складу міжклітинної речовини сполучної тканини: волокна (колагенові, ретикулярні, еластичні) й основна аморфна речовина.
2. Білки волокон сполучної тканини: колагени, еластин, глікопротеїни та протеоглікани.
3. Біосинтез колагену та утворення фібрилярних структур.
4. Структура та роль складних вуглеводів основного аморфного матриксу сполучної тканини – глікозаміногліканів (мукополісахаридів). Механізми участі молекул глікозаміногліканів (гіалуронової кислоти, хондроїтин-, дерматан-, кератансульфатів, гепарину) у побудові основної речовини сполучної тканини. Розподіл різних глікозаміногліканів в органах і тканинах людини.
5. Патобіохімія сполучної тканини: біохімічні механізми виникнення мукополісахаридозів і колагенозів, їх клініко-біохімічна діагностика.
Практична робота
Дослід 1. Кількісне визначення гідроксипроліну (оксипроліну) у сечі.
Матеріальне забезпечення: реактив Ерліха, 3 н розчин сірчаної кислоти, 6 % розчин гідрогену пероксиду, 2,5 н розчин натрію гідроксиду, 0,01 М розчин… Хід роботи.У першу пробірку відміряють 1мл профільтрованої сечі, у другу – 1мл… За калібрувальним графіком визначають вміст гідроксипроліну в дослідній пробі і розраховують кількість…Контроль виконання лабораторної роботи
1. У крові та сечі жінки віком 63 роки, яка хворіє на ревматизм, підвищена концентрація оксипроліну. Що є основною причиною гіпероксипролінемії?
А. Активація пролілгідроксилази
В. Деградація колагену
С. Порушення функції нирок
D. Активація катепсинів
Е. Деградація гіалуропротеїну
2. До фібрилярний елементів сполучної тканини належать колаген, еластин і ретикулін. Вкажіть амінокислоту, яка входить тільки до складу колагену, і визначення якої в біологічних рідинах використовують для діагностики захворювань сполучної тканини?
A. Гідроксипролін
B. Гліцин
C. Фенілаланін
D. Пролін
E. Лізин
3. Пацієнт обстежується в клініці з приводу підозри на колагеноз. Цю патологію можна підтвердити за умови збільшення в крові:
A. Вмісту оксипроліну та оксилізину
B. Активності ізоферментів ЛДГ
C. Вмісту креатину та креатиніну
D. Вмісту уратів
E. Активності трансаміназ
4. У хворих на колагеноз спостерігається деструкція сполучної тканини. Які дослідження лабораторних показників крові та сечі доцільно призначити хворому з підозрою на наявність колагенозу (хронічна форма)?
A. Вмісту оксипроліну та оксилізину в крові та сечі
B. Активності ізоензимів ЛДГ крові
C. Вміст уратів в крові
D. С-реактивного білка в крові
E. Активності трансаміназ крові
5. Деякі патогенні мікроорганізми здатні руйнувати гіалуронову кислоту, виділяючи ензим гіалуронідазу. У чому полягає їх перевага перед мікробами, які не виявляють гіалуронідазної активності?
6. Пацієнт з опіковою хворобою перебуває під загрозою утворення тромбів у кровоносних судинах через посилення згортання крові. Який глікозаміноглікан можна використати, щоб запобігти утворенню тромбів?
приклади тестів “Крок – 1”
1. У хворого на цингу виявлено порушення гідроксилування проліну та лізину в складі колагену. Гальмування якого біохімічного процесу призводить до цього порушення?
A. Окиснювального фосфорилування
B. Мікросомального окиснення
C. Пероксидного окиснення ліпідів
D. Тканинного дихання
E. Субстратного фосфорилування
2. Із віком у хрящовій тканині людини знижується швидкість відновлення протеогліканів, що призводить до зменшення ступеня їх гідратації та втрати пружності тканиною. Активність яких ензимів лізосом при цьому підвищується?
А. Катепсинів, глікозидази
В. Ізомерази, дегідрогенази
С. Дезамінази, декарбоксилази
D. Карбоксилази, ліпази
Е. Оксидази, трансамінази
3. У хворого зі синдромом Слая спостерігається виділення з сечею гепарансульфату та хондроїтинсульфату. Дефіцитом якого ензиму можна це пояснити?
А. Катепсину Д
В. a-Амілази
С. Лактатдегідрогенази
D. Арилсульфатази
Е. b-Глюкуронідази
4. Підвищена ламкість судин, руйнування емалі та дентину в хворих на цингу здебільшого зумовлено порушенням дозрівання колагену. Який етап модифікації проколагену порушено при цьому авітамінозі?
А. Глікозилування гідроксилізинових залишків
В. Видалення з проколагену С-кінцевого пептиду
С. Утворення поліпептидних ланцюгів
D. Відщеплення N-кінцевого пептиду
Е. Гідроксилування проліну
Література
Основна:
1. Губський Ю.І. Біологічна хімія: Підручник. – Київ: Нова книга, 2007. – С. 596 – 619.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – С. 596 – 619 с.
3. Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. Підручник. – Тернопіль: Укрмедкнига, 2002. – С. 655 – 666.
4. Біологічна хімія: тести та ситуаційні задачі: навч. посібник. / Т.І.Бондарчук, Н.М.Гринчишин, Л.І.Кобилінська та ін.; за ред. О.Я.Склярова.– К.: ВСВ «Медицина», 2010. С. 347 – 355.
Додаткова:
1. Березов Т.Т., Коровкин Б. Ф. Биологическая химия. – М.: Медицина, 1998. – С. 661 – 679.
2. Марри Р., Греннер Д., Мейес П. Биохимия человека. – Москва: Мир. – 2004. – С. ІІ, 311 – 318, ІІ. 347 – 351.
3. Практикум з біологічної хімії. За ред. О.Я.Склярова. – К.”Здоров’я”, 2002, С.288 – 292.
4. Северин Е.С. Биохимия: учебник. – 2-е изд., испр. – М.:ГЭОТАР-МЕД, 2004. – 784 с.
Тема № 11. Підсумковий контроль. Модуль 5.
Теоретичні питання
2. Характеристика процесу травлення в шлунку: механізм активації та специфічність дії ферментів (пепсин, гастриксин, ренін). Біохімічні аспекти… 3. Механізм утворення та роль хлоридної кислоти. Кислотність шлункового соку… 4. Травлення білків у тонкій кишці: протеолітичні ферменти підшлункової залози та тонкої кишки, механізм їх…Приклади тестів та ситуаційних задач по засвоєнню практичних навичок
1. у шлунковому соку пацієнта при дослідженні виявлена молочна кислота. Для її виявлення використали... A. Бензидинову пробу B. Реакцію УффельманаЛітература
Основна:
1. Губський Ю.І.. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – 508 с.
2. Губський Ю. І. Біологічна хімія. – Київ-Вінниця: Новакнига, 2009. – 664 с.
3. Гонський Я.І., Максимчук Т.П. Біохімія людини. – Тернопіль: Укрмедкнига, 2001. – 744 с.
4. Біохімічний склад рідин організму та їх клініко-діагностичне значення // За ред. проф. Склярова О.Я., Київ: Здоров’я, 2004. – 191 с.
5. Практикум з біологічної хімії // За ред. Склярова О.Я. – Київ: Здоров’я, 2002. – 298 с.
6. Ситуаційні задачі та тести з біологічної хімії: Посібник для студентів // За ред. проф. Склярова О.Я. – Львів: Світ, 2006. – 272 с.
– Конец работы –
Используемые теги: біологічної, хімії0.051
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: З БІОЛОГІЧНОЇ ХІМІЇ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов