рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни «ХІМІЯ»
Реферат Курсовая Конспект
МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни «ХІМІЯ»
МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни «ХІМІЯ» - раздел Философия, Міністерство Освіти І Науки України Криворізький Технічний Університ...
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ
кафедра хімії
МЕТОДИЧНІ ВКАЗІВКИ
до самостійної роботи з дисципліни «ХІМІЯ»ЗМІСТ МОДУЛЯ I
1.1. Предмет хімії і основні хімічні поняття. 4 1.2. Основні закони хімічної взаємодії 6 1.3. Запитання для самоконтролю.. 11Основні хімічні поняття і стехіометричні закони
Предмет хімії і основні хімічні поняття
Згідно з атомно-молекулярним вченням об’єктом хімії є молекули й атоми. Молекула – це найменша частинка речовини, що зберігає склад і… Молекула складається із атомів, кількість яких може бути різною. Так, молекули… Однак у всіх випадках частинки, що утворюють речовину, є молекулами. Багато речовин у твердому і рідкому стані,…Основні закони хімічної взаємодії
З точки зору атомно-молекулярного вчення закон збереження маси речовин пояснюється тим, що під час хімічних реакцій загальна кількість атомів не… Закон збереження маси є основним законом хімії. Всі розрахунки за хімічним… Закон сталості складу (Ж.Л.Пруст, 1801): Співвідношення між масами елементів, що входять до складу даної…Запитання для самоконтролю
- Що вивчає наука хімія? В чому суть хімічних перетворень?
- Що таке атом, молекула, хімічний елемент, проста та складна речовини, алотропія, сталість складу речовин?
- Що таке атомна і молекулярна маси? Як вони визначаються?
- Що таке кількість речовини, моль, молярна маса?
- Що таке валентність? Як вона визначається?
- Як складають хімічні формули? Які є типи хімічних формул?
- Які розрахунки слід проводити за хімічними формулами?
- Як пояснити закон збереження маси речовин з позицій атомно-молекулярного вчення? Яке значення має цей закон?
- Чому закон Авогадро справедливий тільки для газів? Як використовують цей закон при хімічних розрахунках?
Задачі для самоконтролю
1. Які з перелічених речовин слід віднести до простих, а які - до складних: кокс, кварц, рубін, алмаз, гіпс, радон, озон, водяна пара, сажа, олеум, повітря, мельхіор, купорос, чавун?
2. Що таке валентність? Як її визначають? Визначте валентність елементів у сполуках: NH3, A12S3, Ca3P2, CO2, Mg2Si, SF6, SiC, OsO4.
3. Обчисліть масові частки елементів у сполуках: СаСО3, Н2О, КОН.
4. У скількох грамах руди, що складається з 50% Fe2O3 і пустої породи, міститься 28 г чистого заліза?
5.У зразку руди міститься 62% магнетиту Fe3O4, решта - пуста порода. Визначте вміст заліза в руді, якщо в пустій породі заліза немає.
6.Обчисліть, скільки молекул містить: а) 1 л аміаку за н.у.; б) 1 мл води за 277 К; в) 0,1 моль СО2; г) 3 г оксиду нітрогену (II).
7. Деякий газ знаходиться в закритій посудиш об'ємом 10 л за температури 273 К і тиску 106 Па. Як зміниться тиск у посудині, якщо: а) підвищити температуру на 50°С; б) зменшити кількість газу в посудині на 2 моль?
8. Стальний балон для зберігання кисню об'ємом 50 л розрахований на тиск до 1 мПа і температуру до 50°С. Скільки г кисню можнамаксимально помістити в балон, якщо зарядка проводиться при 273 К?
9.Які ви знаєте способи визначення молярної маси газоподібних речовин? Складіть власні приклади.
10.Маса 1 л газу за н.у. складає 1,964 г. Визначте молекулярну масу газу і густину його за повітрям.
11. Обчисліть молярну масу газу, 6 г якого за температури 750 К і тиску 83,1 кПа займають об'єм 7 л.
12.1 г деякого газу за нормальних умов займає об'єм 315,5 мл. Визначте молярну масу газу, його густину за воднем та масу однієї молекули в грамах. Визначте молекулярну формулу цього газу, якщо відомо, що він є простою речовиною.
13. Об'ємна частка вуглекислого газу в повітрі складає 0,03%. Визначте масу, кількість моль та кількість молекул вуглекислого газу в приміщенні об'ємом 150 м3 (н.у).
Основні класи неорганічних сполук
Хiмiчнi сполуки рiзного якiсного та кiлькiсного складу подiляють на дві великi групи: неорганiчнi сполуки та органiчнi. Складні неорганiчнi сполуки дiлять на основнi та неосновнi класи. До основних класiв неорганiчних сполук вiдносять: оксиди, основи, кислоти та солi.
Взаємозв'язок між найважливішими класами неорганічних речовин ілюструє класична схема (рис.2.1).
Оксиди
Оксиди – це складні речовини, що складаються з двох елементів один з яких оксиген(кисень) в ступені окиснення -2
У оксидах усі атоми оксигену безпосередньо зв'язані з атомами більш електропозитивних елементів, а співвідношення компонентів відповідає правилам валентності, на відміну від усіх інших сполук елементів з оксигеном (пероксидів, супероксидів, озонідів, субоксидів).
У сполуках оксигену з флуором (фтором) аніоноутворю-вачем є більш електронегативний флуор, тому, наприклад, сполуку OF2 відносять не до оксидів, а до фторидів, у яких ступінь окиснення оксигену +2.
Трапляються кисневі сполуки, якi можна вважати змішаними оксидами, або ж солями, утвореними металом та кислотою того ж металу у вищому ступені окиснення, наприклад:
Pb2O3 = PbO·PbO2 = PbPbO3 ; Fe3O4 = FeO·Fe2O3 = Fe(FeO2)2.
При написаннi структурних формул оксидiв необхiдно пам'ятати, що в оксидах, до складу яких входять кiлька атомiв одного і того ж елемента, зв'язок мiж ними здiйснюється через оксиген, наприклад: N2O3 - O=N-O-N=O.
За здатністю утворювати солі розрізняють несолетворні (N2O, NO, CO) та солетворні оксиди. Останні поділяють на кислотні (СО2, N2O5, CrO3), основні (CaO, Na2O, CrO) і амфотерні (ZnO, AI2О3, Сг2О3). В табл.1.1 наведено дані про хімічний характер оксидів залежно від ступеня окиснення елемента, а також формули відповідних гідратів оксидів.
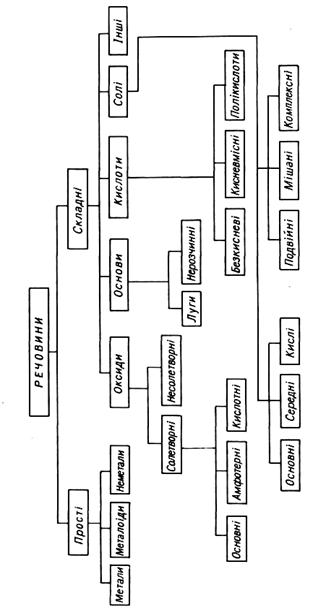
Рис.2.1. Схема взаємозв`язку між основними класами неорганічних сполук
За сучасною номенклатурою назви оксидів починаються словом "оксид", далі йде назва відповідного елемента в родовому відмінку, а якщо елемент: утворює кілька оксидів, вказують його ступінь окиснення, наприклад, Al2O3 – оксид алюмінію, FeO – оксид феруму(II), Fе2O3 – оксид феруму(ІІІ), Р2О5 – оксид фосфору(V), С12О7 – оксид хлору (VII) і т.д.
Кислотними називають оксиди, яким відповідають кислоти. Утворюють кислотні оксиди, як правило, неметали, а також метали з високим ступенем окиснення (від +5 до +8).
Таблиця 2.1.
Хімічний характер оксидів та відповідних їм форм гідратів оксидів
| Ступінь окис-нення еле- мента | Фор-мула оксиду | Формула кислоти, гідрок-сиду | Хімічний характер оксидів | ||
| Основний | Амфотерний | Кислотний | |||
| +1 | Е2О | Е(ОН) | Li, Na, K, Rb, Cs, Fr, Cu*, Ag*, Au*, Tl, Hg* | — | СІ, Вг |
| +2 | EО | Е(ОН)2 | Mg, Ca. Sr, Ba, Ra, Cd, Hg*, Eu, Sm, Yb, V, Cr, Mn, Re, Fe, Co,Ni | Be, Zn, Cu, Ge, Sn, Pb | — |
| +3 | Е2О3 | Е(ОН)3 ЕО(ОН) | Y, La, Ac, Tl, Ce. Gd, Yb, Am, Cm, Bk, Cf, Es, Bi, V, Mn, Re | Au, Al, Ga, In, Sc, Sb, Cr, Fe, Ni, Co, Ir, Rh | В, N, Р, As |
| +4 | EО2 | Е(ОН)4 ЕО(ОН)2 | Th, U, Pu, Am, Cm, Np | Ce, Ge, Sn, Pb, Ті, Zr, V, Mn | С, Si, S, Se, Те |
| +5 | Е2О5 | Е(ОН)5 ЕО(ОН)3 ЕО2(ОН) | Pa, Np, Pu | Nb, Та | N, Р, V, As, Sb |
| +6 | ЕО3 | ЕО2(ОН)2 | — | U, Np, Pu, Am | S, Se, Те, Сг, Мо, W, Mn*, Re, Fe*, Xe |
| +7 | Е2О7 | ЕО3(ОН) | — | — | СІ, І, Mn, Re |
| +8 | EО4 | ЕО2(ОН)4 | — | — | Os, Ru, Xe |
*) елементи, для яких гідрати оксидів у вільному стані не добуто
При взаємодії з основами та основними оксидами кислотні оксиди утворюють солі, причому кислотний оксид входить до кислотного залишку:
СО2 + 2NaOH = Na2CO3 + Н2О; SiO2 + СаО = СаSiO3
СгО3 + 2КОН = К2СrO4 + Н2О ; N2O5 + Na2О = 2NaN03
Р205+ ЗСа(ОН)2 = Са3(Р04)2+ ЗН2О; Mn2O7 + ВаО = Ba(MnO4)2
Більшість кислотних оксидів реагують з водою, утворюючи кислоти:
SO3 + H2O = H2S04; N205 + Н20 = 2HN03 ,
але є оксиди, які з водою безпосередньо не взаємодіють (SiO2, MoO3). Їм відповідають нерозчинні у воді кислоти (H2SiO3, H2MoO4), які можна добути з відповідних солей реакціями обміну.
Якщо будь-яким способом від кислоти відняти воду, лишиться кислотний оксид. Тому кислотні оксиди ще називають ангідридами кислот (зневоднена кислота). На практиці, щоб знати, який ангідрид відповідає тій чи іншій кисневій кислоті, треба подумки відняти від кислоти воду до повного вилучення атомів гідрогену. Якщо ж до оксиду додати воду, знайдемо формулу кислоти, яка йому відповідає. Наприклад, кислотам H2SeO4, H3PO4, НСІО4, Н3ВО3, відповідають ангідриди SeO3, P2O5, C12O7, B2O3, a оксидам SO2, N2O3, V2O5, C12O, CrO3, Мп,О7, відповідають кислоти H2SO3, HNO2, HVO3, HC1O, H2CrO4, HMnO4.
Основним оксидам відповідають основи. Утворюють їх метали з низьким ступенем окиснення +1 або +2. Реагуючи з кислотами і кислотними оксидами, основні оксиди утворюють солі:
СuO + 2HNO3 = Сu(NО3)2, Ag2O + СгО3 = Ag2CrO4
З водою основні оксиди, як правило, не реагують, за винятком оксидів самих активних металів - лужних і лужноземельних:
Li2O + Н2О = 2LiOH BaO + H2O = Ba(OH)2
Амфотерні оксиди мають властивості як основних, так і кислотних оксидів. Це залежить від того, з чим даний амфотерний оксид реагує - з кислотою (кислотним оксидом) чи з лугом (основним оксидом). Амфотерні оксиди утворюють теж лише метали, але із ступенем окиснення +3, +4, (іноді +2): BeO, ZnO, АІ2О3, SnО2 та інш.
При вивченні хімічних властивостей амфотерних оксидів інколи труднощі викликають рівняння реакцій взаємодії їх з лугами та основними оксидами. Слід пам'ятати, що обов'зковим продуктом таких реакцій є сіль, а оскільки амфотерний оксид виступає при цьому в ролі кислотного, він входить до кислотного залишку солі. Щоб визначити склад кислотного залишку, треба, як уже говорилося, подумки додати до оксиду воду (насправді, амфотерні оксиди з водою не реагують) і встановити, яка кислотна форма відповідає даному оксиду. Так, оксиду ZnO відповідає кислотна форма H2ZnО2, у оксиду А12О3 є дві кислотні форми: НА1О2 і Н3А1О3, оксиду SnO2 відповідає кислота Н2SnO3 і т. д.
А12О3+ 2NaOH  2NaAlO2+ Н2О; ZnO + ВаО
2NaAlO2+ Н2О; ZnO + ВаО  BaZnO2
BaZnO2
Al2O3 + 6NаОН  2Nа3АlOз+ЗН2О; SnO2+K2O
2Nа3АlOз+ЗН2О; SnO2+K2O K2SnO3
K2SnO3
З кислотами та кислотними оксидами амфотерні оксиди реагують як основні:
ZnО + 2НСІ = ZnCl2 + Н2О; А12О3+3SO3 Al2(SO4)3
Al2(SO4)3
Таким чином, аналізуючи рівняння реакцій за участю оксидів приходимо до висновку, що між собою реагують оксиди, наділені протилежними функціями - кислотною і основною. Внаслідок реакції утворюється тільки сіль. При взаємодії оксидів з кислотою чи основою обов'язковими продуктами реакцій є сіль і вода.
Є кілька загальних способів добування оксидів, які широко застосовуються на практиці:
1) найпростіше оксид добути при взаємодії двох простих речовин за реакцією сполучення, але так можна одержати далеко не всі оксиди:
4Al + 3O2 = 2Al2O3 2Mg + O2 = 2MgO
4P + 5O2 = 2P2O5 S + O2  SO2
SO2
2) розклад складних кисневмісних речовин при нагріванні: H2SiO3 SiO2+H2O NH4NO3
SiO2+H2O NH4NO3 N20+2Н20
N20+2Н20
2Аu(ОН)3  Аu2О3 + ЗН2О СаСОз
Аu2О3 + ЗН2О СаСОз  СаО + СО2
СаО + СО2
Cu(ОН)2  СuО + Н2О 4HNО2
СuО + Н2О 4HNО2  2HNО3 +NO+ Н2О
2HNО3 +NO+ Н2О
3) горіння (окиснення) складних речовин у присутності кисню:
4NH3+502  4NO+6H20; СН4+202
4NO+6H20; СН4+202 С02 +2Н20
С02 +2Н20
2ZnS+302 2ZnO+2S02 ; 2NO2 +O3
2ZnO+2S02 ; 2NO2 +O3  N2О5 + O2
N2О5 + O2
г) з інших оксидів:
N02 +N0 = N2O3 ; Fе2О3 + C0 2FеО+C02
2FеО+C02
Гідрати оксидів
Основи
За теорією електролітичної дисоціації Арреніуса дооснов належать сполуки, які складаються з катіонів (металів, амонію) і гідроксогруп ОН-, здатних заміщуватись на кислотний залишок, для їх назви ще часто використовують загальний термінгідроксиди: NaOH - гідроксид натрію, NH4OH- гідроксид амонію, Fe(OH)2 - гідроксид феруму (II), Fe(OH)3 - гідроксид феруму (III) і т.д. Основи ділять на розчинні у воді або луги (гідроксиди найбільш активних металів - лужних та лужноземельних) і практично нерозчинні - гідроксиди інших металів.
Носієм основних властивостей у водних розчинах є гідроксильні групи ОН-, які утворюються в процесі розчинення і електролітичної дисоціації вказаних сполук і зумовлюють мильні на дотик властивості розчину, забарвлення індикаторів і характерні хімічні властивості. Завдяки йонному зв'язку розчинні у воді гідроксиди металів (луги) практично повністю дисоціюють на йони і мають високу хімічну активність. Нерозчинні гідроксиди надсилають луже мало ионів ОН-у розчин і тому в хімічному відношенні досить інертні.
Всі без винятку основи взаємодіють з кислотами (реакція нейтралізації), внаслідок чого утворюються сіль і вода:
2NaOH + Н2SiОз = Na2Si03 + 2Н2О
Cu(OH)2 + 2НNО3= Cu(N03)2 + 2Н2О
Крім того, луги взаємодіють з оксидами (кислотними і амфотерними):
Ва(ОН)2 + СО2 = ВаСО3 + Н2О
2КОН+Сr2О3 =2КСrО2 + Н2О
солями, витискуючи нерозчинні у воді й газоподібні продукти:
2NaOH+CuS04=Na2SO4+Cu(OH)2↓
Ba(OH)2+Na2SО4=2NaOH+BaS04↓
Ca(OH)2+2NH4Cl =СаС12+2Н20+2NНз↑
Більшість основ, крім гідроксидів лужних металів, при нагріванні розкладаються на відповідний оксид і воду:
2А1(ОН)3  АІ2О3 + ЗН2О; Са(ОН)2
АІ2О3 + ЗН2О; Са(ОН)2 СаО + Н2О
СаО + Н2О
Луги добувають при взаємодії металу або його оксиду з водою, а також з солей шляхом обмінних реакцій з іншими лугами:
2Li +2Н2О = 2LiOH + Н2; СаО+Н20=Са(ОН)2
К2СО3 +Са(ОН)2 = 2КОН + СаСО3
Основи, які мають промислове значення (NaOH, KOH), одержують у великих масштабах електролізом водних розчинів їх солей:
2NaCl+2H20  2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
катод анод
Амфотерні гідроксиди
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H20, якщо ж до нього додавати луг, проявляється кислотна функція, і метал. що… Сг(ОН)3 + NaOH= Na[Cr(OH)4] - у водному розчині,Кислоти
Назви безкисневих кислот походять від назв елементів, що їх утворюють, або від міжнародних назв кислотних залишків з закінченням-на: НС1 -… Згідно з правилами IUPAC назви кисневих кислот також походять під міжнародних… - хлорна - сірчана - ванадієваСолі
Солі визначають або як продукт заміщення атомів гідрогену кислоти на метал, або як продукт нейтралізації кислоти основою. Як правило, це йонні сполуки, які при розчиненні у воді легко дисоціюють на катіони (металу, амонію) і аніони кислотного залишку. Розрізняють солі середні, кислі, основні, комплексні та деякі інші.
Середні солі - це продукт повної нейтралізації кислоти основою:
Н3РО4 + 3NaOH = Na3PO4 + ЗН2О
Кислі солі - продукт неповної нейтралізації багатоосновної кислоти основою:
Н3Р04 +2NaOH=Na2HP04 +2Н2О
H3P04+NaOH=NaH2P04 + H20
Основні солі - продукт неповної нейтралізації багатокислотної основи кислотою:
Mg(OH)2 + HCl = MgOHCl + H20
Комплексні солі - численний клас сполук, до складу яких входять комплексні йони, утворені за донорно-акцепторним механізмом зв'язку:
Na[Al(OH)4]; K3[Fe(CN)6]; [Cu(NH3)4]SO4
Номенклатура солей включає назви катіона і кислотного залишку. Спочатку називають кислотний залишок, причому слід давати його міжнародну назву, а потім катіон в родовому відмінку із ступенем окиснення в разі потреби:
АІСІ3 -хлорид алюмінію Са3(РО4)2 - ортофосфат кальцію
Na2S - сульфід натрію NaPO3 - метафосфат натрію
Li2SO3 - сульфіт літію Ва(АІО2)2 - метаалюмінат барію
FeSO4 -сульфатферуму(ІІ) КMnО4 - манганат(VІІ) калію
Cr(NO3)3-нітрат хрому (III) Ag2CrO4 - хромат аргентуму
NH4NO2 -нітрит амонію К[АІ(ОН)4] - тетрагідроксоалюмінат калію
В кислих солях до назви кислотного залишку включають початок найменування гідрогену - "гідро", а в основних - назву гідроксильної групи "гідроксо":
Mg(HCO3)2 - гідрокарбонат магнію КН2РО4- дигідрофосфат калію
(СиОН)2СО3-гідроксокарбонат міді(II); АІ(ОН)2СІ–дигідроксохлорид алюмінію
Найважливіші реакції утворення солей були розглянуті при вивченні оксидів, кислот і основ. Перегляньте ще раз цей матеріал і випишіть рівняння відповідних реакцій. Допоможе вам в цьому й схема генетичного зв'язку між класами неорганічних сполук (рис.2.2).
З хімічних властивостей найбільш характерні реакції взаємодії солей з металами і неметалами, кислотами і лугами, з водою та іншими солями, а також розклад солей при нагріванні:
1) Fe + CuSO4 = FeSO4 + Cu
2AgNO3+Cu=Cu(N03)2 + 2Ag
2) 2KBr + CI2 = 2KCI + Br2
2KI + Br2 = 2KBr + H2

Рис.2.2. Генетичний зв'язок між класами неорганічних сполук
3) Na2CO3 + 2СН3СООН =2CH3COONa + H2O + CO2
Ca3(P04)2 + 2H2S04 = 2CaS04 + Ca(HzPO4)2
4) K2CO3 + Ba(OH)2 = BaCO3↓ + 2KOH
FeCl3 + 3KOH = 3KC1 + Fe(OH)3
5) Pb(NO3)2 + K2S = 2KNO3 + PbS↓
AgNO3 + KI = KNO3 +AgI↓
6) 2NaHCO3  Na2CO3 + H2O + CO2
Na2CO3 + H2O + CO2
4KC1O3  KC1 + 3KC1O4
KC1 + 3KC1O4
7) CuSO4 + 5H2O = CuSO4·5H2O - утворення кристалогідратів
8) K2SO3 + H2O ↔ KHSO3 + KOH - гідроліз
ZnCl2 + H2O ↔ ZnOHCl + HCl
CH3COONH4 + H2O ↔CH3COOH + NH4OH
Запитання для самоконтролю
1. Який існує взаємозв'язок між найважливішими класами неорганічних сполук?
2. Як поділяють сполуки з оксигеном за складом і властивостями?
3. Що таке оксиди? Які бувають оксиди? Їх номенклатура.
4. Які хімічні властивості характерні для солетворних оксидів?
5. Які найбільш розповсюджені способи добування оксидів?
6. Що таке гідроксиди? Як їх розрізняють за складом і властивостями?
7. Дати визначення понять основи, кислоти та солі.
8. Що таке луги? З чим взаємодіють луги і як їх добувають?
9. Що характерно для амфотерних гідроксидів?
10. Що таке кислоти? Їх номенклатура і графічні формули.
11. Які загальні властивості і способи добування характерні для кислот?
12. Які бувають солі за складом і властивостями?
13. Які найважливіші реакції солетворення? Які хімічні властивості характерні для солей?
Задачі для самоконтролю
1. Дайте назви і вкажіть хімічний характер оксидів: Cs2O; SiO2; MnO; MnO2; Mn2O7; N2O; N2O3; N2O5; C12O; C12O7. Які з цих оксидів реагують з водою? Складіть рівняння відповідних реакцій.
2. 3 якими із вказаних речовин реагують оксиди натрію та силіцію(IV): HNO3; H2O; P2O5; Ba(OH)2; CuSO4; MgO? Наведіть рівняння відповідних реакцій.
3. Які з наведених оксидів попарно реагують один з одним: АІ2О3; СаО; SO3; Li2O; SiO2? Складіть рівняння відповідних реакцій.
4. Наведіть назви і графічні формули кислот: НАІО2; НВО2; Н3ВО3; НМпО4; НРО3; Н3РО3; Н3РО4. Напишіть формули ангідридів цих кислот.
5. Як дисоціює при розчиненні у воді та які має хімічні властивості ортофосфатна (фосфорна) кислота? Наведіть рівняння реакцій.
6. 3 якими із вказаних речовин буде взаємодіяти розведена сірчана (сульфатна) кислота: Cu; CuO; FeS; FeO; Fe; Fe(OH)3; SiO2; SnO2; BaCl2; CaCO3? Складіть рівняння відповідних реакцій.
7. Скільки осаду утвориться при взаємодії 4,9 г сірчаної (сульфатної) кислоти і 10,4 г хлориду барію? (Відповідь: 11,65 г).
8. З якими із зазначених речовин взаємодіє гідроксид калію: FeO, CuSO4; Al(OH)3; P2O5; H2SiO3; FeI2? Наведіть рівняння реакцій.
9. Напишіть рівняння реакцій термічного розкладу таких сполук: Cu(OH)2; BaC03; LiOH; Ca(HCO3)2; H3BO3; NH4Cl; H2SiO3; (NH4)2CO3.
10. На прикладі гідроксиду алюмінію продемонструйте способи добування і хімічні властивості амфотерних гідроксидів.
11. Наведіть назви солей та рівняння електролітичної дисоціації при розчиненні їх у воді: FeCl3; KH2PO4; A12(SO4)3; K3[A1(OH)6]; MgOHCl; (NH4)2Cr04. ,
І2. Запишіть формули солей, виразивши їх через формули оксидів, за допомогою яких вони утворені:
CaCO3; Mg3(P04)2; NaC104 Ва(С1О)2; Zn(NO2)2; Na2ZnO2; KA1O2; LiHSO4; K3A103; Са(Н2РО4)2; AlOHSO4; К2Сг2О7.
13. Складіть рівняння реакцій нейтралізації, внаслідок яких можна одержати солі:
CuSO4; Са3(Р04)2; Cr(NO3)3; К2СгО4; ВаНРО4; КMnО4; КСІО.
14. Наведіть можливі способи добування і хімічні властивості: а) хлориду натрію; б) карбонату кальцію; в) сульфату барію.
15. В розчин CuSO4 занурили залізну пластинку масою 10 г. Скільки міді виділилося з розчину, якщо маса пластинки збільшилась до 10,8 г? (Відповідь: 6,4 г).
16. Користуючись схемою генетичного зв'язку між класами неорганічних сполук (рис. 1.2), складіть рівняння реакцій можливих перетворень, взявши за вихідні такі речовини: SO3; A1(OH)3; ZnO; KOH; SiO2; HC1; СаО.
17.Складіть рівняння реакцій для здійснення таких перетворень:
а) Ва → Ва(ОН)2 → ВаСІ2 → Ba(NO3)2 → BaSO4 → Ba(HSO4)2;
б) Zn → ZnO → Na2Zn02 → ZnCl2 → Zn(OH)2 → K2[Zn(OH)4];
в) P → P205 → H3P04 → Ca(H2P04)2 → CaC03 → Ca(HCO3)2;
г) Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3.
Назвіть всі речовини.
Будова атома. Періодичний закон Д.І.Менделєєва
Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
Основна маса атома зосереджена в ядрі і характеризується масовим числом А, яке дорівнює сумі чисел протонів (тобто заряду ядра) Z і нейтронів N: … A = Z + N Таблиця 3.1.Квантові числа
Головне квантове число - 1, 2, 3, 4, 5, 6, 7... Енергетичні рівні – K, L, M, N, O, P, Q... Максимальна кількість енергетичних рівнів, яку може мати атом в основному стані, відповідає номеру періоду, в якому…Розподіл електронів в атомі, електронні й електронно-графічні формули елементів
Згідно з принципом найменшої енергії найстійкішому стану електрона в атомі відповідає найменша енергія. Тому електрони розміщуються в першу чергу на… Послідовність заповнення атомних орбіталей залежно від значення головного та…S 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
Таблиця читається по рядках зверху донизу, кожен рядок читається зліва направо.Періодичний закон та періодична система елементів Д.І.Менделєєва
Періодичний закон формулюється так: Властивості елементів, а також форми і властивості сполук елементів перебувають у періодичній залежності від… Графічним зображенням цього закону є періодична система, що поділена на… Перший період вміщує 2 елементи (1s2); другий і третій – по 8 (ns2np6); четвертий і п’ятий – по 18 (ns2np6(n-1)d10);…Радіуси атомів та йонів елементів
Зміна радіусів атомів елементів у періодичній системі має періодичний характер (див. рис. 3.4, а): · у періодах зліва направо |—»| у міру збільшення зарядів ядер (тобто… · у групах зверху донизу |↓| заряди ядер атомів зростають стрибкоподібно, але одночасно збільшується і число…Закономірності зміни енергетичних характеристик елементів.
Хімічна активність елемента визначається здатністю його атомів відщеплювати чи приєднувати електрони. Кількісно ця здатність атомів елементів оцінюється за допомогою двох енергетичних характеристик: 1) енергії (потенціалу) йонізації; 2) енергії спорідненості до електрона.
Енергія йонізації
Аналізуючи данні рис.3.4,б, можна зробити відповідні висновки. • У групах елементів зверху вниз зі зростанням радіусів атомів зменшується… • У періодах елементів зліва направо |—»| у міру зменшення радіусів атомів і водночас зростання ступеня заповнення…Енергія спорідненості до електрона
Характер зміни значень Eсп в групах і періодах системи елементів наведено в табл. 3.2. Таблиця 3.2. Енергія спорідненості до електрона атомів деяких елементів. Символ Електронна формула Eсп,…Електронегативність атомів
Фізичну суть електронегативності æ можна уявити як питому густину валентних електронів, тобто як електронну густину, яка припадає на одиницю… Зауважимо, що хімічні елементи за своєю природою двоїсті, тому поділ їх на… Такою характеристикою запропоновано вважати енергію, яка є сумою енергії йонізації I1 та енергії спорідненості до…Запитання для самоконтролю
1.Назвіть хоча б одне експериментальне підтвердження хвильової природи електрона. Хто з учених вперше висловив ідею про двоїсту природу електрона?
2.Стан кожного електрона в атомі характеризується чотирма квантовими числами — назвіть і вкажіть фізичний зміст кожного з них.
3.Відомі чотири стабільні ізотопи Барію з масовими числами 135, 136, 137 і 138. Яке число протонів і нейтронів у ядрах кожного з нуклідів?
4.Назвіть ізотопи елемента, масові числа яких відрізняються у півтора і більше раза.
5.Який атомний номер і приблизна атомна маса елемента, ядро якого складається з 81 протона і 122 нейтронів? Напишіть повне позначення цього нукліда, вказавши хімічний символ, атомний номер і масове число.
6.Запишіть значення усіх квантових чисел для двох електронів, що містяться на 4s-орбіталі.
10.Напишіть набори усіх чотирьох квантових чисел для кожного з електронів, що містяться на Зр-орбіталях.
11.Поясніть, чому в періодичній системі елементів Аг, Co Те, Th, U розміщені відповідно перед К, Ni, I, Pa, Np, хоча і мають більшу відносну атомну масу.
12.Беручи до уваги правила квантування, виведіть формулу, що виражає місткість енергетичного електронного шару.
13.Яка максимальна кількість електронів може міститися в атомі на енергетичному рівні з п = 4?
14. Що таке ізотопи, ізобари, ізотони?
15.Чому не можна одночасно точно визначити координати електрона та його швидкість?
16.Скільки є значень магнітного квантового числа для енергетичного підрівня, що характеризується значенням орбітального квантового числа l= 2?
17.Вкажіть максимальну кількість електронів, які можуть міститись в атомі на енергетичному рівні з п = 3.
18.У якого елемента починається заповнення 5s-підрівня?
19.Яким є максимальне значення головного квантового числа n для елементів періодичної системи? Що характеризує головне квантове число?
20.Якими літерами позначають енергетичні рівні, що мають головне квантове число від 1 до 7?
21.Який фізичний зміст квадрата хвильової функції[Ψ]2?
22. Якими квантовими числами визначається енергія електрона в атомі?
23.Які значення орбітального квантового числа можливі для енергетичного рівня N (n= 4)?
24.Скільки орбіталей міститься на енергетичному підрівні l=3?
25.Яких значень може набувати магнітне квантове число для l = 2?
26.Яке обмеження накладає принцип Паулі на значення квантових чисел електронів у атомі?
27.У чому суть правил Клечковського? Проаналізуйте відносну енергію Зр-, 3d-, 4s- та 4р-орбіталей.
28. Які електронні орбіталі мають однакове значення суми (n + l) = 6? Яка послідовність зростання їх енергії?
29.Скільки неспарених електронів у збудженого атома хлору?
30.Запишіть електронну формулу атома купруму. Підкресліть валентні електрони. До якої родини елементів він належить?
31.Яке число атомних орбіталей міститься на електронних підрівнях атома: s-,p-, d-, f-; яке максимальне число електронів можуть містити: а) кожна АО; б) кожний підрівень?
32.У елементів якого періоду електрони валентного рівня характеризуються значеннями суми квантових чисел n + l = 5?
33.Вкажіть порядкові номери і назви елементів в яких: а) закінчується заповнення електронами орбіталей 4s ; б) починається заповнення підрівня 4p ; Як змінюється значення суми (n + l) для цих елементів?
34.Що таке період у періодичній системі елементів? Які є періоди?
34.Що таке група у періодичній системі елементів? Які є групи?
35.Які родини елементів розрізняють у періодичній системі на підставі уявлень про енергетичні підрівні? Назвіть місткість кожної родини.
Задачі для самоконтролю
1. Обчисліть довжину хвилі де Бройля, яка відповідає електрону з масою 9,1 • 10-31 кг, що рухається зі швидкістю 6,5 • 106 м/с.
2. Розрахуйте швидкість, з якою повинна рухатися α-частинка масою
6,64 • 10-27 кг, якщо їй відповідає довжина хвилі де Бройля λ = 1,42 • 10-3 нм (1нм = 10-9 м).
3. Обчисліть середню відносну атомну масу елемента Силіцію, знаючи, що у природних сполуках він трапляється з таким ізотопним складом: 92,28% (за масою) 28Si, 4,67% 29Si і 3,05% 30Si.
4.Складіть електронні та електронно-графічні формули валентних рівнів атомів елементів з порядковими номерами 42 і 52. До яких сімейств вони належать?
5.Які атомні орбіталі заповнюються електронами раніше: 4d- чи 5s-; 6s- чи 5p-? Складіть електронну формулу валентного рівня атома з порядковим номером 44.
6.Які з наведених електронних формул, що відтворюють будову незбуджених атомів певних елементів, неправильні: a)1s22s22p53s1; б) Is22s22р63s2; в)Is22s22р63s23р63d4; r)Is22s22р63s23р64s2; д) Is22s22р63s23d2? Чому? Атомам яких елементів відповідають правильно складені формули?
7.Складіть електронні формули йонів елементів: a) Sn2+; б) Sn4+; в) Mg2+; г)Си2+; д) Сl-; е) S2- .
8.На основі електронних формул валентних рівнів атомів Хрому і Селену визначте їх можливі ступені окиснення в сполуках. Складіть формули їх типових сполук (оксидів, гідроксидів, гідрогенових сполук, солей).
9.Виходячи з положення металу в періодичній системі, дайте мотивовану відповідь на запитання, який з двох гідроксидів є сильнішою основою:
Ca(OH)2 чи Fe(OH)2; Cd(OH)2 чи Sr(OH)2 ?
10.Які найнижчі ступені окиснення виявляють неметали: Хлор, Сульфур, Нітроген і Карбон? Чому? Як розрахувати ці ступені окиснення? Складіть формули сполук цих елементів з Гідрогеном і Алюмінієм, назвіть їх.
Хімічний зв’язок. Кристалічний стан речовин
Основні типи хімічного зв’язку. Ковалентний зв’язок
Серед індивідуальних хімічних речовин, що поділяються на прості та складні, простих порівняно небагато. Але й серед простих речовин тільки… Молекули хімічних речовин утворюються із атомів за рахунок хімічного зв’язку,… Хімічний зв’язок, утворений спільними електронними парами, називається ковалентним. Ковалентний зв’язок здатний до…Іонний зв'язок
Характерною ознакою іонного зв’язку є його ненасиченість і ненапрямленість у просторі. Іони можна розглядати як заряджені кульки, силові поля яких… Оцінку типу хімічного зв’язку в сполуках можна зробити на підставі значень…Металічний зв'язок
Металічний зв’язок характерний для металів, що на зовнішніх оболонках мають вакантні орбіталі. При об’єднанні атомів у кристали ці орбіталі перекриваються таким чином, що між атомами утворюються зони, по яких вільно можуть рухатися електрони. Валентні електрони в кристалі металу вільно рухаються по всьому об’єму кристала. Отже, металічний зв’язок делокалізований. Цим і пояснюється висока електро- і теплопровідність, а також ковкість та інші властивості металів. Металічний зв'язок характерний для металів у твердому і рідкому станах. Однак, у пароподібному стані атоми металів, як і всіх речовин, сполучені між собою ковалентними зв’язками.
Водневий зв'язок
Водневий зв’язок особливо характерний для молекул води. Рідкий стан води обумовлений здатністю її молекул сполучатися…Міжмолекулярна взаємодія
Орієнтаційна взаємодія виявляється між полярними молекулами. При зближенні вони орієнтуються таким чином, що різнойменно заряджені кінці їх диполів… Індукційна взаємодія. Якщо зустрічаються полярні й неполярні молекули, то… При взаємодії двох полярних молекул у них під дією власних електричних полів виникають додатково індуковані диполі.…Тверді тіла. Типи кристалічних граток
Для кристалічного стану характерна анізотропія властивостей кристалу (міцність, електро- і теплопровідність, оптичні властивості тощо) у різних… Типи кристалічних граток. Залежно від природи частинок, що містяться у вузлах… Приклади речовин з різним типом кристалічних граток:Запитання та задачі для самоконтролю
1. Що таке ковалентний зв'язок і чим зумовлено його утворення?
2. На чому грунтується метод ВЗ?
3. Які механізми утворення ковалентного зв'язку розрізняють у методі ВЗ?
4. Що розуміють під насичуваністю та напрямленістю ковалентного зв'язку?
5. Як виникають σ-, π- і δ-зв'язки і електрони яких орбіталей можуть брати участь у їх утворенні?
6. Сформулювати поняття про σ - і π -зв'язування. Що таке кратні зв'язки? Охарактеризувати причину напрямленості σ -зв'язків і причину відсутності напрямленості у π -зв'язків.
7. Що розуміють під гібридизацією атомних орбіталей і з чим вона пов'язана?
8. Яким геометричним формам відповідають частинки з sp-, sp2 -, sp3-гібридизацією орбіталей центрального атома?
9. Накреслити орбітальну діаграму молекули Н2О, користуючись s- і р-орбіталями; використовуючи гібридні sp -орбіталі.
10. Вказати усі можливі валентності для Нітрогену, Сульфуру, Хлору.
11. Електронна формула має закінчення 3d54s2. Визначте порядковий номер цього елементу.
- Складіть електронні схеми будови молекул N2, Н2, НС1.
- Що називають кратністю зв'язку? Чому вона дорівнює, якщо від двох взаємодіючих атомів в її утворенні брало участь:
а) 2е; б) 4е; в) 6е? Наведіть відповідні приклади.
- У якій сполуці найбільше виражена полярність зв'язку: H2S; СН4; РН3; НС1; NH3; H2O?
- Наведіть приклади, коли атоми одного й того самого елемента утворюють різні види хімічного зв'язку: йонний, ковалентний полярний і ковалентний неполярний.
- Чи може довжина зв'язку дорівнювати сумі радіусів двох атомів, які її утворюють? Покажіть і поясніть на прикладі молекули Н2, знаючи, що г(Н) = 0,053 нм, а d(H - Н)= 0,074 нм.
- Які типи зв'язків є у таких молекулах: NaF, Li2O, К2С03, Н20, Вг2.
- У якій із наведених нижче сполук зв'язок найбільше і найменше полярний: NaJ, NaBr, CsJ?
- Чому Кальцій не виявляє валентності 3, а Фосфор -6, Нітроген - 5?
- Чому кут Н-О-Н в молекулі води дорівнює 107°, а не 90?
- Зобразіть перекривання електронних орбіталей у молекулах: a) F2; б) HF; в) H2S; г) РН3.
- Кути між зв'язками у молекулах типу СХ4 і ВХ3 становлять відповідно 109,5° і 120°. Що можна сказати про геометрію таких молекул?
- Яким має бути кут між зв'язками у молекулі води, якщо врахувати, що валентні орбіталі центрального атома Оксигену гібридизовані і за яким типом?
- Який тип гібридизації атомних орбіталей Нітрогену в молекулі NH3? Яка структура молекули і кут між зв'язками?
- В основному чи збудженому стані перебувають атоми Фосфору, Сульфуру і Арсену під час утворення молекул РС13 і РС15, H2S і SO2, AsH3 і H3AsO4?
26. Які умови необхідні для виникнення водневого зв’язку?
27. Які речовини здатні утворювати водневі зв’язки?
28. Як впливає водневий зв'язок на температуру кипіння рідин і на властивості льоду?
29. Які види взаємодії можуть виявлятися між молекулами і від яких факторів вони залежать?
30. Охарактеризувати диполь-дипольну взаємодію.
31. Які особливості дисперсійних сил взаємодії між частинками?
32. Назвати найхарактерніші ознаки твердих тіл.
33. У чому полягає відмінність між кристалічними і аморфними тілами.
34. Дати визначення анізотропності кристала.
35. Назвати типи кристалічних граток і навести приклади речовин до кожного з них.
36. У чому полягає принципова відмінність властивостей іонного та ковалентного зв’язку?
37. Які особливості металічного зв’язку порівняно з іншими типами хімічного зв’язку?
Основи хімічної термодинаміки
Основні термодинамічні поняття
Термодинаміка базується на трьох основних законах. Перший закон описує процеси перетворення енергії; другий дозволяє робити висновок про напрямок… У хімічній термодинаміці користуються так званими термодинамічними функціями… Термодинамічна система - це тіло або сукупність тіл, які перебувають у взаємодії та відокремлені від навколишнього…Термохімія.
Усі термохімічні розрахунки базуються на двох законах термохімії. Перший закон термохімії – закон Лавуазьє і Лапласа (1760) формулюється так:… Наприклад, при утворенні 1 моль води із водню і кисню виділяться 241,8 кДж/моль.Теплота нейтралізації.
При взаємодії 1моль еквівалента сильної кислоти з 1моль еквівалента сильного гідроксиду в розведених водних розчинах виділяється майже однакова… = -55,9 кДж/моль (при 298 К). Розглянемо для прикладу реакцію нейтралізації сильної кислоти сильною основою (лугом):Напрям перебігу хімічних процесів.
Згідно з Клаузісом теплота завжди переходить від більш нагрітого тіла до менш нагрітого. Другий закон термодинаміки можна сформулювати ще й так: в ізольованих системах… Ентропія S – це функція стану системи. Вона характеризує міру невпорядкованості стану системи.Питання для самоконтролю
1. Який зв'язок існує між внутрішньою енергією та ентальпією системи?
2. Яким чином робота газу, що розширюється, пов'язана з тиском, об'ємом і температурою?
3. Чим відрізняються функції стану від інших функцій? У чому полягають зручності користування ними?
4. Чи належать тепло та робота до функцій стану?
5. У чому полягає перший закон термодинаміки, які функції стану згадуються в ньому?
6. Тепловий ефект реакції можна виразити через величини ΔU і ΔН. У чому різниця між ними? Написати рівняння зв'язку ΔU і ΔН.
7. Чим термохімічні рівняння відрізняються від хімічних?
8. Який зміст законів термохімії?
9. Чому закон Гесса є законом збереження енергії стосовно хімічних процесів?
10. Що являє собою стандартна теплота (ентальпія) утворення сполуки?
11. Дати визначення понять: ентальпії розчинення, згоряння, нейтралізації.
12. Чому ентальпія нейтралізації всіх сильних кислот і основ однакова (-55,8 кДж/моль), а слабких кислот і основ — залежить від їхньої природи?
13. Який зміст другого закону термодинаміки.
14. Охарактеризуйте фактори, що впливають на перебіг хімічних реакцій.
Задачі і вправи для самостійної роботи
2.Обчислити стандартну ентальпію утворення бензолу, якщо теплота його згоряння становить 3169 кДж/моль, а ентальпія утворення вуглекислого газу та… 3. За стандартних умов теплота повного бромування білого фосфору дорівнює… 4. Теплота згоряння ромбічної сірки дорівнює -296,8 кДж/моль. Розрахуйте: а) кількість теплоти, яка виділиться в…Хімічна кінетика і рівновага
Загальні уявлення про швидкість хімічних реакцій
Розділ хімії, який вивчає перебіг хімічних процесів за певний час, має назву хімічної кінетики.
характеризується значним зменшенням ізобарного потенціалу, тобто є можливість самовільного перебігу процесу, за звичайних умов водень і кисень між… Розглядаючи питання хімічної кінетики, треба розрізняти гомогенні і… Швидкість хімічних реакцій характеризує інтенсивність хімічного процесу, тобто число елементарних актів взаємодії або…Для гомогенних процесів, що відбуваються без зміни об'єму, швидкість хімічної реакції визначають як зміну концентрацій реагуючих речовин або продуктів реакції за одиницю часу.
Зміна концентрацій дорівнює різниці між концентрацією С2, що відповідає моменту часу τ2, і початковою концентрацією С1 в момент часу τ1. Тоді середня швидкість реакції дорівнює:
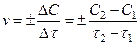 (6.1)
(6.1)
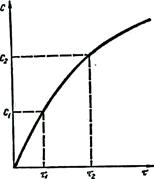
Чим менший проміжок часу ∆τ, тим менша зміна концентрації ∆С і тим ближче відношення ∆С/∆τ до істинної швидкості хімічної реакції. Відомо, що концентрації речовин у хімічному процесі змінюються безперервно (рис.6.1), тому правильніше описувати хімічний процес у певний момент часу за допомогою істинної швидкості реакції. Точний математичний вираз істинної швидкості реакції є перша похідна від концентрації за часом:  (6.2)
(6.2)
Оскільки швидкість хімічних реакцій завжди додатна і характеризується зміною концентрацій реагуючих речовин (С2 < С1), то величина ∆С (dC) буде від'ємна і відношення ∆С/∆τ (dC/dτ) у формулах (6.1), (6.2) треба брати із знаком «мінус». Якщо швидкість реакції визначають за зміною концентрації одного з продуктів реакцій (див. рис.6 1), то величина ∆С (dC)додатна і відношення ∆С/∆τ (dC/dτ) у формулах (6.1), (6.2) треба брати із знаком «плюс». Швидкість хімічних реакцій,
|
реакції (б).
а б
Рис. 6.1. Зміна концентрацій С реагуючих речовин (а) та продуктів (б)
як правило, вимірюють у моль/(см3∙хв). Істинна швидкість реакцій дорівнює тангенсу кута нахилу дотичної до кривої залежності концентрації від часу (див. рис. 6.1):
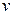 = tg α.
= tg α.
Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрацій, температури, наявності каталізатора і деяких інших зовнішніх факторів.
Закон діючих мас
Отже. швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у степенях, які дорівнюють коефіцієнтам, що стоять перед… Для взаємодії двох молекул, наприклад водню і йоду за рівнянням Н2+I2=2НI,Енергія активації
Частина молекул у системі внаслідок перерозподілу енергії завжди має певний надмір енергії порівняно з середньою енергією молекул. Тому вони можуть… Наявність енергетичного бар'єру призводить до того, що багато які реакції,… ∆H = Eпр - ЕвихВплив температури на швидкість реакції
, (6.4) де А — множник Арреніуса, пропорційний числу зіткнень молекул. Якщо концентрації реагуючих речовин дорівнюють 1 моль/л, то рівняння Арреніуса (6.4) дає змогу виразити залежність…Каталіз
Речовини, які уповільнюють швидкість хімічних процесів, а самі при цьому не змінюються, називаються інгібіторами. З наведеного визначення може здатись, що каталізатор не бере участі в хімічній… Механізм дії каталізаторів різний. Найпоширенішою формою дії каталізатора є утворення проміжних сполук з реагуючими…Хімічна рівновага
Необоротними хімічними реакціями називаються реакції, які відбуваються лише в одному напрямі. З погляду термодинаміки, відповідно до рівняння для… До необоротних реакцій належать, наприклад, розкладання перманганату калію… 2КМп04 = К2МпО4 + МпО2 + 02,Отже, константа рівноваги не залежить від концентрації речовин, а залежить від природи реагуючих речовин і температури реакції.
Вплив зовнішніх факторів на хімічну рівновагу. Принцип ле Шательє
Характер зміни рівноваги залежно від зовнішніх факторів можна визначити за принципом ле Шательє. Цей принцип, відкритий у 1882 p. французьким вченим А. ле Шательє,… Розглянемо принцип ле Шательє на прикладі рівноважної системиЗбільшення концентрацій реагуючих речовин або зменшення концентрацій продуктів реакції зміщує рівновагу в напрямку прямої реакції.
Принцип ле Шательє має велике практичне значення, особливо для хімічної промисловості. Наприклад, при синтезі аміаку підвищення температури зменшує…Запитання та задачі для самоконтролю
1. Що таке швидкість хімічної реакції, як її визначити і від яких факторів вона залежить?
2. Який фізичний зміст константи швидкості, як вона виражається? Коли числові значення швидкості та константи швидкості збігаються?
3. У чому полягає відмінність між порядком і молекулярністю хімічної реакції? Коли вони збігаються?
4. Константа швидкості реакції першого порядку дорівнює 4,5•10-5 с-1, початкова концентрація реагента становить 1,6 моль/л. Обчислити початкову швидкість реакції.
5. Реагенти А і В з початковою концентрацією кожного 0,2 моль/л беруть участь у реакції другого порядку. Чому дорівнює константа швидкості цієї реакції, якщо її початкова швидкість 1,6•10-4 моль/л • с?
6. Назвати порядок реакції, обчислити константу швидкості, якщо рівняння швидкості має вигляд v=k•[А]•[В]2, a v=0,036 моль/л•год, [А] = 0,37 моль/л і [В] = 1,26 моль/л.
7. У скільки разів зросте константа швидкості хімічної реакції при підвищенні температури на 40 оС, якщо температурний коефіцієнт швидкості дорівнює 3,5?
8. Обчислити, як зміниться швидкість реакції 2NO + О2 ⇄ 2NO2 внаслідок збільшення тиску втричі?
9. Як збільшиться швидкість реакції при підвищенні температури з 10 до 100 °С, якщо при нагріванні на кожні 10оС швидкість подвоюється?
10.Записати швидкість реакцій 2Н2 + О2 ⇄ 2Н2О і 2Mg + O2= 2MgO у вигляді кінетичних рівнянь.
11.Для яких реакцій підвищення температури зумовлює сповільнення їх швидкості?
12.Обчислити енергію активації реакції, швидкість якої при підвищенні температури від 27 до 37°С зростає вдвічі.
13.Що таке активований комплекс і в чому полягає його дія?
14.Який принцип дії каталізатора? Як він впливає на енергію активації?
15.Що таке константа рівноваги, про що вона свідчить і від яких факторів залежить?
16.Що сталося б, якби каталізатор неоднаковою мірою впливав на швидкість прямої та зворотної реакцій?
17.Записати вирази для констант рівноваги ендотермічних оборотних реакцій:а) СО2 + С⇄2СО; б) Fе3О4 + 4Н2⇄ 3Fe + 4Н2О. Вказати напрямок зміщення рівноваги при підвищенні температури та тиску.
18.При температурі 2000°С константа рівноваги реакції N2+O2⇄2NO дорівнює 6,0 • 10-4. Обчислити рівноважну концентрацію оксиду Нітрогену, якщо початкові концентрації азоту та кисню становлять відповідно 0,1 і 0,02 моль/л.
19.Обчислити константу рівноваги оборотної реакції А+2В⇄С+D, якщо початкові концентрації речовин дорівнюють: [А] = 6 моль/л, [В] = 5 моль/л і до моменту появи рівноваги прореагувало 80 % речовини В.
20.Рівноважні концентрації речовин у системі 2А + В⇄2С + D дорівнюють: [А] = 2 моль/л, [В] = 1 моль/л, [С] = 1,6 моль/л. Обчислити початкові концентрації.
21.У посудину об'ємом 10л помістили 56 г чадного газу та 54 г водяної пари. Константа рівноваги для реакції CO + Н2О ⇄ СО2 + Н2 за умов реакції дорівнює 1. Якими стали концентрації всіх речовин у момент рівноваги?
Список рекомендованої літератури
– Конец работы –
Используемые теги: методичні, вказівки, самостійної, роботи, дисципліни, ХІМІЯ0.101
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни «ХІМІЯ»
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов