рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Основні типи хімічного зв’язку. Ковалентний зв’язок
Реферат Курсовая Конспект
Основні типи хімічного зв’язку. Ковалентний зв’язок
Основні типи хімічного зв’язку. Ковалентний зв’язок - раздел Философия, МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни «ХІМІЯ» Хімічний Зв'язок Значною Мірою Визначає Будову Молекул І Тіла Загалом, А Отже...
Хімічний зв'язок значною мірою визначає будову молекул і тіла загалом, а отже, і властивості хімічних сполук, речовин і тіл.
Серед індивідуальних хімічних речовин, що поділяються на прості та складні, простих порівняно небагато. Але й серед простих речовин тільки благородні гази складаються з хімічно не зв’язаних один з одним атомів. У решті випадків атоми сполучені між собою хімічними зв’язками. Будова атома, стан електрона в ньому, та вчення про періодичність пояснюють механізм утворення молекул і природу хімічного зв’язку.
Молекули хімічних речовин утворюються із атомів за рахунок хімічного зв’язку, що має електричну природу. Хімічний зв'язок утворюється за рахунок валентних електронів, але здійснюється він по різному. Залежно від характеру розподілу електронної густини в речовині, розрізняють такі основні типи хімічного зв’язку: ковалентний. іонний і металічний.
Хімічний зв’язок, утворений спільними електронними парами, називається ковалентним. Ковалентний зв’язок здатний до насиченості, має певний напрямок у просторі й поляризується.
З метою пояснення природи зв’язку англійські вчені Гейтлер і Лондон запропонували метод валентних зв’язків (МВЗ).
Необхідно твердо засвоїти основні положення МВЗ.
1.Хімічний зв’язок виникає за рахунок утворення спільних електронних пар між взаємодіючими атомами, причому в утворенні зв’язку беруть участь електрони із антипаралельними спінами.
2.Процес утворення молекул із атомів енергетично вигідний, енергія молекул менша від суми енергій атомів.
3.Хімічний зв’язок утворюється за рахунок перекривання орбіталей взаємодіючих атомів.
4.Ковалентний зв’язок тим міцніший, чим більша площина перекривання АО.
Механізм утворення ковалентного зв'язку розглянемо на прикладі утворення молекули водню:
Н + Н = Н2; ∆Н = - 436 кДж/моль
| Рис.4.1.Схема перекривання електронних орбіталей під час утворення молекули водню |
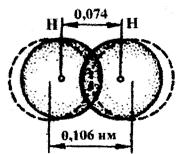
|
Ядро вільного атома Гідрогену оточене сферичною симетричною електронною хмарою, утвореною 1s-електроном. Під час зближення атомів до певної відстані відбувається часткове перекривання їх електронних хмар (орбіталей) (рис 4.1). У результаті між центрами обох ядер виникає молекулярна двоелектронна хмара, що має максимальну електронну густину в просторі між ядрами.
Збільшення густини негативного заряду сприяє швидкому зростанню сил притягання між ядрами та молекулярною хмарою. Отже, утворення ковалентного зв'язку є результатом перекривання електронних хмар атомів. У результаті виникнення хімічного зв'язку спільної пари електронів між двома атомами Гідрогену кожен з них досягає електронної конфігурації атома благородного газу гелію:
Н· + ·Н → Н:Н
Неспарені Спільна, або
електрони поділена пара електронів
Ковалентний зв'язок у молекулі хлору також утворюється за допомогою спільних електронів або електронної пари:

Як бачимо, кожен атом Хлору має три неподілені пари і один неспарений електрон. Хімічний зв'язок виникає за рахунок неспарених електронів кожного атома. Неспарені електрони зв'язуються у спільну пару електронів, яка називається також поділеною парою.
Отже, у молекулі хлору кожен його атом має завершений зовнішній рівень з восьми електронів (s2p6), причому два з них (електронна пара) однаковою мірою належать обом атомам.
Хімічні зв'язки зображають за допомогою електронів зовнішнього енергетичного рівня у вигляді крапочок, поставлених біля хімічного елемента. Утворення ковалентного зв'язку між атомами Флуору, Оксигену й Нітрогену можна подати схемами:

Завдяки взаємодії цих атомів і встановлення між ними ковалентного зв’язку, навколо кожного атома утворюється стійка конфігурація із восьми електронів.
Якщо між атомами виник один ковалентний зв'язок (одна спільна електронна пара), він називається одинарним; якщо більше, то кратним: подвійним (дві спільні пари), потрійним (три спільні електронні пари).
Одинарний зв'язок зображується однією рискою (штрихом), подвійний - двома, потрійний - трьома. Риска між двома атомами показує, що у них пара електронів узагальнена, унаслідок чого і утворився хімічний зв'язок. За допомогою таких рисок зображують структурні формули молекул.
F – F (одинарний зв'язок); О = О (подвійний зв'язок); N≡N (потрійний зв'язок).
Потрійний зв'язок міцніший, ніж подвійний і первинний (одинарний). Тому молекула азоту є міцнішою, ніж молекула кисню або водню, чим зумовлена значна інертність азоту у хімічних реакціях.
Валентність атома визначається числом неспарених електронів на його валентному рівні.
Наприклад:
 - валентність ІІ;
- валентність ІІ;
11Na 1s22s22р63s1 - валентність І.
Число неспарених електронів на валентному рівні атома може змінюватися під час переходу атома у збуджений стан. Такий перехід можливий тільки тоді, коли в атома на валентному рівні є вакантні АО.
Наприклад, в алюмінію: 13Al, 1s22s22р63s23p1 можливе розпаровування 3s-електронів з переходом одного s-електрона в р-стан, де є вакантні АО.
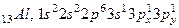
У цьому випадку три неспарених електрони і алюміній буде проявляти валентність ІІІ.
Якщо в атомі, виходячи з його електронної структури, на зовнішньому енергетичному рівні немає вакантних АО, розпаровування з переходом електронів на суміжні АО даного енергетичного рівня неможливе. Наприклад, для азоту, кисню і фтору характерний лише нормальний стан, тому що на валентному (другому) рівні є лише s- і р-підрівні, що заповнені електронами.
 ;
;
 ;
;
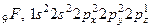 ;
;
Тому за рахунок неспарених електронів атом азоту може утворювати три ковалентних зв’язки, атом кисню – два і атом фтору – лише один. У неону 10Ne, 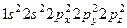 взагалі немає вакантних АО на валентному рівні. Валентність нульова. Збудженого стану немає. Цим і пояснюється його інертність.
взагалі немає вакантних АО на валентному рівні. Валентність нульова. Збудженого стану немає. Цим і пояснюється його інертність.
Атоми елементів третього періоду на зовнішньому енергетичному рівні мають d-підрівень, на який при збудженні можуть переходити s- і р-електрони зовнішнього рівня. При цьому з’являється додаткова можливість збільшення числа неспарених електронів. Так, наприклад, атом хлору в основному стані має один неспарений електрон і при затраті енергії може бути переведений у збуджений стан, що характеризується наявністю трьох, п’яти і семи електронів.
 (В=I) Нормальний стан
(В=I) Нормальний стан
 (В=III) Збуджений стан
(В=III) Збуджений стан
 (В=V) Збуджений стан
(В=V) Збуджений стан
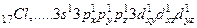 (В=VII) Збуджений стан
(В=VII) Збуджений стан
Тому атом хлору проявляє валентність – І, ІІІ, V, VII.
Приклад 1. Яку валентність проявляє магній?
Відповідь. У нормальному стані розподіл електронів такий: 12Mq, 1s22s22р63s2. Неспарених електронів немає, отже магній у нормальному стані не утворює хімічних сполук. Проте на валентному рівні (третьому) у нього є вакантні АО. Тому атом магнію легко переходить у збуджений стан. Один 3s-електрон переходить на 3р-підрівень. У збудженому стані атом магнію проявляє валентність ІІ.
Хімічний зв’язок між атомами зумовлюється перекриванням s-, р-, d-атомних орбіталей, які певним чином орієнтовані у просторі. Тому й хімічний зв’язок, що утворюється за їх участю, має в просторі певну напрямленість. Залежно від способу перекривання електронних орбіталей розрізняють σ (сигма)-, π (пі) і δ(дельта) – зв’язки.
σ-зв’язок здійснюється при перекриванні електронних орбіталей уздовж лінії, що з’єднує ядра взаємодіючих атомів. Так перекриваються: s- і s-, s- і р-, р- і р-, d- і d-АО між собою.
|
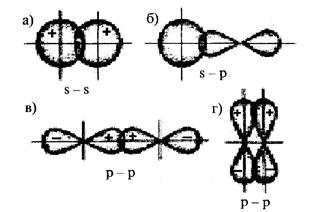 |
σ-зв’язок характеризується однією областю перекривання електронних орбіталей, він завжди одинарний, тобто утворюється за рахунок однієї електронної пари.
π- зв’язок виникає при перекриванні АО по обидва боки від лінії, що з’єднує ядра атомів. Наприклад, під час взаємодії двох р-орбіталей, розташованих перпендикулярно до лінії, що з’єднує ядра атомів, виникають дві області перекривання (рис.4.2, г). Відповідно π-зв’язок характеризується двома областями перекривання, що розташовані по обидва боки від лінії, яка з’єднує ядра атомів. π- зв’язок також може утворитися при перекриванні двох d-орбіталей тощо.
Часто при утворенні молекул відбувається зміна форми й енергії АО. Замість нерівноцінних (різних за формою і енергією) АО утворюються рівноцінні (гібридні) АО, що мають однакову форму й енергію, тобто відбувається гібридизація (змішування) АО.
 |
Тип гібридизації визначається типом і кількістю орбіталей, що беруть участь у гібридизації. Число гібридизованих орбіталей завжди дорівнює числу орбіталей, які беруть участь у гібридизації. Гібридні АО мають несиметричний вигляд.
|
sp-гібридизація (q2) відбувається у випадку перекривання s- і р-орбіталей. Гібридні орбіталі розташовуються симетрично під кутом 180º. Зв’язки, що утворюються за участю електронів цих орбіталей, також розташовуються під кутом 180º. Форма молекул – лінійна. Наприклад, молекули BeH2 і BeCl2 мають лінійну форму.

|
|
Такий тип гібридизації має місце при утворенні галогенідів елементів ІІ групи періодичної системи.
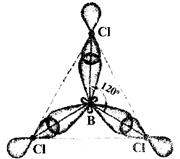
sp2-гібридизація (q3) виникає при перекриванні однієї s- і двох р-орбіталей. У цьому випадку гібридні АО розташовуються одна до другої під кутом 120º.
Під таким самим кутом розміщуються зв’язки, утворені електронами цих орбіталей. Такий тип гібридизації характерний для молекул елементів ІІІ групи періодичної системи. Наприклад, молекула ВCl3 має форму правильного рівностороннього трикутника, у центрі якого розташований атом бору, а на вершинах – атоми хлору.
|
sp3-гібридизація (q4) виникає при перекриванні однієї s- і трьох р-орбіталей. Чотири гібридні орбіталі, що утворюються, симетрично орієнтуються у просторі під кутом 109º28´ (тетраедрична орієнтація).
Тетраедричне розміщення зв’язків і форма тетраедра характерні для багатьох сполук чотиривалентного вуглецю, наприклад, у молекулі CCl4 або CH4.
sp3-гібридизація характерна і для інших молекул елементів IV групи періодичної системи.

|
|
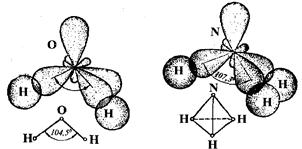
Проте можуть біти відхилення від тетраедричної форми. Наприклад, у молекулах аміаку спостерігається sp3-гібридизація, проте молекули мають пірамідальну будову. Це пояснюється тим, що в молекулах аміаку тільки три гібридні орбіталі приймають участь в утворені зв’язків з атомами водню, а четверта – насичена власними електронами.
Таке явище спостерігається й у молекулах води (sp3-гібридизація), де дві гібридні АО насичені тільки власними електронами. Тому молекули води побудовані у площині з кутом між зв’язками, що дорівнює 104,5º.
|
Ковалентний зв'язок може бути неполярним або полярним. Полярність хімічного зв’язку виникає при зміщенні електронної пари до атома з більшою електронегативністю (æ) (див. розділ 3.6). Кількісно полярність зв’язку визначають за значенням дипольного моменту μ (мю), що дорівнює добутку заряду на відстань між центрами негативного і позитивного полюсів диполя: μ=q·l, де μ – дипольний момент; q – ефективний заряд; l - довжина диполя.
Молекули, що утворилися за рахунок полярного ковалентного зв’язку, як правило, полярні. Наприклад, HCl, HBr, HI тощо. Проте зустрічаються неполярні молекули, що утворилися за рахунок полярного зв’язку, наприклад, СH4, СCl4, СО2, ВH3, BCl3. Таке явище пов’язане із симетричним розташуванням атомів у просторі. Дипольні моменти зв’язків, що виникли в молекулі, компенсуються іншими дипольними моментами зв’язків тієї самої молекули. Тому молекули в цілому неполярні.
Молекули, утворені за допомогою ковалентного неполярного зв’язку (наприклад Cl2, Br2, І2, О2, N2, )- неполярні. Це пояснюється тим, що æ атомів однакова й тому немає зміщення електронних пар.
Ковалентний зв'язок може виникнути за обмінним (кожен з атомів надає по одному електрону для утворення спільної електронної пари) або донорно-акцепторним механізмом.
Донорно-акцепторний механізм утворення ковалентного зв’язку полягає в тому, що виникає перекривання АО за рахунок спареної (неподіленої) електронної пари одного атома з вакантною АО другого атома. Атом, що дає неподілену електронну пару, називається донором електронів; атом, який дає вакантну АО – акцептором електронів.
Донорно-акцепторний механізм утворення ковалентного зв’язку схематично можна зобразити так:
А: + В□ →А:В
донор акцептор
Прикладом донорно-акцепторної взаємодії є реакція між йоном Гідрогену Н+ (ls° - вільна s орбіталь) і молекулою амоніаку NH3, яка має неподілену пару електронів (двоелектронну хмару). Процес утворення йона амонію можна подати схемою:

або  .
.
Слід зауважити, що всі чотири зв'язки N - Н у катіоні амонію є рівноцінними і однаковими за властивостями.
– Конец работы –
Эта тема принадлежит разделу:
МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни «ХІМІЯ»
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... кафедра хімії... МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни ХІМІЯ ЗМІСТ МОДУЛЯ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Основні типи хімічного зв’язку. Ковалентний зв’язок
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов