рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Основні закони хімічної взаємодії
Реферат Курсовая Конспект
Основні закони хімічної взаємодії
Основні закони хімічної взаємодії - раздел Философия, МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни «ХІМІЯ» У 1748 Р. Російський Вчений М.в.ломоносов Сформулював Один Із Фундаментальних...
У 1748 р. російський вчений М.В.Ломоносов сформулював один із фундаментальних законів природи – закон збереження маси:
| Маса речовин, що вступили в реакцію, дорівнює масі речовин, що утворилися внаслідок реакції. |
З точки зору атомно-молекулярного вчення закон збереження маси речовин пояснюється тим, що під час хімічних реакцій загальна кількість атомів не змінюється, а лише відбувається їх перегрупування. Наприклад, для реакції, яка виражається 2Н2+О2=2Н2О скільки атомів водню вступило в реакцію, стільки ж їх залишилось після реакції, тобто число атомів елемента у речовинах, що вступають у реакцію дорівнює числу їх у речовинах, що утворилися внаслідок реакції.
Закон збереження маси є основним законом хімії. Всі розрахунки за хімічним рішенням виконуються на основі цього закону. Виникнення сучасної хімії як точної науки пов’язане з відкриттям М.В.Ломоносовим закону збереження маси речовини.
Закон сталості складу (Ж.Л.Пруст, 1801):
| Співвідношення між масами елементів, що входять до складу даної сполуки, сталі й не залежать від способу добування цієї сполуки. |
Наприклад, воду можна отримати за допомогою кількох хімічних реакцій:
1) 2Н2+О2=2Н2О;
2) 2NaOH+Н2SО4=Na2SО4+2Н2О;
3) CaSО4×2Н2О=CaSО4+2Н2О
У всіх випадках чиста вода складається із двох атомів водню і одного атома кисню. Співвідношення маси атомів водню і кисню в молекулі води складає 1:8, тобто із 1 г водню і 8 г кисню завжди утворюється 9 г води.
Приклад 1. Скільки грамів води утвориться із 3 г водню і 12 г кисню? Яка речовина взята в надлишку?
Розв’язання. Із умови задачі видно, що водень взято в надлишку, тому що кисню потрібно мати 24 г (3×8=24), щоб вступив у реакцію весь водень (3 г). Кисню у нас 12 г, тобто тільки 12/8=1,5 г водню вступить у реакцію з 12 г кисню. Отже, утвориться 1,5+12=13,5 г води.
Закон сталості складу може бути застосований лише для хімічних сполук, що мають молекулярну будову.
Для речовин, які складаються із атомів чи іонів, існують відхилення від закону сталості складу. Так, у оксиді титану ТіО2 на кожну одиницю маси титану припадає від 0,65 до 0,67 одиниць маси кисню, що відповідає формулі ТіО1,9-2,0. Звичайно формули такого типу відображають не склад молекули, а показують лише межі зміни складу речовини.
Сполуки змінного складу детально вивчав російський вчений Н.С.Курнаков, який назвав такі сполуки бертолідами на честь французького вченого Бертоле, який відстоював у суперечці з Прустом погляд на хімічні сполуки як сполуки, що мають змінний склад.
Хімічні сполуки, що характеризуються сталим складом Н.С.Курнаков назвав дальтонідами на честь англійського вченого Дальтона.
Велике значення для ствердження атомістичної теорії мало відкриття Дж.Дальтоном закону кратних відношень:
| Якщо два елементи утворюють один з одним кілька хімічних сполук, то маси одного з елементів, що припадають у цих сполуках на ту саму масу другого, відносяться між собою як невеликі цілі числа. |
Наприклад, кисень з азотом утворює п’ять різних оксидів (N2O, NO, N2O3, NO2, N2O5), в яких маси кисню, що припадають на одну й ту саму масову частку азоту, відносяться між собою, як 1:2:3:4:5.
Цей закон стосується сполук сталого складу, тобто тих, що мають молекулярну структуру. Для сполук, які не мають молекулярної структури, масові кількості одного елемента відносно другого можуть мати і не цілочисельні значення.
Закон об’ємних відношень (Ж.Гей-Люссак):
| За однакових умов об’єми газів, що вступають у реакцію, відносяться між собою і до об’ємів газів, що утворилися, як невеликі цілі числа. |
Так, наприклад, з одним об’ємом кисню завжди реагують два об’єми водню з утворенням двох об’ємів водяної пари, тобто їх об’ємні співвідношення дорівнюють 1:2:2.
Італійський учений Авогадро в 1811 р. висловив гіпотезу, що згодом перетворилась в закон Авогадро:
| В рівних об’ємах різних газів за однакових умов (T=const, P=const) міститься однакове число молекул. |
Закон Авогадро справедливий лише для газоподібних речовин. Для рідин і твердих речовин об’єм однакового числа молекул різний і залежить від розмірів самих молекул або атомів.
Висновки із закону Авогадро:
- молі різних газів за однакових умов займають однаковий об’єм;
- моль будь-якої газоподібної речовини за нормальних умов (273 К і 101,3 кПа) займає об’єм 22,4 л, цей об’єм називають молярним об’ємом газоподібних речовин.
Знаючи число Авогадро (6,02×1023) і масу моля, можна обчислити абсолютну масу дискретної частинки цієї речовини.
Приклад 2. Обчислити масу однієї молекули водню в грамах.
Розв’язання. Маса однієї молекули водню в грамах дорівнює:
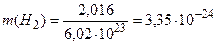 г
г
Молярні маси М(Х) газоподібних речовин або речовин, що легко переходять у газоподібний стан без розкладу, можна визначити такими способами:
1) За рівнянням Менделєєва-Клапейрона
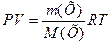 (1)
(1)
звідси
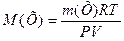 (2)
(2)
де Р – тиск газу, Па; V - його об’єм, м3; m(Х) - маса газу, г; М(Х) – молярна маса газу, г/моль; Х – формульне позначення речовини; R - універсальна газова стала, R=8,31 Дж/(моль×К); Т – абсолютна температура, К.
Приклад 3. Обчислити молярну масу ацетону, якщо маса 0,5 л парів ацетону при температурі 87°С і тиску 96×103 Па дорівнює 0,93 г.
Розв’язання. Значення всіх величин, що дані в задачі, підставимо в рівняння (2) і обчислимо молярну масу. Тиск виражено в паскалях, тому R=8,31 Дж/(моль×К); Т=273+87=360 К.
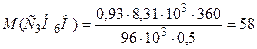 г/моль.
г/моль.
2) На підставі закону Авогадро. Згідно із законом Авогадро відношення мас рівних об’ємів різних газів дорівнює відношенню їх молярних мас, тобто
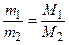 (3)
(3)
але
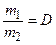 , (4)
, (4)
де m1, m2 – маси рівних об’ємів газів; М1, М2 – молярні маси цих газів; D – відносна густина першого газу за другим.
Якщо рівняння (4) підставимо в рівняння (3), отримаємо:
М1=М2×D, (5)
тобто, молярна маса газу дорівнює його густині відносно іншого газу, помноженій на молярну масу цього газу.
Дуже часто густину газу визначають відносно водню або повітря. В цьому випадку вираз (5) має вигляд:
 (6)
(6)
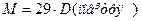 (7)
(7)
де 2 г/моль – молярна маса водню; 29 г/моль – середня молярна маса повітря.
Приклад 4. Визначити молярну масу невідомого газу, якщо густина його відносно повітря дорівнює 1,517.
Розв’язання: Згідно з рівнянням (7) отримаємо
М=29×1,517=44 г/моль
Всі хімічні реакції протікають у відповідності з законом еквівалентів:
| Маси взаємодіючих речовин відносяться між собою так, як молярні маси їх еквівалентів. |
| Еквівалентом елемента називається така його кількість, яка сполучається з 1 моль атомів водню в хімічних реакціях, або заміщує таку саму кількість атомів водню в хімічних реакціях. |
Наприклад, у сполуках HCl, H2S, NH3, CH4 еквівалент хлору, сірки, азоту, вуглецю дорівнює відповідно 1 моль, 1/2 моль, 1/3 моль, 1/4 моль.
Таким чином, еквівалент одновалентного елемента дорівнює 1 моль, а багатовалентних -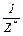 моль, де Z* - число еквівалентності, що дорівнює для елемента його валентності в даній сполуці.
моль, де Z* - число еквівалентності, що дорівнює для елемента його валентності в даній сполуці.
| Еквівалентом складної речовини називається така її кількість, яка взаємодіє без залишку з одним еквівалентом водню або з одним еквівалентом будь-якої речовини |
| Маса одного еквівалента елемента називається молярною масою еквівалента і позначається mЕ(Х). |
Між молярною масою еквівалента, молярною масою атомів і валентністю елемента в даній сполуці існує залежність
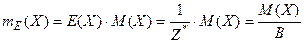 ,
,
де E(X) – еквівалент, Z* - число еквівалентності, В –валентність елемента в даній сполуці.
Так, у розглянутих прикладах молярні маси еквівалентів хлору, сірки, азоту, вуглецю відповідно дорівнюють 35,45 г/моль; 32/2=16 г/моль; 14/3=4,67 г/моль; 12/4=3 г/моль.
Еквіваленти і молярні маси еквівалентів звичайно знаходять за даними аналізу сполук або на підставі результатів заміщення одного елемента іншим. При цьому не обов’язково виходити з його сполук з воднем. Еквівалент (молярну масу еквівалента) можна визначити за складом сполук даного елемента з будь-яким іншим, еквівалент (молярна маса еквівалента) якого відомий (відома).
Приклад 5. Визначити молярну масу еквівалента і еквівалент магнію, якщо при згорянні 1 г цього металу утворилось 1,658 г оксиду магнію (молярна маса еквівалента кисню mE(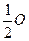 )=8 г/моль).
)=8 г/моль).
Розв’язання. Згідно з законом еквівалентів маємо:
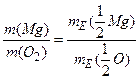 ,
,
звідки
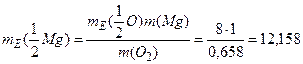 г/моль
г/моль
Таким чином, молярна маса еквівалента магнію дорівнює 12,158 г/моль, а еквівалент магнію – 1/2 моль, тому що молярна маса магнію 24,312 г/моль.
Якщо елемент утворює кілька хімічних сполук, проявляючи при цьому різну валентність, його еквівалент і молярна маса еквівалента в кожній сполуці будуть різними. Наприклад, залізо утворює дві сполуки з киснем: FeO – оксид заліза (ІІ); Fe2O3 – оксид заліза (ІІІ). Відповідно, еквівалент заліза у першій сполуці дорівнює 1/2 моль, у другій – 1/3 моль; молярна маса еквівалента заліза у першому випадку дорівнює mE(1/2 Fe)=55,85/2=27,92 г/моль, у другому – mE(1/3 Fe)=55,85/3=18,62 г/моль.
| Еквівалентний об’єм простих газоподібних речовин – це об’єм, який займає молярна маса еквівалента речовини за нормальних умов. |
Для визначення еквівалентного об’єму простих газоподібних речовин необхідно молярний об’єм газу поділити на число еквівалентності.
Число еквівалентності в такій сполуці визначається за подвоєною кількістю зв’язків між атомами елемента, що входить у дану молекулу. Наприклад, для водню Н-Н, кисню О=О і азоту N≡N еквівалентні об’єми дорівнюють відповідно 22,4/2 = 11,2 л; 22,4/4=5,6 л; 22,4/6=3,7 л.
– Конец работы –
Эта тема принадлежит разделу:
МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни «ХІМІЯ»
КРИВОРІЗЬКИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ... кафедра хімії... МЕТОДИЧНІ ВКАЗІВКИ до самостійної роботи з дисципліни ХІМІЯ ЗМІСТ МОДУЛЯ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Основні закони хімічної взаємодії
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов