рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Философия
- /
- Работа 2. Перенапряжение при выделении водорода
Реферат Курсовая Конспект
Работа 2. Перенапряжение при выделении водорода
Работа 2. Перенапряжение при выделении водорода - раздел Философия, По Теоретической электрохимии 1. Вывод Уравнения Поляризационной Кривой При Замедленной Ста...
1. Вывод уравнения поляризационной кривой при замедленной стадии разряда
Катодное выделение водорода из растворов электролитов на металлических электродах протекает при потенциалах более отрицательных, чем потенциал обратимого водородного электрода в том же растворе. Разность потенциалов между поляризованным и равновесным электродами называется перенапряжением
η = Еi – ЕP,
где ЕР – равновесный потенциал электрода, на котором устанавливается равновесие ox + ne– ↔ R;
Еi – потенциал поляризованного электрода, на котором протекает реакция ox + ne– ↔ R при плотности тока iK.
Согласно определению перенапряжение катодной реакции (реакции восстановления) – отрицательная величина, т.е. ηК < 0.
Величина перенапряжения зависит от материала электрода, от температуры, от состава раствора и от плотности тока, проходящего через электрод (поляризующий ток). Она колеблется от значений, исчисляющихся несколькими десятками милливольт для металлов платиновой группы до значений, достигающих 1 – 1,5 В для ртути и свинца.
При iK >> i0 в концентрированных растворах и отсутствии специфической адсорбции зависимость перенапряжения от плотности тока выражается:
 , (1)
, (1)
или 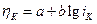 (2)
(2)
где iK – плотность катодного тока, измеренная амперметром, А/см2;
i0 – плотность тока обмена;
a – постоянная, зависящая от материала электрода и от состава раствора:
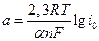 ; (3)
; (3)
b – коэффициент, принимающий чаще всего значение, близкое к 0,118 В при температуре 25 ºС и практически не зависящий от состава раствора и природы электродов:
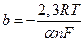 ; (4)
; (4)
α – коэффициент переноса катодной реакции стадии разряда – ионизации;
n – число электронов, расходующихся на восстановление одного иона.
Константа «a» соответствует перенапряжению водорода при плотности тока 1А/см2, константа «b» дает изменение перенапряжения при десятикратном изменении плотности тока (см. рис. 1).
Уравнение (1) соблюдается для средних и высоких значений перенапряжения. При низких значениях плотности тока iK < i0 величина перенапряжения прямо пропорциональны плотности поляризующего тока:
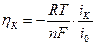 (1.5)
(1.5)
Величины i и α являются кинетическими параметрами электрохимической реакции и могут быть определены с помощью рис. 1 и уравнений (3) и (4).
После включения поляризующего тока или изменения его величины потенциал электрода, как правило, быстро приближается к новому стационарному по времени значению, соответствующему данной плотности тока. Если плотность поляризующего тока очень мала, то для установления нового значения требуется некоторое время, в течение которого поляризующий ток изменяет величину заряда двойного электрического слоя на границе раздела металл – раствор.
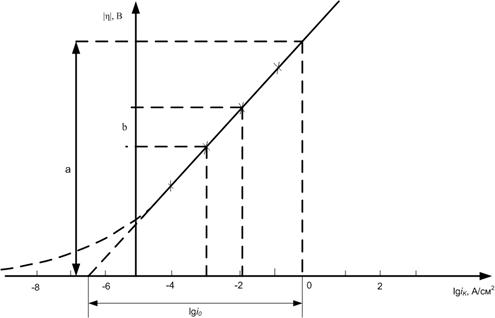
Рис. 1. Зависимость перенапряжения от плотности тока в полулогарифмических координатах:
Сплошная линия η – lg iK отвечает перенапряжению при i >> i0, пунктирная линия отвечает перенапряжению при i << i0.
Явление перенапряжения указывает на необратимость (малую скорость) одной из промежуточных стадий процесса восстановления водородных ионов:
 ,
,
где I – стадия доставки иона гидроксония из объема раствора на внешнюю границу двойного электрического слоя;
II – стадия электростатической адсорбции иона гидроксония;
III – стадия разряда-ионизации, заключающаяся в данном случае в переносе заряда (электрона) с металла на ион гидроксония с одновременным разрушенимем гидратной оболочки;
IV – стадия образования молекулы водорода из адсорбированных атомов;
V – стадия десорбции молекул водорода в раствор с образованием газообразного водорода.
Согласно современным представлениям, перенапряжение выделения водорода на большинстве металлов приписывается замедленности стадии III разряда адсорбированных ионов гидроксония с образованием атомов водорода H3O+ + e– → Hадс. (теория замедленного разряда). На некоторых металлах, на которых наблюдается низкое значение перенапряжения, как, например, металлы платиновой группы, замедленной стадией является медленность процесса соединения адсорбированных атомов с образованием молекул водорода (рекомбинация атомов).
Смещение электродного потенциала в отрицательную сторону способствует возрастанию скорости стадии разряда-ионизации.
Наиболее полно влияние различных факторов на перенапряжение при выделении водорода отражено в теории замедленного разряда А.Н. Фрумкина. В условиях, достаточно далеких от равновесного состояния, когда парциальный ток восстановления 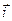 много больше тока обмена (
много больше тока обмена (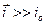 ), и при условии обратимости всех стадий выделения водорода, за исключением стадии разряда, скорость выделения водорода:
), и при условии обратимости всех стадий выделения водорода, за исключением стадии разряда, скорость выделения водорода:
 , (6)
, (6)
где iK – плотность катодного тока, измеренная амперметром, А/см2;
æ - трансмиссионный коэффициент;
k – постоянная Больцмана;
h – постоянная Планка;
aoxO – активность восстанавливающихся частиц в глубине раствора;
γ – коэффициент активности активированного комплекса;
Zox – зарядность восстанавливающихся частиц;
Ψ1 – внутренний потенциал поверхностной фазы, соответствующий положению адсорбированной восстанавливающейся частицы;
gox, gR – специфические стандартные свободные энергии адсорбции, соответственно для исходного вещества и продукта реакции;
W* - энергия активации при равновесии между металлом и раствором в стандартных условиях (a = 1);
Еº - стандартный потенциал электрода, на котором устанавливается равновесие ox + ne– ↔ R.
Уравнение (6) можно переписать в виде:
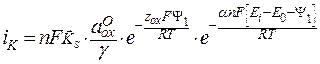 , (7)
, (7)
где kS – гетерогенная константа скорости прямой реакции, включающая W*.
При выделении водорода на ртутном катоде исходные вещества: ионы H3O+ и молекулы H2O, а также продукты реакции стадии разряда специфически не адсорбируются на поверхности катода, поэтому gox и gR равны нулю.
Прологарифмировав уравнение (7) и произведя замену стандартного потенциала на
 , получим:
, получим:

или
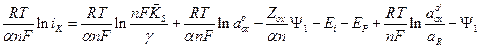 (8)
(8)
Разность Ei – EP представляет собой перенапряжение реакции выделения водорода.
Переписав уравнение (8) относительно перенапряжения, получим уравнение, описывающее влияние условий электролиза и состава раствора на перенапряжение выделения водорода при замедленной стадии разряда
 , (9)
, (9)
где aoxO – активность ионов H3O+, определяющая равновесный потенциал;
aR – активность восстановленной формы, представляющая активность продуктов реакции: воды и молекулярного водорода, которая практически не зависит от состава раствора, т.е. aR = const.
В уравнении (9) значение константы «b» такое же, как и в уравнении Фольмера. Константа «a» отражает влияние ряда переменных (aoxO, aoxO`, α, Ψ1 и др.), зависящих от состава электролита, на величину перенапряжения.
2. Влияние pH на перенапряжение водорода при постоянной ионной силе раствора.
Рассмотрим влияние pH на перенапряжение водорода при:
1. Ψ1 = const (Ψ1 – не зависит от pH раствора),
2. i = const.
Потенциал Ψ1 не зависит от ионной силы раствора. Постоянного значения Ψ1 при изменении pH можно достичь, применяя растворы с неизменной ионной концентрацией. В таких растворах различная величина pH устанавливается путем изменения относительного содержания кислоты (щелочи) и электролита фона (например, хМ H2SO4 + (c-x)M K2SO4 при с = const).
При pH < 7 необратимая реакция выделения водорода:
H3O+ + e– → Hадс. + H2O
Обратимая реакция, определяющая величину EP:
H3O+ + e– ↔ ½ Hадс. + H2O
Следовательно, при pH < 7:
aoxO = aoxO’ = aOH3O+
и
n = z = 1
Тогда уравнение (9) можно переписать в виде:
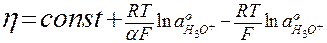 ; (10)
; (10)
Слагаемые 4 и 5 уравнения (9) при рассматриваемых условиях не зависят от pH и войдут в const.
При выделении водорода на ртутном катоде
α = 0,48 – 0,5, тогда
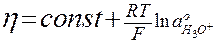 (11)
(11)
Так как
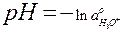 , то
, то
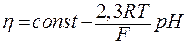 (12)
(12)
При температуре раствора 25 °С
η = const – 0,059pH; (13)
т.е. при возрастании pH на 1 в кислых растворах перенапряжение водорода увеличивается на 0,059 В (см. рис. 2).
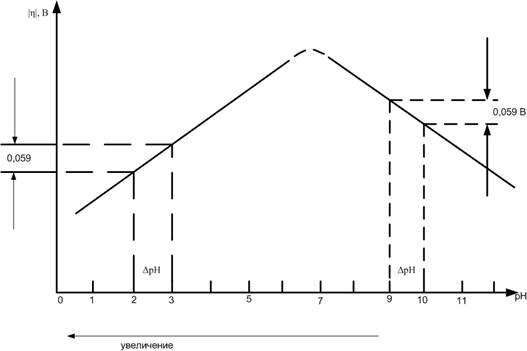
Рис. 2. Влияние pH раствора на перенапряжение водорода при Ψ1 = const и i = const.
Экспериментальная зависимость η от pH хорошо совпадает с теоретической в области pH < 7.
При pH > 7 эксперимент дает уменьшение η ≈ 0,059 В с ростом pH на 1. Несовпадение теоретических и экспериментальных данных заставило изучит механизм выделения водорода из щелочных растворов.
В кислых растворах на катоде разряжаются ионы гидроксония H3O+, в щелочных растворах концентрация H3O+ мала (iпр., H3O+ →0), и уже при очень низких плотностях тока потенциал катода достигает значений, при которых становится возможным восстановление молекул воды. Таким образом, реакция выделения водорода при pH > 7
H2O + e– →Hадс. + OH–
Активность реагирующих частиц соответствует активности молекул воды, т.е.
aoxO = aOH2O.
Активность молекул воды практически не зависит от pH раствора, поэтому потенциал при определенном токе Ei один и тот же, в растворах с различным pH. Напротив, равновесный потенциал водородного электрода, так же и при pH <7, определяется активностью ионов гидроксония и монотонно смещается в отрицательную сторону на 0,059 В при повышении pH на 1.
В щелочных растворах различна природа восстанавливающихся частиц и частиц, определяющих равновесный потенциал водородного электрода, то есть:
aoxO aOH2O = const,
aoxo’ = a° ≠ const.
Слагаемые 2, 4, 5 уравнения (9) не зависят от pH раствора и их можно ввести в const. Тогда уравнение 9 примет вид
 (14)
(14)
или
 (15)
(15)
то есть в щелочных растворах при температуре 25 °С перенапряжение водорода уменьшается на 0,059 В при возрастании pH на 1 (рис. 2).
3. Влияние pH раствора на перенапряжение водорода при изменяющейся ионной силе раствора.
Рассмотрим влияние pH раствора на перенапряжение водорода при:
1. Ψ1 ≠ const;
2. i = const.
Изменение pH раствора создается за счет изменения концентрации только кислоты или только щелочи. Так как в растворе отсутствует фоновый электролит, то при изменении pH раствора будет меняться ионная сила раствора, что вызывает изменение величины Ψ1 – потенциала. Следовательно, при i = const в растворах, не содержащих фонового электролита, величина pH должна воздействовать на перенапряжение водорода через слагаемые 2, 3, 4 уравнения (9).
В отсутствие специфической адсорбции ионов электролита знак Ψ1 – потенциала совпадает со знаком заряда электрода. Штерном были получены следующие приближенные уравнения для Ψ1 – потенциала:
Если qM > 0, то
 (16)
(16)
Если qM < 0, то
 (17)
(17)
Для того, чтобы выбрать уравнение (16) или (17), нужно сравнить потенциал электрода под током Ei с потенциалом нулевого заряда электрода Eq=0. На ртути выделение водорода происходит при потенциалах более отрицательных, чем потенциал нулевого заряда Ei < Eq=o, следовательно, электрод заряжен отрицательно и влияние pH на строение двойного слоя описывается уравнением (17). Если потенциал поляризованного электрода Ei значительно отличается от Eq=0 (φKOH велико по сравнению с Ψ1), что имеет место при выделении водорода с заметной скоростью, тогда можно пренебречь влиянием изменения φион на Ψ1 – потенциал.
Тогда  , (18)
, (18)
где С – концентрация – кислоты иди щелочи в зависимости от величины pH.
Для растворов с pH < 7 уравнение Ψ1 имеет следующий вид:
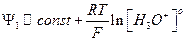 (19)
(19)
Увеличение pH раствора происходит за счет уменьшения концентрации кислоты, при этом Ψ1 –потенциал возрастает по величине и приобретает более отрицательное значение.
При выделении водорода из кислых растворов:
 и n = z = 1
и n = z = 1
для постоянной плотности тока iK и коэффициента переноса α = 0,5 уравнение (9), примет вид:
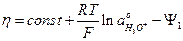 (20)
(20)
Подстановка значения Ψ1 из (1.19) приводит к
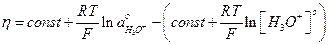 (21)
(21)
После раскрытия скобок и объединения const и, полагая, что
aoH3O+ = [H3O+], получим η = const,
следовательно, при изменении pH кислых электролитов, не содержащих электролит фона, изменение слагаемых 2, 3 и 4, зависящих от pH, происходит в противоположные стороны, поэтому η не зависит от pH (см. рис. 3).
При pH > 7 возрастание pH раствора происходит вследствие увеличения концентрации щелочи. Строение двойного слоя, т.е. величина Ψ1, определяется концентрацией щелочи. В щелочных растворах потенциал выделения водорода отрицательнее потенциала нулевого заряда ртути, поэтому для оценки влияния pH на Ψ1 используем уравнение (18). Согласно уравнению (18), при увеличении pH Ψ1 уменьшается по абсолютной величине и приобретает менее отрицательные значения.
При выделении водорода из щелочных растворов:
aoxo = aH2Oo ; aoxo = aH3O+ n=1 z= o
Концентрация молекул воды в рассматриваемом диапазоне pH практически не зависит от концентрации щелочи, следовательно,
aoH2O = const
При i = const и α ≈ 0,5 уравнение (9) примет следующий вид:
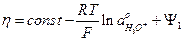 (22)
(22)
Подставим значение Ψ1 – потенциала из уравнения (18):
 (23)
(23)
Концентрацию щелочи можно выразить:
 ,
,
Где KW – ионное произведение воды.
Тогда
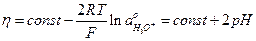 (24)
(24)
Увеличение pH на 1 в щелочных небуферированных растворах вызывает снижение перенапряжение на 0,118 В (см. рис. 3).

Рис. 3. Влияние pH на перенапряжение водорода в растворах с изменяющейся ионной силой при iK = const
– Конец работы –
Эта тема принадлежит разделу:
По Теоретической электрохимии
Лабораторный практикум по Теоретической электрохимии Кинетика электродных процессов...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Работа 2. Перенапряжение при выделении водорода
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов