Правило відрізків
В процесі кристалізації змінюється і концентрація компонентів в фазах, і кількість кожної фази сплаву (при кристалізації кількість твердої фази збільшується, а рідкої зменшується).
Фазою (phase) називається хімічно однорідна частина сплаву, відокремлена від інших його частин поверхнею розділу (границею). Фазами в сплавах можуть бути хімічні елементи, хімічні сполуки, рідкі та тверді розчини.
В будь-якій точці діаграми, коли в сплаві одночасно існують дві фази, можна визначити кількість обох фаз і їх концентрацію. Для цього служить правило відрізків або правило важеля.
Правило відрізків (правило важеля) застосовують для визначення:
1. Концентрації компонентів в фазах;
2. Кількості (ваги) фаз сплаву в будь-якій точці діаграми.
Використаємо правило відрізків для аналізу стану сплаву в точці b (рис. 3.2). Проведемо горизонтальну лінію (коноду) через точку b до перетину з лініями діаграми. Одержимо лінію ас. Точка b ділить лінію ас на відрізки аb і bс.
Для визначення концентрації компонентів в фазах необхідно з точок перетину коноди з лініями діаграми опустити перпендикуляри на вісь концентрацій (вісь абсцис) діаграми стану (рис. 3.2).
Наприклад, в точці b (рис. 3.2) сплав складається з кристалів сурми і рідини. Опустивши перпендикуляр з точки а на вісь концентрацій, визначимо концентрацію компонентів в рідині. Вона становить 48 % Pb та 52 % Sb. Опустивши перпендикуляр з точки с на вісь абсцис, побачимо, що тверда фаза в даній точці складається з кристалів сурми (100 % Sb).
Відповідно до правила відрізків, кількість (вага), наприклад, твердої фази – кристалів сурми – в даній точці діаграми так відноситься до кількості всього сплаву, як довжина відрізка, що прилягає до лінії ліквідус аb, відноситься до повної довжини лінії ас.
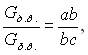 звідки:
звідки: 
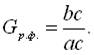
Аналіз кривих охолодження
На рис. 3.2 зображені криві охолодження для чистих металів (Pb, Sb) I, V та їх сплавів II, III, IV.
Прáвило фаз, або правило Гіббса - співвідношення, що пов'язує кількість різних речовин (компонентів), фаз і термодинамічних ступенів свободи у гетерогенній системі (у стані термодинамічної рівноваги). Цим правилом користуються для знаходження у певному пункті фазової діаграми найвищого значення кількості термодинамічних ступенів свободи.
Для аналізу кривих охолодження застосовують правило фаз (закон Гіббса), яке виражається формулою
С = К- Ф + 1,
де: С - число ступенів вільності, тобто число зовнішніх факторів (температура, концентрація), які можна змінювати без зміни числа фаз в сплаві; К - число компонентів ( в сплавах свинець - сурма К = 2, це свинець і сурма); Ф - число фаз.
Температура плавлення чистого свинцю - 327 °С, сурми - 630 °С.
Доевтектичному сплаву (6 % Sb, 94 % Pb) відповідає крива II. Вище точки 1 сплав знаходиться в рідкому стані і має одну фазу, тоді С = 2-1+1=2. При двох ступенях вільності в цій області можна змінювати концентрацію та температуру, а сплав залишиться однорідним – рідким. Крива охолодження круто спадає вниз.
Точка 1 - початок кристалізації, точка 2 - закінчення кристалізації. В інтервалі температур від точки 1 до точки 2 проходить утворення кристалів свинцю, на цій ділянці сплав являє собою суміш рідини і кристалів свинцю. Тобто між точками 1 і 2 існує дві фази - рідка і тверда: С = 2-2+1=1. При одному ступені вільності незалежною змінною є тільки температура. Із зменшенням температури сплаву кристалів утворюється більше, рідини залишається менше.
На ділянці 2-2? залишки рідини кристалізуються в механічну суміш свинцю та сурми – евтектику, де матимемо три фази (кристали свинцю, кристали сурми і рідкий сплав). Число ступенів вільності С = 2-3+1=0. При цьому виділяється велика кількість теплоти і температура залишається постійною.
Нижче точки 2 сплав знаходиться повністю в твердому стані і його структура складається з кристалів свинцю та евтектики (дрібнодисперсної суміші кристалів свинцю та сурми). Таким чином, сплав в даній області складається з двох фаз - кристалів свинцю і сурми: С=2-2+1=1.
Крива III – охолодження евтектичного сплаву ( 13 % Sb, 87 %Pb). Евтектичний сплав має криву охолодження аналогічну кривій чистого металу, тільки із більш швидким охолодженням розчину. Кристалізація протікає при сталій температурі і концентрації (в точці С). Утворюється механічна суміш компонентів (свинцю та сурми).
Заевтектичному сплаву відповідає крива IV. Точка 1 відповідає початку кристалізації, 2 - кінцю кристалізації. В інтервалі температур від 1 до 2 проходить утворення кристалів сурми. На цій ділянці сплав являє собою суміш рідини та кристалів сурми. Із зниженням температури сплаву кристалів утворюється більше, рідини залишається менше. На ділянці 2-2? залишок рідини кристалізується в механічну суміш кристалів свинцю та сурми (евтектику) (eutectic).
Схеми мікроструктури сплавів після охолодження показані на рис. 3.3.
Схеми мікроструктури: а – чистий свинець, б - доевтектичний сплав, в – евтектичний слав, г - заевтектичний сплав.
Аналіз мікроструктури показує, що залежно від концентрації компонентів змінюється мікроструктура сплаву.
Діаграма стану дає можливість визначити стан сплаву при будь-якій температурі та заданій концентрації.
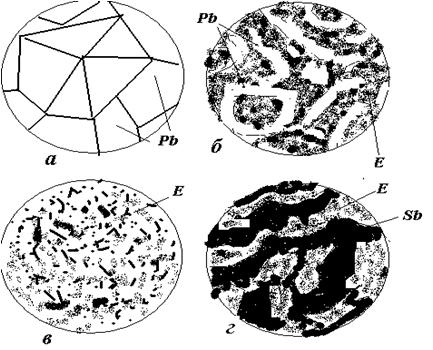
Рисунок 3.3 – Структура сплавів свинець – сурма:
а – чистий свинець; б – доевтектичний сплав;
в – евтектичний сплав; г – заевтектичний сплав