Окислювання.
Окислювання застосовують для знешкодження стічних вод, що містять токсичної домішки (ціаніди, комплексні ціаніди міді і цинку) чи з'єднання, що недоцільно витягати зі стічних вод, а також очищати від них воду іншими методами (сірководень, сульфіди). Такі стічні води зустрічаються в цехах гальванічних покрить, збагачувальних фабриках, нафтопереробної і нафтохімічної промисловості і т.д. У практиці знешкодження стічних вод як окислювачі використовують хлор, хлорне вапно, гіпохлорід кальцію і натрію, диоксид хлору, озон, технічний кисень і кисень повітря. Крім того, можуть бути використані перекис водню, біхромат калію, перманганат калію.
Найбільше широко використовується хлор і його з'єднання. Це один з розповсюджених способів окислювання отрутних ціанідів, а також таких органічних і неорганічних з'єднань, як сірководень, гідросульфід, сульфід, меркаптан.
Стічні води, що містять отрутні ціаніди, утворяться в гальванічних цехах. Окислювання отрутних CN- - іонів здійснюється шляхом перекладу їх у нетоксичні ціанати CNO-, що потім у воді гідролизуються з утворенням іонів амонію і карбонатів.
Окислювання ціанідів хлорним вапном протікає по рівнянню:
KCN + CaCl2O = KCNO + CaCl2.
Ціанат калію, що утвориться, гідролизується:
KCNO + 2H2O = KHCO3 + NH3.
При застосуванні хлору як окислювач реакція протікає в лужному середовищі:
NaCN + 2NaOH + Cl2 = NaCNO + 2NaCl + H2O
2NaCNO + 2H2O = Na2CO3 + CO(NH2)2.
При окислюванні комплексного з'єднання ціаніду цинку, наприклад, гіпохлорідом відбувається реакція
[Zn(CN)4]2- + 4OCl- + 2OH-  4CNO- + 4Cl- + Zn(OH)2.
4CNO- + 4Cl- + Zn(OH)2.
Іон ціанату, що утвориться, піддається також гідролізу з утворенням нетоксичних з'єднань.
Хлорування застосовується і для окислювання стічних вод, що містять сірководень, сульфіди, меркаптан і інші.
У лужному середовищі хлор окисляє сульфіди до сульфатів:
Na2S + 4Cl2 + 8NaOH = Na2SO4 + 8NaCl + 4H2O.
У кислому і нейтральному середовищі можливе окислювання до сульфітів:
NaHS + 3Cl2 + 3H2O  NaHSO3 + 6HCl.
NaHSO3 + 6HCl.
Для окислювання сульфідів широко використовується кисень. Реакція окислювання йде в рідкій фазі при підвищених температурі і тиску. Реакція протікає через ряд послідовних стадій:
S2-  S
S  Sn
Sn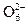
 S2
S2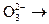 S
S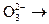 S
S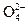 .
.
У процесі окислювання сірка змінює свою валентність від 2 до 6. Продукти окислювання визначаються умовами проведення реакцій.
На мал.37 приведена схема установки по окислюванню сульфідів стічних вод киснем повітря. Стічна вода, що містить сульфіди, надходить у прийомний резервуар і через теплообмінник подається в окисну колону. Повітря подається в нижню частину колони. Волога з відпрацьованого повітря конденсується в сепараторі і направляється в прийомний резервуар. Стічні води після окислювання прохолоджуються і направляються на подальше очищення.
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |




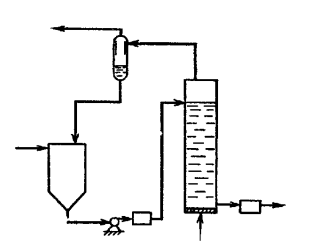
Мал.37. Установка по окислюванню сульфідів.
1.Прийомний резервуар; 2.Теплообмінник; 3.Окисна колона; 4.Повітророзподільна система; 5.Сепаратор; 6.Холодильник; 7.Подача стічної рідини; 8.Відвід очищеної стічної рідини; 9.Відвід відпрацьованого повітря; 10.Конденсат; 11.Подача повітря.
Для очищення стічних вод широко використовується озон, що є сильним окислювачем. Проведені численні дослідження з окислювання різних органічних забруднень озоном показали ефективність цього способу при обробці водяних розчинів, що містять феноли, ціклопентан, циклогексан, тетраэтілсвинец, нафтенові і сульфонафтенові кислоти, ціаніди крезолу, ПАВ і багато хто інші. Як приклад можна привести реакції окислювання сірководню.
H2S + O3  S + O2 + H2O
S + O2 + H2O
3H2S + 4O3  3H2SO4 .
3H2SO4 .
Реакції протікають одночасно, але при надлишку озону переважає друга.
ЛЕКЦІЯ 20