Индикаторы для титрования по кислотно-основному методу
| Условия титрования | рН в точке эквивалент-ности | Индикатор | Приготовление раствора индикатора |
| Сильную кислоту титруют слабым гидрокси-дом или слабый гидроксид титруют сильной кислотой | рН < 7 (слабокисл. среда) | Метиловый красный (интервал перехода при рН 4,4 – 6,2) Метиловый оранжевый (интервал перехода при рН 3,1 – 4,4) Лакмус (интервал перехода при рН 5,0 – 8,0) | Метиловый красный: 0,02 г сухого метилового красного на 100 см3 спирта Метиловый оранжевый: 0,05г метилового оранжевого на 100 см3 воды Лакмус: 1,90 г сухого лакмуса на 100 см3 воды |
| Слабую кислоту титруют сильным гидрокси- дом или сильный гидроксид титруют слабой кислотой | рН > 7 (слабощелочная среда) | Фенолфталеин (интервал перехода при рН 8,0 – 10) | Фенолфталеин: 1 г сухого фенолфталеина на 100 см3 спирта |
| Сильную кислоту титруют сильным гидрокси-дом или сильный гидроксид титруют сильной кислотой | рН = 7 | Лакмус, метиловый оранжевый, метиловый красный, фенолфталеин, нейтральный красный | Нейтральный красный: 0,1 г сухого нейтрального красного на 70 см3 спирта + 30 см3 воды |
При выполнении анализов стандартизацию рабочих растворов проводят двумя способами: пипетированием и методом отдельных навесок.
Пипетирование заключается в следующем: на аналитических весах взвешивают навеску вещества, полностью переносят ее через воронку в мерную колбу, растворяют в небольшом количестве воды, раствор разбавляют водой до метки. Колбу закрывают и тщательно перемешивают. Аликвоту этого раствора отбирают пипеткой, помещают в коническую колбу и титруют. Проводят титрование трех одинаковых аликвот и для расчета берут средний результат (объем стандартного раствора, пошедшего на титрование).
При титровании отдельных навесок поступают следующим образом. Точную навеску вещества, рассчитанную на одно титрование, взвешивают на часовом стекле или в стакане объемом 100 - 150 см3, растворяют в небольшом объеме воды (20 - 30 см3) и оттитровывают. При этом способе титрования необходимо брать не менее двух навесок и вычислять среднее значение концентрации приготовленного раствора.
Способ отдельных навесок по сравнению со способом пипетирования более трудоемкий, но он более точен вследствие избежания ошибок, связанных с неточностью объема мерной колбы.
При измерении объемов необходимо помнить, что нельзя измерять малые объемы большими измерительными сосудами, а на титрование нельзя брать объемы раствора меньше 20 см3.
2. Перманганатометрический метод.
Метод перманганатометрии основан на окислении различных восстановителей раствором КМnО4, при этом Мn (VII) в составе иона МnО4– восстанавливается или до Мn (VI), или до Мn (IV), или до Мn (II). Степень восстановления марганца, а следовательно, и окислительные свойства раствора перманганата калия в большой степени зависят от среды, в которой протекает реакция. Так, в кислой среде Мn (VII) восстанавливается до Мn (II) по реакции:
МnО4– + 5е + 8Н+ = Мn2+ + 4Н2O Е° = + 1.51 В.
В слабощелочной и нейтральной - до Мn (IV), продуктом восстановления является МnO2 или Н2МnO3, которые выпадают в виде бурого осадка:
МnO4– + 3е + 2Н2O = МnО2¯ + 4OH– Е° = + 0,57 В.
В сильнощелочной среде - до Мn (VI):
МnO4– + e = МnO42– Е° = + 0,54 В
Так как окислительная способность КМnО4 в кислой среде выше, чем в нейтральной и щелочной средах, перманганатометрические определения чаще всего проводят в кислой среде.
Окислительно-восстановительные потенциалы указанных выше систем выражаются уравнением:
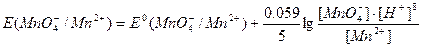
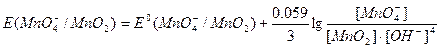
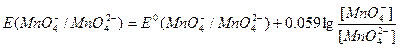
Из приведенных уравнений видно, что 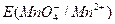 и
и 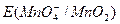 в значительной степени зависят от [Н+] или [ОН–], a
в значительной степени зависят от [Н+] или [ОН–], a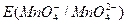 практически не зависит от среды раствора. В связи с высоким окислительным потенциалом КМnО4 в кислой среде его можно применять для окисления почти всех веществ, способных окисляться.
практически не зависит от среды раствора. В связи с высоким окислительным потенциалом КМnО4 в кислой среде его можно применять для окисления почти всех веществ, способных окисляться.
Для подкисления титруемых растворов чаще всего применяют серную кислоту, т. к. азотная кислота может способствовать возникновению нежелательных побочных процессов, а соляная кислота может восстанавливаться перманганатом калия или промежуточными окислами, которые образуются в ходе основной реакции.
В связи с тем, что прибавленная кислота не только создает определенную величину pН раствора, но и сама участвует в реакции, количество ее нельзя рассчитывать по стехиометрическому уравнению, а следует прибавлять в избытке.
При титровании перманганатом калия индикатор обычно не применяют т.к. его раствор имеет интенсивную окраску и избыточная капля окрашивает титруемый раствор в розовый цвет, появление которого свидетельствует о конце титрования. Для титрования очень разбавленными растворами КМnО4 применяют индикаторы, чаще дифениламин.
По методу перманганатометрии можно количественно определить окислители, восстановители, а также вещества, не обладающие ни окислительными, ни восстановительными свойствами, но способные взаимодействовать с окислителями или восстановителями.
Восстановители непосредственно титруют раствором КМnО4 т.е. определяют прямым титрованием. Так, прямым титрованием в кислой среде определяют щавелевую кислоту и ее соли, иодистоводородную, сернистую, сероводородную, азотистую кислоты, а также тиосульфаты, роданиды, многочисленные ионы металлов. При титровании раствором КМnО4 медленно окисляющихся восстановителей их растворы нагревают или прибавляют к титруемым растворам катализаторы, что способствует ускорению реакции.
Реакция КМnО4 с Na2C2O4 протекает согласно следующему суммарному уравнению:
5С2О42– + 2MnO4– + 16Н+ ® 10СО2 + 2Мn2+ + 8H2O
5С2О42– – 2е ® 2СO2 ½5
MnO4– + 5e + 8H+ ® Мn2+ + 4Н2O ½ 2
Практически данная реакция протекает в несколько стадий:
а) вначале перманганат очень медленно реагирует с щавелевой кислотой, вследствие чего и раствор долго остается окрашенным в малиново-фиолетовый цвет от нескольких капель раствора КМnО4,прибавленных к Н2С2О4;
б) затем наступает период, в течение которого малиново-фиолетовая окраска перманганата медленно исчезает. При этом образуются ионы двух-, трех- и четырех валентного марганца, слегка окрашивающие раствор в бурый цвет:
MnO4– ® МnО2 ® Мn3+ ® Мn2+
в) наконец, ионы марганца с промежуточной валентностью быстро окисляют щавелевую кислоту, превращаясь в Мn2+.
Нагревание и повышение [Н+] способствует быстрому течению указанной реакции окисления-восстановления. Ионы марганца низких степеней окисления оказывают каталитическое действие на реакции. При этом перманганат очень быстро обесцвечивается.
В общем процессы взаимодействия КМnО4 с Н2С2О4 можно схематически представить следующим образом:
а) очень медленная реакция: MnO4– + 5e + 8H+ ® Мn2+ + 4Н2O
б) быстрая реакция: 2MnO4– + 3Мn2+ + 16H+ ® 5Мn4+ + 8Н2O
в) быстрая реакция: Мn4+ + Мn2+ ® 2Мn3+
г) быстрая реакция: 2Мn4+ + С2О42– ® 2Мn3+ + 2СО2
в) более медленная, чем реакция (г): 2Мn3+ + С2О42– ® 2Мn2+ + 2СО2
3. Трилонометрический метод.
Этот метод основан на реакции образования прочных комплексных соединений ионов металлов с рядом комплексообразующих органических реактивов, получивших название комплексонов. Связывание определяемого катиона в комплекс происходит тем полнее, чем прочнее образующийся комплекс. Для этого титрование комплексонами проводят при строго определенных условиях, из которых наибольшее значение имеет рН титруемого раствора.
Метод комплексонометрии имеет ряд преимуществ:
1. Обладает высокой чувствительностью (до 10–3 моль/дм3).
2. Реакции протекают быстро и стехиометрично, т.е. в строго эквивалентных отношениях, что открывает широкие возможности применения комплексонов для определения большинства катионов, в том числе
кальция, магния, бария, индия и др., которые невозможно перевести в устойчивые комплексные соединения другими методами.
3. Обладает высокой избирательностью, что позволяет использовать метод
в химическом анализе различных сплавов, минералов, в частности силикатных материалов и вяжущих веществ.
В комплексонометрии используется прямое, обратное и заместительное титрование.
Методом прямого комплексонометрического титрования определяют Сu2+, Pb2 + , Co2+, Ni2+, Ba2+, Ca2+, Mg2 +, Sr2 + , Al3+, Fe2+, Fe3+ и многие другие катионы при определенном значении рН раствора.
В кислой среде проводят анализ лишь некоторых катионов: Fe3+, А13+, Se3+, Zn2+, образующих с комплексонами прочные комплексные соединения. Для обеспечения кислой среды в исследуемый раствор добавляют ацетатный буферный раствор (СН3СООН + CH3CООNa) или раствор минеральных кислот и их солей.
Большинство же катионов в кислой среде с комплексонами образуют очень не устойчивые комплексные соединения или совсем их не образуют. Поэтому титрование растворов определяемых катионов, за некоторым исключением, проводят в щелочной среде при рН = 8 – 13 . Для обеспечения щелочной среды в процессе титрования добавляют соответствующие буферные растворы щелочей NaOH и KOH. Например, при определениях в щелочной среде при рН = 8 – 10 добавляют аммонийный буферный раствор (NH3´H2O + NH4Cl). Для обеспечения сильнощелочной среды рН >10 в исследуемый раствор добавляют 20 % раствор щелочи КОН или NaOH.
Комплексоны представляют собой полиаминополикарбоновые кислоты и их производные. Известно более 200 комплексонов, из них наиболее важное значение в определении металлов имеет этилендиаминтетрауксусная кислота (ЭДТУ), сокращенно Н4Y, где Y4– – анион ЭДТУ, и особенно ее двунатриевая соль, известная под названием комплексона III (трилон Б), сокращенно Na2Н2Y·2H2O.
Этилендиаминтетрауксусная кислота четырехосновна:

 НООС СН2 СН2 СООН
НООС СН2 СН2 СООН
 N СН2 СН2 N
N СН2 СН2 N

 НООС СН2 СН2 СООН
НООС СН2 СН2 СООН
Четыре ступени диссоциации ее характеризуется следующими величинами констант:
К1 = 10–2, К2 = 1,8·10–3, К3 = 6,9·10–7, К4 = 5,5·10–11
Характер диссоциации определяется средой раствора: при рН > 12 кислота ионизирована полностью.
Комплексоны, имея в своем составе 6 функциональных групп (четыре карбоксильные и две аминные), отличаются полидентантностью, т.е. способностью одновременно образовывать несколько связей (координационных) с ионами металлов.
Комплексоны при определнном значении рН образуют устойчивые малодиссоциирующие растворимые в воде внутрикомплексные (клешневидные, хелатные) соединения почти со всеми двух-, трех- и четырех зарядными катионами, при этом образуются соединения типа [МеY]n–. Например, двухзарядный металл Ме2+ в комплексоне III замещает два атома водорода карбоксильных групп и одновременно связывается координационно с азотом аминогрупп, образуя при этом очень прочные пятичленные кольца:

 НООС СН2 СН2 СООН
НООС СН2 СН2 СООН
 N - СН2 - СН2 - N + Ме2+ «
N - СН2 - СН2 - N + Ме2+ «

 NaOOC СН2 СН2 СООNa
NaOOC СН2 СН2 СООNa
O = C - O O - C = O
 |  | ||||||
 |  | ||||||
« Н2С Me СН2 + 2H+
 | |||||||
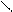 | 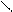 |  | |||||
N N
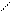 | 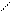 | ||||||
 |  |
 NaOOCСН2 СН2 СН2 СН2COONa
NaOOCСН2 СН2 СН2 СН2COONa
Трехвалентный металл замыкает еще одно кольцо с -СООН - группой. При этом образуется еще более прочный комплекс, т.к. их устойчивость зависит от заряда иона: чем выше заряд, тем устойчивее комплекс. В сокращенном виде взаимодействие комплексона III с металлами различной степени окисления можно представить следующими уравнениями:
Ме2+ + Na2H2Y = Na2MeY + 2H+
Ме3+ + Na2H2Y = NaMeY + 2H+ + Na+ Ме4+ + Na2H2Y = MeY + 2H+ + 2Na+
Из приведенных уравнений видно, что одна молекула комплексона реагирует только с одним катионом металла (независимо от степени его окисления). Таким образом, все реакции между комплексоном III и катионами отвечают стехиометрическому соотношению 1:1. (В комплексонометрии эквивалентная масса любого металла равна половине атомной массы).
Для установления точки эквивалентности используют:
а) специфические индикаторы - вещества, реагирующие только с определяемым ионом: например, Fe3+ титруют комплексоном III при рН = 2 в присутствии роданидов, салицилатов и других соединений, образующих с Fe3+ окрашенные продукты:
б) металл-индикаторы (иначе металлохромные индикаторы) - органические
красители, как правило, многоосновные кислоты, образующие с ионами
металлов окрашенные в яркий цвет комплексные соединения MeInd.
В процессе титрования комплексоном III менее прочные комплексные соединения MeInd разрушаются и образуются более прочные комплексы катиона с комплексоном. В точке эквивалентности первоначальный цвет комплексонного соединения MeInd исчезает и появляется окраска, свойственная свободному индикатору.
Важнейшими индикаторами, используемыми в комплексонометрии, является: эриохром черный “Т”, кислотный хром темно-синий и мурексид. Эриохром черный “Т” (ЭХЧ – Т) и кислотный хром темно-синий окрашены в синий цвет.
ЭХЧ – Т – трехосновная кислота, в водных растворах диссоциирует с образованием анионов Н2Ind–, НInd2–, Ind3– различной окраски. Переход анионов друг в друга сопровождается изменением окраски:
Н2Ind– « НInd2– « Ind3–
красный синий желто-оранжевый
Применяется при титровании металлов при рН = 7 – 11. В этом интервале рН сам индикатор имеет синий цвет, а образуемые им комплексы, например, с Mg2 +, Ca2+, Mn2+, Zn2+, Pb2+, Al3+, Сu2+, Cd2+ и др., имеют красный цвет. При титровании катиона комплексоном III красная окраска комплекса [МеInd]n– переходит в синюю, присущую свободному индикатору. Схематично процесс титрования солей Ca2+ при ЭХЧ – Т можно представить следующим образом:
НInd2– + Ca2+ « CaInd– + Н+
синий красный
CaInd– + Na2H2Y + ОН – ® Na2СаY + НInd2– + Н2О
красный синий