И ВНУТРЕННЯЯ ЭНЕРГИЯ
Работа совершается только при изменении объема газа. Если происходит расширение газа, то работа совершается против внешних сил; при сжатии, наоборот, газ воспринимает работу внешних сил. В соответствии с этим работа расширения газа положительна, а работа сжатия – отрицательна.
В rJ-диаграмме (рис. 2) кривая 1-2 изображает процесс расширения газа, а кривая 2-1 – процесс сжатия.
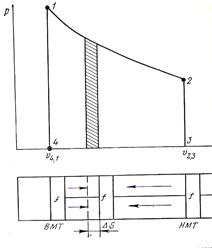 |
Рис. 2. Работа расширения газа в rJ-диаграмме.
Пусть в цилиндре тепловой машины перемещается без трения поршень площадью f от верхней мертвой точки (ВМТ) 1 к нижней мертвой точке (НМТ) 2. Перемещение происходит под действием расширяющегося газа с давлением r. Так как работа силы, действующей в направлении движения точки ее приложения, определяется произведением величины этой силы на пройденный путь, то элементарная работа Dℓ при перемещении поршня на величину Ds составит
Dℓ = pf Ds = p DJ (36)
Следовательно, работа расширения газа в процессе 1-2 в rJ-диаграмме измеряется площадью, ограниченной кривой 1-4 и 2-3 и отрезком 4-3 оси абсцисс. Диаграмма называется рабочей. Поскольку величина площади 1-2-3-4 зависит от того пути, по которому протекает процесс между точками 1 и 2, то и работа расширения газа не является функцией состояния, а является функцией процесса. Кроме того, работа всегда связана с перемещением тел в пространстве, например поршня в цилиндре двигателя, вала турбины, поэтому она характеризует упорядоченную форму передачи энергии (макроскопическую) и является мерой энергии.
Молекулы газа, находящиеся в состоянии непрерывного хаотического движения, обладают внутренней энергией, которая включает в себя: 1) кинетическую энергию поступательного, вращательного и колебательного движения молекул, зависящую от температуры; 2) потенциальную энергию взаимодействия молекул, зависящую от расстояния между ними и от их взаимного расположения.
Работа в системе СИ измеряется в джоулях (Дж), удельная работа (то есть работа, отнесенная к 1 кг газа) – в Дж/кг.
Формула внутренней энергии:
Du = Duк + Dun.
В идеальных газах силы взаимодействия между молекулами отсутствуют, поэтому внутренняя энергия идеального газа равна кинетической энергии теплового движения молекул:
Du = Duк.
Изменение внутренней кинетической энергии определяется изменением температуры газа от Т1 в начале процесса до Т2 в конце процесса:
Du = f(T2) – f(T1).
Внутренняя энергия измеряется в Дж/кг.
В любом термодинамическом процессе изменение внутренней кинетической энергии идеального газа равно ее изменению в процессе, протекающем при постоянном объеме (J = const), поскольку в этом случае вся теплота, сообщаемая газу, затрачивается на изменение внутренней энергии:
u2 – u1 = Du = cJ (T2 – T1).
В технической термодинамике определяется не абсолютное значение внутренней энергии, а ее изменение при переходе газа из состояния 1 в состояние 2. Следовательно, отсчет внутренней энергии может производиться от любого условного нуля. Для идеальных газов внутреннюю энергию считают равной нулю при нормальных условиях (t = 0 0C, r = 760 мм рт. ст.).