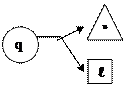Результаты анализа политропных процессов
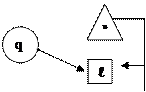
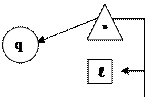
| Группа | Пределы изменения показателя политропы | Изменение внутренней энергии | Подвод (отвод) теплоты | Теплоемкость процессов | Графическое выражение первого закона | |||||||
| I – ¥ < n < 1 Du > 0 q > 0 cп > 0 II 1 < n < k Du < 0 q > 0 cп < 0 III k < n < + ¥ Du < 0 q < 0 cп > 0 |

|
Первая группа включает процессы (см. рис. 7), расположенные между изохорой с подводом теплоты (n = – ¥) и изотермой (n = 1), то есть все процессы расширения с покатазетем политропы – ¥ < n < 1.
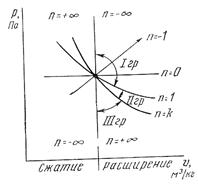 |
Рис. 7. Частные случаи политропного процесса в rJ-диаграмме.
Теплота подводится + q: часть ее расходуется на работу расширения (ℓ), а другая часть – на изменение внутренней энергии газа Du. По мере удаления от изохоры (n = – ¥) и приближения к изотерме (n = 1), то есть с увеличением показателя n, доля подводимой теплоты, затрачиваемая на работу, возрастает.
Теплоемкость процессов этой группы положительная.
Вторая группа политропных термодинамических процессов расположена между изотермой расширения (n = 1) и адиабатной (n = k), то есть в эту группу входят процессы с показателем политропы 1 < n < k. Теплота подводится, но работа расширения совершается также частично за счет внутренней энергии газа (Du). В процессах этой группы температура газа уменьшается. При приближении к адиабате (n = k) все большая часть работы расширения совершается за счет уменьшения внутренней энергии. Теплоемкость процессов этой группы отрицательна.
Третья группа процессов расположена в области между адиабатой расширения (n = k) и изохорой с отводом теплоты (n = + ¥). Следовательно, в эту группу входят политропные процессы с показателем k < n < + ¥. Теплота не подводится. Работа расширения газа совершается за счет внутренней энергии, но, кроме того, часть внутренней энергии отводится в виде теплоты. Теплоемкость политропных процессов этой группы положительна.
Контрольные вопросы и задания. 1. Назовите основные термодинамические процессы. 2. В чем измеряется удельная энтропия и как подсчитывают ее изменение? 3. Объясните Ts-диаграмму. 4. Каким уравнением определяется изменение внутренней энергии идеального газа в термодинамическом процессе? 5. В каком процессе вся подведенная теплота расходуется на изменение внутренней энергии, а в каком – на работу расширения? 6. Укажите значение энтальпии h и ее размерность. 7. Нужно ли подводить теплоту при изотермическом расширении?