Модели атомного ядра
Развитие исследований радиоактивного излучения, с одной стороны, и квантовой теории - с другой, привели к созданию квантовой модели атома Резерфорда - Бора. Но созданию этой модели предшествовали попытки построить модель атома на основе представлений классической электродинамики и механики. В 1904 году появились публикации о строении атома, одни из которых принадлежали японскому физику Хантаро Нагаока, другие - английскому физику Д.Д.Томсону. Нагаока представил строение атома аналогичным строению солнечной системы: роль Солнца играет положительно заряженная центральная часть атома, вокруг которой по установленным кольцеобразным орбитам движутся "планеты" - электроны. При незначительных смещениях электроны возбуждают электромагнитные волны.
В атоме Томсона положительное электричество "распределено" по сфере, в которую вкраплены электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию определяющей химические свойства атомов. Он предпринял попытку теоретически объяснить периодическую систему элементов Д.И.Менделеева. Но вскоре оказалось, что новые опытные факты опровергают модель Томсона .
Резерфорд, усомнившись в этой модели, провёл опыты по изучению рассеяния a-частиц. Его опыт состоял в следующем. Схема этого эксперимента Резерфорда приведена на рисунке 1.1.
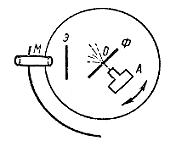
Рисунок 1.1. Схема эксперимента Резерфорда.
Αльфа-частицы, излучаемые источником А, пролетев сквозь щель, попадали на экран из сернистого цинка Э. На экране возникало четкое изображение щели в виде узкой полоски.
Затем между щелью и экраном помещалась тонкая металлическая пластина, вернее, - тонкая золотая фольга Ф. При этом изображение щели на экране размывалось, что и указывало на рассеяние α-частиц веществом пластинки.
Именно в этом эксперименте был установлен поразительный факт: очень небольшая часть α-частиц (примерно 1 из 10000!) рассеивалась на значительный угол, отбрасывалась практически назад - к источнику. Позднее статистическая обработка результатов исследования рассеяния α - частиц позволила рассчитать линейный размер ядра атома. Он, по оценке Резерфорда, составил 10-15 м.
Планетарная модель атома с центральным положительно заряженным ядром и с электронами, вращающимися вокруг него по круговым орбитам, была лишь качественным представлением строения атома.
При изучении  - частиц Резерфорд, исходя из модели Томсона, подсчитал, что рассеивание
- частиц Резерфорд, исходя из модели Томсона, подсчитал, что рассеивание 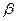 - частиц не может давать больших углов отклонений даже при многих столкновениях с частицей. И здесь Резерфорд обратился к планетарной модели. 7 марта 1911 года Резерфорд сделал в философском обществе в Манчестере доклад "Рассеяние
- частиц не может давать больших углов отклонений даже при многих столкновениях с частицей. И здесь Резерфорд обратился к планетарной модели. 7 марта 1911 года Резерфорд сделал в философском обществе в Манчестере доклад "Рассеяние 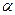 и
и 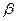 -лучей и строение атома". В докладе он, в частности, говорил: "Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве
-лучей и строение атома". В докладе он, в частности, говорил: "Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве 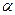 и
и 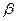 -частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала". Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным ±Ne. Заряд оказался пропорциональным атомному весу. "Точное значение заряда центрального ядра не было определено,- писал Резерфорд, - но для атома золота оно приблизительно равно 100 единицам заряда".
-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала". Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным ±Ne. Заряд оказался пропорциональным атомному весу. "Точное значение заряда центрального ядра не было определено,- писал Резерфорд, - но для атома золота оно приблизительно равно 100 единицам заряда".
Резерфорд постулировал движение электронов по круговым орбитам, так как статическая модель атома с неподвижными зарядами оказывалась неустойчивой системой.
Но движущиеся по круговой орбите электроны, должны излучать энергию. Ведь согласно законам классической электродинамики, любой ускоренно движущийся заряд является источником электромагнитных волн. Такое непрерывное излучение энергии должно было очень быстро привести к истощению энергии атома и к падению электрона на ядро.
Такое рассеяние a-частиц нельзя объяснить, исходя из модели атома Томсона. Поэтому Резерфорд предложил другую модель строения атома, названную ядерной. Согласно этой модели, атом состоит из ядра, в котором сосредоточена почти вся масса атома и обладающего положительным зарядом, вокруг которого вращаются электроны, имеющие отрицательный заряд. При этом размеры ядра много меньше размеров атома и заряд ядра равен суммарному заряду электронов по абсолютной величине.
Из последующих исследований и экспериментов Гейгера и Мардсена, предпринявших проверку формул Резерфорда, возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным (Резерфорд считал знак заряда неопределенным) зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу.
Заряд ядра оказался важнейшей характеристикой атома. В 1913 году было показано, что заряд ядра совпадает с номером элемента в таблице Менделеева. После знакомства с Резерфордом Бор, отказавшись от изучения электронной модели, начал работу в его группе. Обратившись к планетарной модели, Бор создал на ее основе теорию атома Резерфорда-Бора. Резерфорд понял революционный характер идей Бора и обсудил с ним основы этой теории, высказал критические замечания, после чего статьи Бора были опубликованы. Во время Первой Мировой войны Бор продолжает работать в лаборатории Резерфорда. В 1915 году он опубликовал работы "О сериальном спектре водорода" и "О квантовой теории излучения в структуре атома". В 1916 году была опубликована статья Зоммерфельда, где он рассмотрел движение электрона по эллиптическим орбитам и обобщил правила квантования Бора. Бор с восторгом отозвался об этой статье. Теория атома после открытий Зоммерфельда стала называться теорией Бора - Зоммерфельда. В 1936 году Бор выступил со статьей "Захват нейтрона и строение ядра", в которой предложил капельную модель ядра и механизм захвата нейтрона ядром. Странно, но ни Бор, ни другие не могли сразу предсказать деление ядра, подсказываемое капельной моделью, пока в начале 1939 г. не было открыто деление урана.
Капельная модель основана на аналогии между поведением молекул в капле жидкости и нуклонов в ядре – короткодействие ядерных взаимодействий, одинаковая плотность ядерного вещества в разных ядрах (несжимаемость), свойство насыщения ядерных сил. Она трактует ядро как каплю электрически несжимаемой жидкости, подчиняющуюся законам квантовой механики.
Капельная модель объяснила механизмы ядерных реакций, особенно реакции деления ядер, а также позволила получить полуэмпирическую формулу для энергии связи нуклонов в ядре.
Оболочечная модель - это модель, в которой нуклоны считаются движущимися независимо друг от друга в усредненном центрально – симметричном поле. В соответствии с этим имеются дискретные энергетические уровни, заполняемые нуклонами с учетом принципа Паули.
Эти уровни группируются в оболочки, в каждой из которых может находиться определенное число нуклонов.
Ядра с полностью заполненными оболочками являются наиболее устойчивыми – это, так называемые, магические ядра, у которых число протонов Z или нейтронов N равно одному из магических чисел: 2, 8, 20, 28, 50, 82, 126.
Ядра, у которых магическими являются и Z, и N, называются дважды магическими.
В 1932 году Д.Д.Иваненко опубликовал заметку, в которой высказал предположение, что нейтрон является наряду с протоном структурным элементом ядра. Однако протонно-нейтронная модель ядра была встречена большинством физиков скептически. Даже Резерфорд полагал, что нейтрон - это лишь сложное образование протона и электрона. В 1933 году Иваненко на конференции в Ленинграде сделал доклад о модели ядра, в котором он защищал протонно-нейтронную модель, сформулировав основной тезис: в ядре имеются только тяжелые частицы. Иваненко отверг идеи о сложной структуре нейтрона и протона. По его мнению, обе частицы должны обладать одинаковой степенью элементарности, т.е. и нейтрон, и протон могут переходить друг в друга. В дальнейшем протон и нейтрон стали рассматриваться как два состояния одной частицы - нуклона, и идея Иваненко стала общепринятой, а в 1932 году в составе космических лучей была открыта еще одна элементарная частица - позитрон.