Кристаллические вещества
К кристаллическим веществам относят все металлы и металлические сплавы.
Кристалл состоит из множества сопряженных друг с другом элементарных кристаллических ячеек. В элементарной кристаллической ячейке содержится наименьшее число атомов.
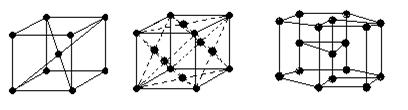
Для описания структуры кристаллических тел пользуются понятием пространственной кристаллической решетки, которая представляет собой пространственную сетку, в узлах которой располагаются частицы, образующие твердое тело (рис. 1.1).
а б в
Рис. 1.1. Основные типы кристаллических решеток металлов:
а – кубическая объемно центрированная;
б – кубическая гранецентрированная;
в – гексагональная
В узлах ковалентных (атомных) решеток находятся нейтральные атомы, которые связаны друг с другом ковалентной связью.
В узлах металлических решеток расположены положительные ионы, в промежутках между которыми находятся свободные электроны. Они образуют решетку с помощью металлических связей.
В узлах молекулярных решеток находятся молекулы. Такие решетки образуются за счет ковалентной и ионной связей.
Каждое вещество обычно образует кристаллы определенной формы. Порядок взаимного расположения атомов в кристалле может быть различен.
Простейшим типом элементарной кристаллической ячейки является простая кубическая решетка. Размеры кристаллической решетки характеризуются ее параметрами. Под параметром решетки понимают расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку. Эти расстояния очень малы и измеряются в нанометрах или ангстремах (1А=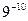 м). Параметр кубической решетки обозначается буквой а и находится в пределах 0,28-0,6 нм. Параметр решетки хрома равен 2,9 Å, алюминия – 4,04 Å. Следовательно, в кристаллическом веществе на 1 мм размещаются десятки миллионов атомов.
м). Параметр кубической решетки обозначается буквой а и находится в пределах 0,28-0,6 нм. Параметр решетки хрома равен 2,9 Å, алюминия – 4,04 Å. Следовательно, в кристаллическом веществе на 1 мм размещаются десятки миллионов атомов.
Стремление атомов металлов к сближению и уплотнению приводит к образованию более сложных типов решеток. Наиболее распространенными типами кристаллических решеток являются:
кубическая объемно центрированная (рис 1.1, а), ее имеют α - железо, хром, вольфрам, ванадий;
кубическая гранецентрированная (рис. 1.1, б), ее имеют γ - железо, медь, алюминий;
гексагональная (рис. 1.1, в), ее имеют бериллий, кадмий, магний и др. металлы.
Наиболее плотно и компактно размещены атомы гексагональной и кубической гранецентрированной решеток.
Упорядоченное расположение атомов в кристаллах приводит к различному расположению и плотности атомов в разных направлениях. Этим обусловлено различие свойств металлов в разных направлениях.
Изменение свойств кристаллов (металлов) в зависимости от направления называют анизотропией. Степень анизотропности свойств металлов может быть значительной. Например, предел прочности на растяжение у меди изменяется от 120 до 360 МПа, а относительное удлинение при растяжении (∆l/l=10) – до 55%.
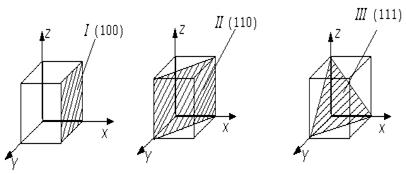
Однако промышленные сплавы обычно состоят из большого числа кристаллов, кристаллические решетки которых по-разному ориентированы в пространстве, поэтому свойства сплавов не зависят от направлений в кристаллических решетках (индексы Миллера). Кристаллографические плоскости и их индексация представлены на рис. 1.3.