Спектры поглощения и спектры испускания
Если между раскаленным источником света и дифракционной решеткой поместить пары металлов или каких-либо других атомов, то на фоне сплошного спектра появятся узкие темные линии (рис. 26а). Такие темные линии называют спектром поглощения. Каждый сорт атомов дает свой спектр поглощения, то есть свой характерный набор линий.
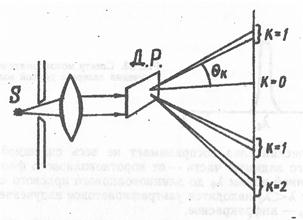
Рис. 25. Разложение света в спектр дифракционной решеткой (ДР)
Если в качестве источника использовать раскаленные пары атомов, то оказывается, что их спектр испускания состоит из большого числа отдельных линий той или иной яркости (рис. 26б). При этом положение этих ярких линий, то есть их длина волны λl, в точности совпадает с положением темных линий в спектре поглощения этих атомов. Иными словами, спектры поглощения и испускания данного сорта атомов совпадают (законы Кирхгофа). Каждый сорт атомов в раскаленном состоянии излучает характерный спектр, поэтому по спектрам испускания (или поглощения) можно определить состав атомов, излучающих свет.
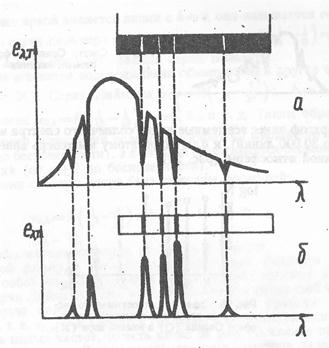
Рис. 26. Спектры поглощения (а) и испускания (б) атомов
Впервые яркие линии в спектрах излучения атомов обнаружил английский физик Тальбот в 1834 г. Поместив крупинки поваренной соли NaCl в пламя свечи, он обнаружил яркую желтую линию (это была одна из линий спектра излучения Na), а поместив в пламя монохлорид стронция SrCl — увидел красную линию (это одна из линий Sr). Тальбот писал: «Можно ожидать, что оптические исследования позволяют различать малейшие количества веществ точнее, чем химические способы». Действительно, современный спектральный анализ обладает огромной чувствительностью (он определяет наличие ~10-10 г вещества) и широко используется в промышленности и наук