ПРОГРАМА РОБОТИ
2.1 Зобразити діаграму стану Pb-Sb та Cu-Ni, проставити температуру, концентрацію та написати структури та фази, які знаходяться в зонах діаграми.
2.2 Проаналізувати сплави заданої концентрації та побудувати криві охолодження із застосуванням правила фаз.
2.3 Застосовуючи правило відрізків, визначити кількісний та якісний склад кожної фази в сплаві заданої концентрації при заданій температурі.
2.4 Скласти звіт про роботу та зробити висновки.
3 ПИТАННЯ ДЛЯ САМОПІДГОТОВКИ
3.1 Зони діаграм.
3.2 Перетворення, які відбуваються на лініях діаграм.
3.3 Правило фаз та його застосування при аналізі сплавів.
3.4 Правило відрізків та його застосування при визначені кількісного та якісного складу фаз в сплавах різної концентрації при різних температурах. [1, с.118-124; 3, с.23-28]
4 ТЕОРЕТИЧНІ ВІДОМОСТІ
Діаграма стану сплавів двох компонентів, які володіють повною взаємною розчинністю у рідкому стані, і не розчиняються в твердому стані та утворюють евтектику.
Практичним прикладом діаграм такого типу є діаграма стану сплавів свинцю з сурмою.
Проводячи на цій діаграмі вертикаль, яка відповідає будь - якому складу сплавів, за точками перетину її з лініями діаграм, визначають температуру початку або кінця твердіння або температуру плавлення будь - яких сплавів свинцю з сурмою. Лінія АВС
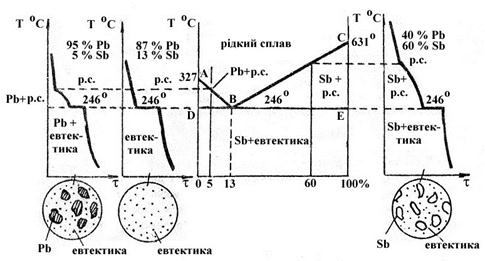
(рисунок 1) є кривою початку твердіння або ліквідус; вище неї усі сплави свинцю з сурмою знаходяться тільки в виді однорідного рідкого розчину. В області, обмеженою фігурою DАВ, сплави знаходяться у виді кристалів свинцю та рідкого сплаву, а в області, обмеженою фігурою ВСЕ, у виді кристалів сурми та рідкого сплаву. Лінія DВЕ є кривою кінця твердіння, або солідус; нижче цієї лінії сплави повністю знаходяться тільки у твердому стані; нижче лінії DB вони складаються з кристалів свинцю та евтектики; нижче точки С – з однієї евтектики; нижче лінії BЕ – з кристалів сурми та евтектики.
Рисунок 1 – Криві охолодження, структури та діаграма стану
сплавів свинцю із сурмою
Евтектика являє собою механічну суміш кристалів свинцю та сурми.
Сплав з 5%Sb твердіє в інтервалі температур та має на кривій охолодження дві критичні точки. Перша (перегин кривої охолодження) відповідає початку виділення з рідкого сплаву кристалів свинцю, яке продовжується до 246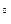 С. В процесі виділення кристалів свинцю рідкий сплав, що залишився, збагачується сурмою до евтектичного складу, тому остаточно твердіє при вказаній евтектичній температурі, яка відповідає горизонтальній ділянці кривої охолодження. Внаслідок цього мікроструктура сплаву, що затвердів, складається з кристалів свинцю та евтектики.
С. В процесі виділення кристалів свинцю рідкий сплав, що залишився, збагачується сурмою до евтектичного складу, тому остаточно твердіє при вказаній евтектичній температурі, яка відповідає горизонтальній ділянці кривої охолодження. Внаслідок цього мікроструктура сплаву, що затвердів, складається з кристалів свинцю та евтектики.
Сплав з 13%Sb та 87%Pb є евтектичним; його крива охолодження має одну критичну точку, яка відповідає евтектичному перетворенню при 246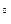 С. Евтектичний сплав при дослідженні під мікроскопом виявляє характерну структуру з суміші кристалів свинцю та сурми.
С. Евтектичний сплав при дослідженні під мікроскопом виявляє характерну структуру з суміші кристалів свинцю та сурми.
Сплав, збагачений сурмою (60%Sb), також твердіє в інтервалі температур та має на кривій охолодження дві критичні точки. Перша відповідає початку виділення з рідкого сплаву кристалів сурми, яка в цьому випадку продовжується до 246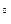 С. Рідка фаза даного сплаву збагачена свинцем, внаслідок виділення кристалів сурми до евтектичного складу твердіє при температурі другої критичної точки, яка відповідає горизонтальній ділянці на кривій охолодження та в результаті утворюється структура з кристалів сурми та евтектики.
С. Рідка фаза даного сплаву збагачена свинцем, внаслідок виділення кристалів сурми до евтектичного складу твердіє при температурі другої критичної точки, яка відповідає горизонтальній ділянці на кривій охолодження та в результаті утворюється структура з кристалів сурми та евтектики.
Аналіз сплавів робиться із застосуванням правила фаз.
Правило фаз визначає число ступенів свободи С рівноважної систем в залежності від числа компонентів К та числа фаз Ф:
С = К – Ф + 1
Компонентом називається незалежна складова частина системи, яка може бути або хімічним елементом, або хімічною сполукою. К – кількість компонентів, утворюючих систему.
Фазою називається однорідна частина системи, відділена від інших частин (фаз) поверхнею розділу. Фазами можуть бути як самі компоненти, так і їх хімічні сполуки, тверді та рідкі розчини.
Числом ступенів свободи звуть число можливих варіантів змін температури, тиску та концентрації фаз без зміни числа фаз в системі.
Застосовуючи правило фаз до діаграми сплавів свинцю з сурмою, у яких число компонентів рівне 2, отримуємо:
С = 2 +1 – Ф = 3 – Ф.
Вище лінії АВС, де усі сплави знаходяться у однорідному стані, Ф = 1 та число ступенів свободи С = 3 – 1 = 2 . Тут система двохваріантна, тому можна змінювати і температуру, і концентрацію сплаву, не змінюючи її рівноваги – сплав буде залишатися рідким.
Усередині трикутника DAВ сплави складаються з кристалів свинцю та рідкого сплаву, тобто з двох фаз Ф = 2 при числі ступенів свободи С = 3 – 2 = 1. Тут система одноваріантна, що дозволяє свавільно змінювати, зберігаючи рівновагу сплаву, або температуру, або концентрацію, залишаючи залежною другу змінну.
В евтектичній точці В розрізняють три фази: рідкий сплав та евтектика, яка складається з механічної суміші кристалів свинцю та сурми. Отже, тут Ф =3 та число ступенів свобода С = 3 – 3 = 0, тобто система безваріантна і будь-яка зміна температури або концентрації викличе порушення рівноваги.
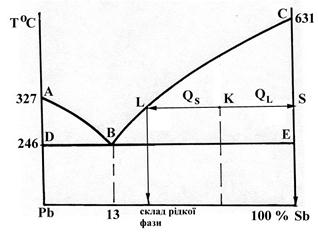 |
Склад присутніх у сплаві свинцю з сурмою фаз та відносна їх кількість на діаграмі (рисунок 2) визначається за правилом відрізків таким чином: через задану точку К, яка відповідає даному сплаву, проводять на рівні заданої температури горизонталь (коноду) до перехрещення її з лінією ліквідус. Проекція точки перехрещення горизонталі з лінією ліквідус L на вісь концентрацій вкаже склад рідкої фази.
Рисунок 2 - Діаграма стану сплаву Pb – Sb
Тверда фаза складається з чистої сурми (точка S).
Співвідношення між ваговою кількістю твердої фази QS та рідкої фази QL визначається таким чином:
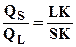
Довжини відрізків (плечі важеля),які відповідають фазам, слід брати у напрямку, обернено розташуванню фаз на діаграмі (рисунок 2)
Діаграма стану сплавів повної взаємної розчинності як в рідкому, так і в твердому стані.
Ця діаграма відноситься до другого типу. Розглянемо її на прикладі діаграми стану сплавів мідь – нікель (Рисунок 3).
Сплави різних концентрацій твердіють у деякому інтервалі температур та мають на кривих охолодження дві критичні точки (два перегини). У проміжку між ними, тобто між початком "а" та кінцем "b" твердіння, з рідкого сплаву випадають кристали твердого розчину.
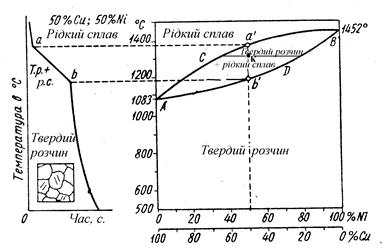 |
Рисунок 3 – Діаграма стану сплавів мідь – нікель
Верхня лінія діаграми АСВ відповідає початку кристалізації та має назву ліквідус, вище неї сплави знаходяться у рідкому стані. Нижня лінія ADB - кінець кристалізації та зветься солідус, нижче неї всі сплави знаходяться у твердому стані. Таким чином, вище лінії АСВ сплави нікелю з міддю складаються з однорідного рідкого сплаву, нижче лінії АDB – з одного твердого розчину.
Застосовуючи правило фаз до діаграми цього типу, одержуємо вище лінії АСВ та нижче лінії АDB одну фазу при двох компонентах (С = 3 – 1 = 2), інакше кажучи, система двохваріантна. Усередині площини АСВDA присутні дві фази. Тут С = 3 – 2 = 1, тобто система одноваріантна.
Згідно з правилом відрізків, кількість фаз у точці К визначається проведенням горизонтальної лінії через цю точку до перетину з лініями ліквідус та солідус. Ці точки перетину вкажуть концентрацію рідкої фази та твердого розчину. Відносні вагові кількості, тобто тверді фази та рідкої фази по правилу відрізків (або важеля) визначаються за співвідношенням аналогічно попередньо розглянутій діаграмі першого роду (Pb-Sb).
5 ОСНАЩЕННЯ РОБОЧОГО МІСТА
5.1 Журнал лабораторних робіт
5.2 Методичні вказівки
5.3 Варіанти індивідуальних завдань.
6 РЕКОМЕНДАЦІЇ ЩОДО ВИКОНАННЯ РОБОТИ
ТА ОФОРМЛЕННЯ ЗВІТУ
6.1 Зобразити діаграму свинець-сурма та мідь-нікель з вказівкою рівноважних фаз у різних областях.
6.2 Дати визначення діаграми стану, евтектики, альфа-твердого розчину.
6.3 Проаналізувати по діаграмі Pb-Sb перетворення у сплаві з концентрацією складових згідно свого варіанту при охолодженні.
6.4 Проаналізувати по діаграмі Cu-Ni перетворення у сплаві з концентрацією складових згідно свого варіанту при охолодженні.
6.5 Визначити фази та підрахувати по формулі С = К – Ф + 1
число ступенів свободи у кожній критичній точці заданих варіантом сплавів.
6.6 На основі даних п.6.5 збудувати поряд з діаграмами Pb-Sb та Cu-Ni криві охолодження заданих сплавів.
6.7 Для заданого сплаву визначити, користуючись правилом відрізків, кількість присутніх в сплаві фаз.
6.8 По діаграмі визначити процентний вміст елементу (Sb або Ni) у кожній фазі сплаву при заданій температурі.
7 ПИТАННЯ ДЛЯ САМОПЕРЕВІРКИ
7.1 Що таке критичні точки?
7.2 Що таке крива охолодження?
7.3 Які перетворення відбуваються на кожній лінії діаграм стану сплавів Pb-Sb та Cu-Ni?
7.4 Що можна визначити за правилом відрізків?
7.5 Які фази та структури знаходяться в різних зонах діаграм?