Ионная поляризация
Ионная поляризация наблюдается в веществах с ионной химической связью и проявляется в смещении друг относительно друга разноименно заряженных ионов. Как указывалось, время установления ионной поляризации весьма мало, всего на 2—3 порядка больше электронной поляризации. Соотношение 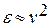 для веществ с ионной поляризацией не соблюдается. Например, для каменной соли ν = 1,54; ν2 = 2,22 и ε = 4,8; для рутила TiO2: v = 2,7, ν2 = 7,3, ε = 114.
для веществ с ионной поляризацией не соблюдается. Например, для каменной соли ν = 1,54; ν2 = 2,22 и ε = 4,8; для рутила TiO2: v = 2,7, ν2 = 7,3, ε = 114.
Зависимость ε от температуры у твердых ионных линейных диэлектриков с ростом температуры может быть различной. У большинства ионных диэлектриков с ростом температуры ε увеличивается, так как при этом уменьшается коэффициент упругой связи между ионами и расстояние между ними увеличивается при тепловом расширении материала. Если обозначим через kупр—коэффициент упругой связи, а через Δх смещение ионов, то в состоянии равновесия qE= kупр • Δх, а элементарный электрический момент пары, состоящей из двух разноименно заряженных ионов Ри = qΔх =q2E/kупр и
αи = q2/kупр (9)
Тогда поляризованность единицы объема Ри будет равна сумме всех элементарных моментов. ε увеличивается с ростом температуры для неорганических стекол различного состава, для электротехнического фарфора, содержащего большое количество стекловидной фазы. Но у некоторых веществ с большим внутренним полем электронная поляризация преобладает над ионной, как например у рутила TiO2 и перовскит CaTiO3, и ε с ростом температуры уменьшается.
Если диэлектрик характеризуется не только электронной, но и ионной поляризацией, то общая поляризуемость (деформационная) будет равна сумме электронной и ионной поляризуемости α = αэ + αи. Наличие второго слагаемого приводит к тому, что α ионных диэлектриков больше, чем у неполярных веществ. Более высокие значения ε наблюдается у ионных диэлектриков, содержащих многовалентные ноны, например Тi++++, Рb++, O--. В таких веществах ионы слабо связаны друг с другом и несут большие электрические заряды, что обусловливает большую ионную поляризуемость.