Теория метода и описание установки
Адиабатическим называется процесс изменения объёма газа, проходящий без теплообмена с окружающей средой. При адиабатическом процессе изменяются все три параметра, определяющие состояние газа.
Как известно, изменение объёма V связано с изменением давления p. В случае адиабатического процесса эта зависимость выражается уравнением Пуассона
| PV g = const. | (5.1) |
Показатель адиабаты g является важной термодинамической величиной, характеристикой газа. Он равен отношению теплоёмкости газа при постоянном давлении Cp к теплоёмкости этого же газа при постоянном объёме CV, то есть
 . .
| (5.2) |
Теплоёмкостью называется количество теплоты, необходимое для нагревания тела или системы на один градус:
 . .
| (5.3) |
Величина теплоёмкости газа зависит от условий, при которых происходит его нагревание. По первому закону термодинамики полученное системой количество теплоты
| dQ = dU + dA, | (5.4) |
где dU – приращение внутренней энергии термодинамической системы; dA – работа, совершённая системой против внешних сил. Уравнение 1 закона термодинамики (5.4) записано здесь для бесконечно малых величин.
Внутренняя энергия газов при давлениях порядка атмосферного (» 105 Па) прямо пропорциональна абсолютной температуре газа и числу i степеней свободы молекул газа:
 , ,
| (5.5) |
где n – количество газа (число молей).
Газ совершает работу только при изменении объёма:
| dA = рdV, | (5.6) |
поэтому, если нагревать газ при постоянном объёме, то всё тепло, сообщаемое газу извне, полностью идёт на увеличение внутренней энергии. Если же нагревать его при постоянном давлении, то газ расширяется, при этом сообщаемое газу тепло идёт не только на увеличение внутренней энергии, но и на совершение работы изобарического расширения. Поэтому теплоёмкость газов при p = const больше, чем при V = const. Для идеального газа справедливо следующее соотношение между молярными теплоёмкостями:
 , ,
| (5.7) |
причем теплоёмкость прямо пропорциональна числу степеней свободы молекул газа I и не зависит от температуры:
 , ,
| (5.8) |
где R = 8,31 Дж/(моль×К) – универсальная газовая постоянная.
В случае адиабатного процесса dQ = 0, и, как следует из первого закона термодинамики, работа газа совершается за счёт изменения его внутренней энергии:
| dA = – dU. | (5.9) |
При расширении газа он совершает положительную работу, следовательно, внутренняя энергия газа уменьшается, и, в соответствии с (5.5), уменьшается температура газа. При адиабатическом сжатии наоборот: работа газа отрицательна, а приращение внутренней энергии положительно. Поэтому при адиабатическом сжатии температура газа увеличивается.
Показатель адиабаты можно определить экспериментально, если осуществить ряд газовых процессов в воздухе, заключённом в сосуде. Очевидно, как следует из выражений (5.2), (5.7) и (5.8), по измеренному значению g можно также найти число i степеней свободы молекул газа. Соответствующую формулу для вычисления i по экспериментально определённому значению g нужно вывести при подготовке к лабораторной работе.
Применяемый в данной работе прибор Клемана – Дезорма схематически изображён на рис. 5.1. Он представляет собой стеклянный баллон, плотно закрытый пробкой, через которую пропущены трубки. Одна из трубок имеет кран K, позволяющий устанавливать и прерывать сообщение баллона с атмосферой. Другая трубка соединена с водяным U-образным манометром с одной стороны и с ручным воздушным насосом с другой. Нагнетая насосом воздух в баллон и быстро выпуская его, можно осуществить процесс, близкий к адиабатическому.
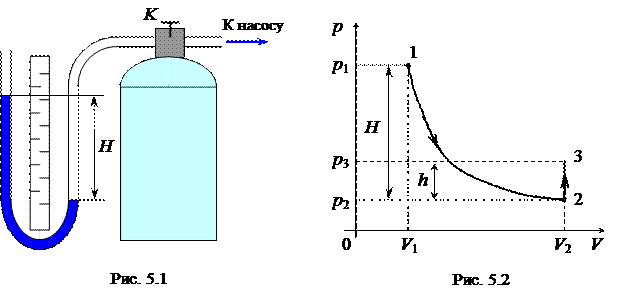 |
Теперь перейдём непосредственно к описанию методики определения показателя адиабаты. Известно, что любое состояние газа характеризуется определенными значениями параметров р, V и T. Процесс – это переход из одного состояния в другое, т.е. изменение параметров. В координатах р, V состояние газа изображается точкой, а газовый процесс – линией. На рис. 5.2 представлены два процесса: адиабатический 1®2, и изохорный 2®3. Покажем, что показатель адиабаты g можно определить, осуществив три состояния газа и записав последовательно уравнения процессов.
1. Газ в состоянии 1, полученном после нагнетания воздуха в сосуд и установления комнатной температуры T1, имеет параметры: р1 = рат + H, где H – избыточное давление в сосуде над атмосферным давлением рат; V1 – объём единицы массы воздуха в сосуде. На графике этому состоянию соответствует точка 1.
Примечание. Здесь все давления выражаются в метрах водяного столба. Фактически избыточное давление равно rgH, где r – плотность воды. Поскольку в дальнейшем мы придём к отношению давлений, то множитель rg сократится.
2. Если теперь на короткое время соединить сосуд с атмосферой, открыв кран K (см. рис. 5.1), то воздух в баллоне расширится и перейдёт в состояние 2 с давлением р2 = рат. Единица массы газа займёт объём V2 > V1, температура понизится до некоторого значения T2 < T1 (рис. 5.2, точка 2). Переход газа из состояния 1 в состояние 2 можно считать адиабатическим процессом, поскольку за время расширения газ в сосуде не успевает обменяться теплом с окружающей средой.
Для адиабатического перехода из состояния 1 в состояние 2 справедливо уравнение Пуассона (5.1):
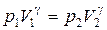 . .
| (5.10) |
3. Воздух, оставшийся в сосуде, сохраняя объём постоянным (V3 = V2), постепенно нагревается до комнатной температуры (T3 = T1), и давление повышается до значения р3 = рат + h (точка 3 на рис. 5.2).
Газ в состояниях 3 и 1 имеет одну и ту же комнатную температуру. Значит, эти состояния можно связать уравнением Бойля – Мариотта:
| р1V1 = р3V3. | (5.11) |
Из уравнений (5.10) и (5.11) легко получить связь между начальным давлением р1 и конечным давлением р3

| (5.12) |
и, логарифмируя последнее равенство, определить показатель степени
 . .
| (5.13) |
Учитывая, что H и h много меньше рат (давление атмосферы соответствует 10 м водяного столба, а H не превышает 300 мм), и используя формулу приближённых вычислений: ln(1+x) » x (при x << 1), можно получить расчётную формулу для показателя адиабаты:
 . .
| (5.14) |
Эта формула даёт правильный результат, если процесс расширения 1®2 действительно адиабатический, и за время расширения теплота не проникает сквозь стенки сосуда. Практически это условие можно выполнить, если провести расширение очень быстро. Однако здесь возникает другая проблема – процесс становится существенно неравновесным, так как температура и давление не успевают выравниваться в объёме сосуда, и применять уравнения (5.10) и (5.11) не совсем корректно.
Анализ ситуации с теплообменом показывает: чем дольше длится процесс расширения газа, тем большее количество теплоты проникает из комнаты в сосуд, и тем меньше будет понижение температуры при переходе газа в сосуде из состояния 1 в состояние 2 (см. рис. 5.2). Поэтому при последующем изохорном нагревании (процесс 2®3) давление поднимется на меньшую величину h', чем при адиабатическом процессе: h' < h, и рассчитанное по формуле (5.14) значение g будет заведомо меньше теоретического. При t ® ¥ процесс расширения становится изотермическим, h' ® 0, а показатель g ®1. С увеличением времени t, в течение которого сосуд сообщается с атмосферой, значение h' уменьшается по экспоненциальному закону:
| h' = h0e–at. | (5.15) |
 ). Определяющие формулы для этих теплоёмкостей:
). Определяющие формулы для этих теплоёмкостей:
 ; ; 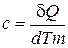 ; ; 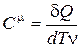 . .
| (6.1) |
Здесь dT — бесконечно малое приращение температуры тела вследствие поглощения им бесконечно малого количества теплоты dQ; n = т/m – число молей.
Теплоёмкость твёрдых тел, в отличие от газов, практически не зависит от условий нагревания: ср » сV, но существенно зависит от температуры. Согласно квантовой теории теплоёмкости Эйнштейна – Дебая с увеличением температуры теплоёмкость возрастает сначала быстро, а при температурах порядка комнатных (~ 300 К) и выше теплоёмкость кристаллических тел слабо увеличивается с температурой.
Задолго до создания квантовой теории теплоёмкости, в 1819 г. французские физики Дюлонг и Пти на основе опытов установили закон теплоёмкости твёрдых тел, согласно которому молярные теплоёмкости любых металлов и кристаллических диэлектриков практически одинаковы и при комнатных температурах приблизительно равны 3R (R = 8,31 Дж/(моль×К) – газовая постоянная).
Предлагаемый метод определения теплоёмкости основан на сопоставлении двух уравнений, выражающих количество теплоты, отдаваемой или поглощаемой телом. Количество теплоты dQ1, отданное телом массой m при остывании на dT градусов, может быть найдено по известному выражению
| dQ1 = cmdT, | (6.2) |
где 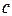 – удельная теплоёмкость вещества.
– удельная теплоёмкость вещества.
С другой стороны, по закону охлаждения И. Ньютона, при остывании тела количество отданного тепла dQ2 пропорционально площади S поверхности тела, разности температур тела T и окружающей среды T0 и времени охлаждения dt:
| dQ2 = a(T – T0) S dt, | (6.3) |
где a – коэффициент теплоотдачи, значение которого определяется лишь условиями охлаждения (форма, размеры, перепад температуры, скорость воздуха и др.) и не зависит от материала образца; T – температура поверхности тела; T0 – температура окружающей среды.
При малых размерах тела, изготовленного из металла, температуру можно считать одинаковой во всех его точках, поскольку металлы обладают хорошей теплопроводностью. Вследствие этого температуру можно измерять не на поверхности, а внутри металлического образца.
В соответствии с законом сохранения энергии dQ1 = dQ2, и из выражений (6.2) и (6.3) получаем
 , ,
| (6.4) |
где 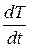 – скорость охлаждения образца.
– скорость охлаждения образца.
Записав уравнение (6.4) для двух образцов одинаковой формы и размеров, имеющих одну и ту же температуру, но изготовленных из различных металлов, можно получить расчётную формулу для определения теплоёмкости с1 первого тела по теплоёмкости с2 второго тела:
 , ,
| (6.5) |
где r1 и r2 – плотности металлов, из которых изготовлены образцы.
Если известна удельная теплоёмкость какого-либо металла, принимаемого за эталон, то по формуле (6.5) можно найти теплоёмкость другого металла, экспериментально определив соответствующие скорости охлаждения (dT/dT)1 и (dT/dT)2. Они определяются графическим дифференцированием экспериментальных кривых охлаждения исследуемых металлов (см. рис. 6, с. 13), поскольку 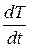 – это производная от функции зависимости температуры образца от времени в процессе остывания тела.
– это производная от функции зависимости температуры образца от времени в процессе остывания тела.
Производные 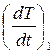 и
и  нужно находить при одинаковых температурах образцов, поскольку теплоёмкость металлов зависит от температуры. В качестве эталона здесь используем медь (Cu). Её удельная теплоёмкость в интервале температур от 100 до 300 °С приведена в табл. П.2 на с. 52. Нетрудно подсчитать, что в этом диапазоне температур изменение теплоёмкости составляет менее 5 %.
нужно находить при одинаковых температурах образцов, поскольку теплоёмкость металлов зависит от температуры. В качестве эталона здесь используем медь (Cu). Её удельная теплоёмкость в интервале температур от 100 до 300 °С приведена в табл. П.2 на с. 52. Нетрудно подсчитать, что в этом диапазоне температур изменение теплоёмкости составляет менее 5 %.
Определив удельную теплоёмкость c, можно вычислить и молярную теплоёмкость  , зная молярную массу металла, которая элементарно определяется из таблицы Д. И. Менделеева: моль вещества содержит столько граммов, сколько углеродных единиц составляет масса одной молекулы этого вещества.
, зная молярную массу металла, которая элементарно определяется из таблицы Д. И. Менделеева: моль вещества содержит столько граммов, сколько углеродных единиц составляет масса одной молекулы этого вещества.
 Определение теплоёмкостей металлов производится на установке, схема которой изображена на рис. 6.1. Образец 1 нагревается в электропечи 4, и по достижении им заданной температуры вынимается из печи для охлаждения. Во время остывания температура образца непрерывно измеряется с помощью термопары 2, концы которой подключены к милливольтметру 3. Милливольтметр измеряет эдс термопары, которая практически прямо пропорциональна разности температур образца и окружающей среды. Шкала милливольтметра проградуирована в градусах Цельсия, так что по нему прямо и определяется температура образца в любой момент времени.
Определение теплоёмкостей металлов производится на установке, схема которой изображена на рис. 6.1. Образец 1 нагревается в электропечи 4, и по достижении им заданной температуры вынимается из печи для охлаждения. Во время остывания температура образца непрерывно измеряется с помощью термопары 2, концы которой подключены к милливольтметру 3. Милливольтметр измеряет эдс термопары, которая практически прямо пропорциональна разности температур образца и окружающей среды. Шкала милливольтметра проградуирована в градусах Цельсия, так что по нему прямо и определяется температура образца в любой момент времени.