рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Термическая обработка металлов и сплавов
Реферат Курсовая Конспект
Термическая обработка металлов и сплавов
Термическая обработка металлов и сплавов - раздел Образование, Материаловедение Огромную Роль В Получении Тех Или Иных Свойств В Металлах И Сплавах Играет Те...
Огромную роль в получении тех или иных свойств в металлах и сплавах играет термическая обработка. Но это довольно сложный вопрос для понимания, и сходу его не возьмешь! Мы постараемся к этому вопросу подойти постепенно, шаг за шагом!
Прежде всего, нужно вспомнить, что когда мы говорили об ограниченных твердых растворах, то отмечали, что для ряда компонентов растворимость в основном металле может быть ограниченной, т. е. он может растворяться до определенного предела. Это объясняется тем, что в большинстве случаев эти атомы располагаются в дефектах кристаллической структуры, в «порах» (между сферами атомов), а число этих мест в металле-растворителе ограничено.
Но мы также с Вами говорили, что с повышением температуры растворимость повышается, это объясняется тем, что при повышении температуры колебательное движение атомов возрастает и число дефектов решетки увеличивается, поэтому растворимость компонентов повышается! Для примера вспомним холодный и горячий чай. В каком чае больше и лучше раствориться сахар?! Конечно, в горячем! Подобными свойствами обладают и металлы.
Ранее мы также отмечали, что многие металлы при нагревании в твердом состоянии могут изменять тип своей решетки. В нормальных условиях нагрева решетка перестраивается диффузионным путем, т. е. происходит образование зародыша новой решетки (энергетически более выгодно), и далее атом за атомом (как кирпичи на строительстве!) перемещаются, от старой решетки к новой! Процесс происходит при постоянной температуре. Мы приводили в качестве примера железо, оно при нагревании ниже температуры плавления, перестраивает свою решетку в твердом состоянии трижды, а марганец – даже четыре раза!
Мы неоднократно обращали внимание на то, что каждому типу решетки соответствуют и определенные свойства: если в процессе нагрева изменилась решетка, то изменяются и свойства, в том числе растворимость компонентов!
При охлаждении эти процессы пойдут в обратном порядке, но только, как говорят, при равновесных условиях, при условии медленного охлаждения! Если скорость охлаждения увеличивать, то температуры обратных превращений будут снижаться, и чем выше скорость охлаждения, тем при более низких температурах они произойдут! При очень больших скоростях охлаждения выделение растворенного при нагреве элемента в кристаллической решетке, может и не произойти, а решетка обязательно перестроится, но уже бездиффузионным путем; не путем переноса «кирпичиков» туда – сюда, а путем сдвига и поворота в кристалле по определенным плоскостям, с обязательным строением для этой температуры.
Кажется, что мы все предусмотрели, и теперь можно переходить к изучению процессов, происходящих при различных видах термической обработки. Что касается предварительных видов обработки, таких, как отжиг, нормализация, то они изучаются в курсах материаловедения достаточно подробно, и больших сложностей при их изучении нет. Более сложны при изучении, как говорят, окончательные виды термической обработки – закалка и отпуск!
Закалка. Это название обработки часто употребляется в обыденной жизни, много выражений по поводу закалки в отношении здоровья, но смысл понятен – укреплять! Действительно, при закалке сплавы упрочняются, делаются твердыми! Интересный ответ получаешь у деловых людей на вопрос, что такое закалка (имеется в виду упрочнение), ответ всегда однозначный: «Нагреть докрасна и в воду!» Такое упрощенное представление стоит опровергнуть, так как это не всегда правильно!
Несколько примеров для опровержения или подтверждения. В моей молодости автомобилей было мало, еще меньше, а то и совсем не было их у молодежи! Но двухколесная техника, у уважающего себя парня всегда была, правда, не всегда новая! Приходилось разбирать и двигатели, особенно вскрывать головку цилиндра, под ней медная прокладка и если при сборке ничего не сделать с этой прокладкой, то мощность терялась из-за неплотного прилегания головки цилиндра. Тогда мы нагревали ее «докрасна и в воду», после этого прокладка становилась пластичной, выбирались все зазоры, и все было хорошо! Но в этом примере нет и следа упрочнения! В чем дело?
А вот другой пример: рыбаки, охотники, да и прочие стремятся сделать нож из «самокала», так называют сталь, которая как бы сама, охлаждаясь после нагрева до высоких температур на воздухе, приобретает высокую твердость. Оказывается, вода не нужна! Это не что иное, как инструментальная быстрорежущая сталь! Потом о ней несколько слов скажем.
Но прежде всего нужно помнить наш давний вывод: без изменения структуры, т. е. внутреннего строения, не бывает изменения свойств!
Следовательно, исходя из этого вывода, в меди и в «самокале» происходят какие-то изменения в структуре и нам надо понять, что происходит?
Начнем изучение этого вопроса с термической обработки дуралюмина. Эти сплавы и им подобные широко применяются в различных отраслях промышленности. Основными компонентами этих сплавов является алюминий с добавкой меди 3,8-4,8 % и небольшим количеством магния, марганца и др. Медь с алюминием образует химическое соединение CuAl2. Это соединение, в свою очередь, с алюминием образует ограниченный твердый раствор α. Растворимость меди в α-твердом растворе при 20 °С составляет 0,05 %, а при 548 °С – 5,7 % меди.
Сплавы, содержащие до 5 % меди, имеют при комнатной температуре структуру α + CuAl2, в α-твердом растворе содержится не более 0,05 % Cu.
 Термическая обработка таких сплавов заключается в нагреве примерно до 500°С, длительной выдержке и последующем охлаждении в воде при 40 °С. После этого проводится естественное старение при 20 °С в течение около 100 часов, или искусственное старение при 200 °С в течении 10-15 часов.
Термическая обработка таких сплавов заключается в нагреве примерно до 500°С, длительной выдержке и последующем охлаждении в воде при 40 °С. После этого проводится естественное старение при 20 °С в течение около 100 часов, или искусственное старение при 200 °С в течении 10-15 часов.
 Что же происходит в сплаве при таком технологическом процессе? Обратимся к диаграмме состояния на рис. 11. Прежде чем обратиться к диаграмме, вспомним о том, что мы установили раньше.
Что же происходит в сплаве при таком технологическом процессе? Обратимся к диаграмме состояния на рис. 11. Прежде чем обратиться к диаграмме, вспомним о том, что мы установили раньше.
Первое, что с помощью «правила отрезков» можно для сплава при любой температуре определить, какие фазы или структурные составляющие присутствуют в данной области; во-вторых, мы с Вами установили, что при повышении температуры сплава растворимость компонентов в ограниченных твердых растворах повышается.
А теперь еще одно положение «правила отрезков»: если точки пересечения горизонтали, для данного сплава и при заданной температуре, с линиями, ограничивающими данную область и указывающими на наличие фаз, спроектировать на ось концентраций, то проекции этих точек на ось концентраций, укажут состав этих фаз!
Это положение мы с Вами рассмотрим на примере рис. 12.
На данном рисунке представлена правая часть диаграммы «Al – Cu», у которой масштаб по оси концентраций значительно увеличен, что позволяет нагляднее представить второе положение «правила отрезков».
 Мы отмечали, что α-твердый раствор при 20° содержит не более 0,05 % меди. Проследим, что будет происходить с составом твердого раствора при повышении его температуры. Выберем сплав с 4,3 % меди (точка «А», что соответствует составам сплавов Д1 и Д16) и проследим, как будет изменяться состав α-раствора при повышении температуры. При 200° проекция точки F на ось концентрации F´ укажет, что α-раствор содержит уже ~ 0,7 % меди, а при температуре нагрева до 500° – около 3,4 %. Температура 500° – это температура термической обработки дуралюминов типа Д1 и Д16. Следовательно, при таком нагреве растворяется большая часть меди в решетке алюминия! Однако при термической обработке таких сплавов требуется длительная выдержка при температуре нагрева. Это вызвано тем, что диффузионные процессы при этих температурах протекают медленно.
Мы отмечали, что α-твердый раствор при 20° содержит не более 0,05 % меди. Проследим, что будет происходить с составом твердого раствора при повышении его температуры. Выберем сплав с 4,3 % меди (точка «А», что соответствует составам сплавов Д1 и Д16) и проследим, как будет изменяться состав α-раствора при повышении температуры. При 200° проекция точки F на ось концентрации F´ укажет, что α-раствор содержит уже ~ 0,7 % меди, а при температуре нагрева до 500° – около 3,4 %. Температура 500° – это температура термической обработки дуралюминов типа Д1 и Д16. Следовательно, при таком нагреве растворяется большая часть меди в решетке алюминия! Однако при термической обработке таких сплавов требуется длительная выдержка при температуре нагрева. Это вызвано тем, что диффузионные процессы при этих температурах протекают медленно.
Следующий этап термической обработки заключается в охлаждении нагретых изделий в воде, тем самым фиксируем состояние сплава, соответствующее температуре 500°. Если при 20° твердый раствор содержал 0,05 % меди, и он был насыщенным, то после охлаждения в воде в нем меди будет во много раз больше и он является пересыщенным. Такой раствор неустойчив, и должны протекать процессы выделения меди из раствора. Подобные эксперименты проводились в школе: растворив в горячей воде поваренную соль в больших количествах без остатка, видели, что к концу урока на дне сосуда выделились кристаллы соли. Подобные процессы должны происходить и в сплаве, но в металле эти процессы протекают во много раз медленнее. Действительно, чтобы атом меди перемещался, он должен «протискиваться» между атомами алюминия, разрывая межатомные связи между этими атомами, на что требуются большие усилия. Но если повысить температуру, то эти процессы облегчаются!
Мы получили пересыщенный твердый раствор, как это повлияло на свойства? Ведь мы всегда говорили, что изменение строения сплава ведет к изменению свойств! Сплавы типа дуралюмин в отожженном состоянии имеет предел прочности порядка 20 кгс/мм2, а после нагрева до 500° и охлаждения в воде – около 25 кгс/мм2; как видим, повышение прочности небольшое, однако оно есть.
Поэтому процессы распада пересыщенного раствора должны обязательно происходить, и чем выше температура, тем интенсивнее они протекают!
 На рис. 13 представлены схемы процесса выделения меди из пересыщенного твердого раствора и образования фаз в зависимости от температуры нагрева. При невысоких температурах нагрева (естественное старение), зарождаются выделения с более простой кристаллической структурой. Так, при естественном старении, т. е. при комнатной температуре, образуются так называемые зоны Гинье-Престона или предвыделения! Они представляют собой очень малые объемы твердого раствора с высокой концентрацией меди, но с сохраненной решеткой (рис 13, а); такие зоны наиболее трудно преодолеваются дислокациями. При повышении температуры искусственное старение происходит выделение с образованием кристаллов CuAl2, но еще не отделившихся от исходной решетки (рис. 13, б), вызывая большие напряжения на границе раздела, тем самым затрудняя движение дислокаций. Дальнейшее повышение температуры вызывает отделение фазы, что приводит к снижению прочности. На начальном этапе распада раствора выделяющиеся частицы – мелкие. Эти выделения блокируют плоскости скольжения дислокаций, и создают препятствия дислокациям. Поэтому прочность выше, чем в отожженном и закаленном состояниях. При увеличении выдержки или увеличении температуры выделившиеся частицы растут, блокируя меньшее количество плоскостей, облегчая движение дислокаций, тем самым снижая прочность.
На рис. 13 представлены схемы процесса выделения меди из пересыщенного твердого раствора и образования фаз в зависимости от температуры нагрева. При невысоких температурах нагрева (естественное старение), зарождаются выделения с более простой кристаллической структурой. Так, при естественном старении, т. е. при комнатной температуре, образуются так называемые зоны Гинье-Престона или предвыделения! Они представляют собой очень малые объемы твердого раствора с высокой концентрацией меди, но с сохраненной решеткой (рис 13, а); такие зоны наиболее трудно преодолеваются дислокациями. При повышении температуры искусственное старение происходит выделение с образованием кристаллов CuAl2, но еще не отделившихся от исходной решетки (рис. 13, б), вызывая большие напряжения на границе раздела, тем самым затрудняя движение дислокаций. Дальнейшее повышение температуры вызывает отделение фазы, что приводит к снижению прочности. На начальном этапе распада раствора выделяющиеся частицы – мелкие. Эти выделения блокируют плоскости скольжения дислокаций, и создают препятствия дислокациям. Поэтому прочность выше, чем в отожженном и закаленном состояниях. При увеличении выдержки или увеличении температуры выделившиеся частицы растут, блокируя меньшее количество плоскостей, облегчая движение дислокаций, тем самым снижая прочность.
Рис. 13. Типы выделений из пересыщенного твердого раствора:
а – зона ГП; 1 – атомы растворителя; 2 – растворенные атомы;
б – кристаллы метастабильной фазы (когерентное выделение);
в – кристаллы стабильной фазы (некогерентное выделение)
Максимальное упрочнение наблюдается при естественном старении, прочность этих сплавов достигает порядка 40 кгс/мм2, с увеличением температуры старения эффективность упрочнения снижается!
В молодые годы мы увлекались лыжным спортом. Промышленность выпускала лыжные крепления, состоящие из двух половинок, они быстро расшатывались, и лыжи, при резких поворотах, слетали! Тогда мы стали делать кустарным путем цельные крепления из листового дуралюмина. Весь дуралюмин поставляется в упрочненном состоянии, т. е. в закаленном и состаренном. Если попробовать такой лист гнуть на 90° и больше, то будут образовываться трещины и изготовить изделие невозможно! Если дуралюмин был подвергнут искусственному старению при 200 °С, то при последующем нагревании до этой температуры выделения растворяются, и металл приобретает свойства свежезакаленного состояния. Два – три дня эти свойства сохраняются и можно делать с этой заготовкой что угодно! А через несколько дней сплав опять состарится и приобретет былую прочность, это явление носит название возврата. Так и мы решали эту проблему!
Мы с Вами рассмотрели закалку сплава, при которой не происходит превращения в кристаллической решетке, а связанную лишь с изменением растворимости компонента с повышением или понижением температуры! Тут, кстати, можно вспомнить поведение меди при нагреве. Когда мы говорим «медь», то подразумеваем, что это чистый химический элемент, но на самом деле «медь» содержит ряд сопутствующих элементов. Повышение чистоты металла многократно увеличивает его стоимость, следовательно, металлы получают относительно чистыми, исходя из предъявляемых требований. Техническая медь содержит в небольших количествах сопутствующие элементы, которые могут быть растворены в решетке. При работе двигателя прокладка нагревается и происходит процесс, напоминающий старение дуралюмина, и прокладка твердеет. Нагревание ведет к процессу растворения этих элементов, упрочнение уменьшается, и медь становится пластичной!
В большинстве случаев, понятие «закалка» связывают с процессом перестройки решетки при нагреве. При этом происходит изменение растворимости, т. е. способности насыщаться элементами, которые при комнатной температуре растворялись незначительно. Последующее охлаждение должно зафиксировать пересыщенный твердый раствор. Типичным примером такой закалки является закалка сталей!
Рис. 14. Диаграмма состояния «железо – углерод» (без обозначений)
 Но прежде чем говорить о закалке этих сплавов, познакомимся с тем, что такое сталь и чем сталь отличается от других сплавов.
Но прежде чем говорить о закалке этих сплавов, познакомимся с тем, что такое сталь и чем сталь отличается от других сплавов.
Прежде всего, надо дать понятие, что такое сталь? Простейшее определение: «сталь – это сплав железа с углеродом»! Но это далеко не полное определение, так как в состав современных сталей, помимо постоянных технологических спутников, могут входить самые разнообразные элементы. Введение в сталь тех или иных элементов, называемых легирующими, зависит от требуемых свойств, которые стремятся при этом получить! Не вдаваясь в подробности, нужно отметить, что современная промышленность использует огромное количество специальных сталей. Однако, чтобы уяснить каким образом протекают процессы при термической обработке в сталях, необходимо рассмотреть простейший вариант. Мы познакомимся с процессами протекающими в стали, где основными элементами являются углерод и железо!
На рис. 14 представлена диаграмма «железо – углерод» (так мы будем ее называть в дальнейших рассуждениях), однако, на ней не указаны фазовые или структурные составляющие, а лишь нанесены важнейшие элементы. Это сделано с той целью, чтобы Вы попробовали заполнить диаграмму, зная «правило отрезков» и подробные объяснения, которые приводятся ниже!
Одно важное напоминание, так как иногда студенты, пользуясь «правилом отрезков», проводят горизонталь не до линии, ограничивающей данную область, а останавливаются около характерных концентрационных точек. Разберем пример, как надо делать! Положим, что Вам надо определить структуру сплавов составов от 0,8 % С до 2,14 % С и при температуре выше 727°, но ниже 1147°. Выбрав температуру, проводим горизонталь через эту точку, от линии SE до линии FK. Отсюда видим, что структуры этих сплавов состоят из аустенита и цементита вторичного (А+ЦII), так как цементит выделяется из пересыщенного раствора в твердом состоянии. Если же нужно определить структуру сплавов составов от 2,14 % С и до 4,3 % С и при той же температуре, то кажется, что структура будет подобна сплавам предыдущего примера? Нет! Здесь надо смотреть, а что происходило с данными сплавами ранее? Оказывается, на линии ECF образовывалась эвтектика, следовательно, он должен состоять из ледебурита, аустенита и цементита вторичного. Однако, ледебурит при данной температуре состоит из аустенита и цементита, и при этом из аустенита, при данных условиях, выделяется цементит вторичный. Но для образования новых кристаллов ЦII требуются затраты энергии для его зарождения и роста, а рядом уже имеется кристалл цементита, входящий в ледебурит. Надо полагать, что ЦII без всяких усилий будет выделяться на имеющихся кристаллах. Помните, как в школе выращивали кристаллы соли из насыщенного раствора. Где шел процесс быстрее, на дне сосуда или на подвешенном кристалле?
Итак, для этих сплавов структура будет состоять из: ледебурит + аустенит!
Основные положения сплавов железа с углеродом. Железо с углеродом образует химическое соединение Fe3C, получившее название – цементит. Это очень твердое и хрупкое вещество. Химическое соединение Fe3C образуется при содержании 6,67 % углерода. Структурно различают три типа цементита: ЦI – цементит первичный, который образуется непосредственно из расплава, для сплавов содержащих углерода больше 4,3 % и имеет кристаллы в виде крупных игл; ЦII – цементит вторичный, образующийся в твердом состоянии при охлаждении, он выделяется из аустенита при температурах выше 727 °С и содержании углерода больше 0,8 %, по границам аустенитного зерна; ЦIII – цементит третичный, образуется за счет уменьшения растворимости из α-твердого раствора при температуре ниже 727 °С и при содержании углерода меньше 0,02 %. Все это будет более понятно при рассмотрении диаграммы « железо – цементит». Хотя часто говорят «железо – углерод», но большой ошибки в этом нет!
Мы уже говорили, что железо в процессе нагрева изменяет своё строение, т. е. решетку, трижды, но нас будут интересовать, в основном, две – это α-решетка, объемно-центрированный куб, существующая до 911 °С, и γ-решетка, куб гранецентрированный, при температурах выше 911 °С. Железо с цементитом образует ряд соединений.
Цементит с Feα (так можно обозначать железо с решеткой объемно-центрированного куба) образует ограниченный твердый раствор с очень малой растворимостью – до 0,02 % углерода, который получил название феррит, это практически чистое железо. Применить упрочнение, как это осуществляется с дуралюмином, невозможно, так как цементита третичного (ЦIII), образующегося при распаде феррита с понижением температуры, бесконечно мало. Следовательно, нужен иной способ упрочнения!
Цементит с Feγ также образует ограниченный твердый раствор, но со значительной растворимостью углерода – до 2,14 %. Такой твердый раствор получил название аустенит. Область его существования: для железа – при температуре выше 911 °С, для сплавов – область, ограниченная линиями GS-SE-EA (см. диаграмму Fe – Fe3C).
Кроме твердых растворов, железо с цементитом образует и механические смеси. Сплав с 4,3 % углерода при температуре 1147 °С образует эвтектическую смесь аустенита с цементитом (А+Ц), которая носит название ледебурит. Во всех сплавах, содержащих углерода более 2,14 %, по мере кристаллизации, на линии ECF, т. е. при температуре 1147 °С образуется ледебурит (правило отрезков, смотри на концы горизонтали ECF). Его строение подобно кружеву: округлые зерна аустенита, отороченные светлым цементитом.
При содержании углерода 0,8 % и температуре 727°С, в твердом состоянии, образуется эвтектоидная смесь феррита и цементита, которая называется перлит. Первородный перлит имеет пластинчатое строение – чередующиеся очень мелкие пластинки феррита и цементита.
Когда между компонентами образуется «механическая смесь» при кристаллизации из расплава или в твердом состоянии, нужно помнить, что в сплавах, отличных по составу от эвтектических или эвтектоидных, происходит выделение фаз, избыточных по отношению к эвтектическому или эвтектоидному составу! Попробуем объяснить это положение.
Если в сплаве (железо – углерод) 3,0 % углерода, то кристаллизация начинается с образования фазы с меньшим содержанием углерода, тем самым повышая содержание углерода в расплаве. В данном случае образуется аустенит с 2,14 % углерода, а расплав приближается к 4,3 %С. Это дает нам второе положение правила отрезков.
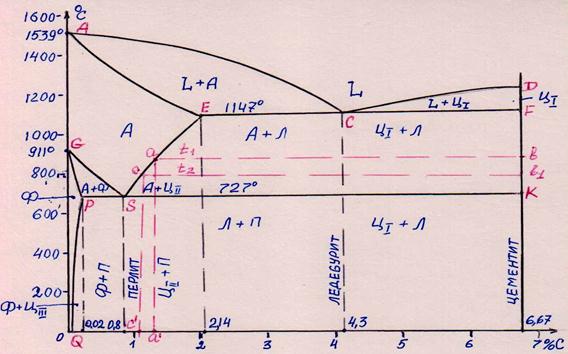
Рис. 15. Диаграмма состояния «железо – углерод»
В процессе охлаждения все сплавы на линии ECF будут иметь состав оставшейся жидкости, равный эвтектическому, и образуется ледебурит.
Если же в сплаве углерода больше, чем требуется для образования эвтектики, то процесс кристаллизации начнется с образования кристаллов первичного цементита, богатого углеродом, а состав расплава будет обедняется углеродом и приближаться к эвтектическому! И в конечном счете структура будет состоять из первичного цементита и ледебурита.
Вот теперь есть возможность сопоставить диаграммы на рис. 14 и 15 и определить, где Вы сделали ошибки (если, конечно, Вы их делали, а надо бы!). Если Вы последовали советам, то всегда разберетесь в диаграммах!
Все сплавы, в зависимости от содержания углерода, делятся на стали, с содержанием углерода до 2,14 %, и чугуны с содержанием углерода свыше 2,14 %С.
В зависимости от содержания углерода и структурных составляющих стали подразделяются: на доэвтектоидные (до 0,8 % С), эвтектоидные (0,8 % С) и заэвтектоидные (>0,8 % С); чугуны: на доэвтектические (до 4,3 % С), эвтектические (4,3 % С) и заэвтектические (свыше 4,3 % С). Эти чугуны, имеющие структуру в соответствии с данной диаграммой, носят название белых чугунов. Данное название они получили по виду излома чугуна. При разрушении чугуна, излом будет светлый (фарфоровидный), и его вид зависит от наличия в структуре большого количества очень твердого и хрупкого цементита. Есть и другие чугуны. Но эти сплавы подробно разбираются в курсах лекций и на лабораторных занятиях. Нас же, в первую очередь, будут интересовать стали и их термическая обработка, применяемая с целью придания свойств, в соответствии с требованиями при эксплуатации.
Стали могут классифицироваться различным образом: по структуре, по назначению, по составу и т. д. Мы же остановимся на классификации, предложенной выше. Нас интересуют углеродистые стали.
Доэвтектоидные стали – это, в основном, по назначению конструкционные или машиноподелочные стали, они идут на изготовление деталей машин и механизмов. Структура этих сталей в состоянии поставки состоит из зерен феррита (твердого раствора с очень малой растворимостью углерода в Feα) и зерен перлита.
Эвтектоидные углеродистые стали – инструментальные, идущие на изготовление, в основном, слесарного инструмента (молотки, зубила и т. п.). Структура этих сталей – перлит.
Заэвтектоидные углеродистые стали – инструментальные, идущие на изготовление инструмента, работающего с малым разогревом (метчики, плашки, некоторые типы штампов и т. д.). Структура этих сталей – зерна перлита, окруженные тонкой «сеткой» цементита вторичного.
Естественно предположить, что изделия различного назначения должны обладать и различными свойствами. У всех на слуху понятие закалка, даже совсем не посвященные связывают ее с упрочнением. Мы уже разбирали такой метод изменения свойств на примере закалки дуралюмина, но в данном случае тот метод не применим. Получить большое пересыщение твердого α-раствора возможно, так как максимальная растворимость углерода в железе всего 0,02 % С. Но известно, что γ-раствор способен растворить углерода до 2,14 % С и, следовательно, надо нагревать до температуры Feγ/. Суть любой закалки сводится к получению пересыщенного твердого раствора и его фиксации. Но способ получения пересыщенного твердого раствора и механизм упрочнения при закалке сталей, принципиально отличен от закалки дуралюмина!
Получение пересыщенного твердого раствора в сталях основано на фазовом превращении Feα в Feγ. В этом случае имеющийся в стали углерод при нагреве растворится в γ-решетке, т. е. в аустените. Теперь будем охлаждать сталь с такой скоростью, когда невозможна диффузия атомов углерода из решетки (т. е. перестройка, как перекладка кирпичей!). Такая скорость носит название критической скорости закалки, и для углеродистых сталей такая скорость достигается охлаждением в воде! Так мы получаем пересыщенный раствор. Однако γ-Fe (можно так обозначать) при комнатных температурах, в данном случае, существовать не может так как энергетически это невозможно. Следовательно γ-решетка перестроится в α-решетку, но бездиффузионным путем. Процесс перестройки решетки осуществляется путем сдвига и поворота плоскостей атомов. Это трудно объяснить на словах, еще труднее понять! Но надо понять одно, что решетка все равно перестроится и будет α- решетка, но углерод застрянет в ней, между атомами на гранях элементарных ячеек. Решетка из кубической станет вытянутой в одном направлении, тетрагональной; эта фаза носит название мартенсита. Кристаллы мартенсита имеют игольчатое строение. Такое строение кристаллов вызывает огромные напряжения, и дислокации практически не могут перемещаться, отсюда очень высокая прочность и отсутствие пластичности! Однако, не при всех содержаниях углерода мартенсит имеет высокую твердость. Считается, что при содержании углерода до 0,2 % практически нецелесообразно подвергать сталь закалке, так как упрочнение крайне мало, низка твердость стали. С ростом содержания углерода в мартенсите твердость возрастает и при 0,7 % С она достигает максимума, при дальнейшем увеличении содержании углерода мало увеличивается, но накладываются другие нежелательные явления. Наша следующая задача: постараться разобраться с выбором температуры закалки сталей с различным содержанием углерода. На рис. 16 представлена «стальная» часть диаграммы «железо – углерод»; с ее помощью попробуем установить оптимальные режимы нагрева при закалке. При этом нужно помнить, что температура должна быть достаточной для насыщения аустенита углеродом, но не выше оптимальной, Это связано с тем, что чем выше температура нагрева, тем сильнее растет зерно. Рост зерна приводит к ухудшению таких свойств, как прочность и пластичность! Для сталей те температуры, при которых при нагреве происходят фазовые или структурные превращения, называются «критическими».
Так, температуру превращения перлита в аустенит (727 °С) обозначают Ас1; температура превращения феррита в аустенит (линия GS) обозначается Ас3; температура полного растворения цементита вторичного в аустените (линия SE) обозначается Аcm.Теперь приступаем к самому главному – выбору температуры закалки, исходя из назначения сталей. Промышленность уже давно не пользуется универсальными сталями.
Конструкционные углеродистые стали (до 0,6 – 0,7 % С). Детали машин и механизмов работают в условиях больших знакопеременных нагрузок, и поэтому стали после термической обработки должны обладать высокими прочностью, циклической прочностью и достаточной пластичностью. При нагреве изделий до температуры Ас1 + (30-50) °С (такой интервал принимается с целью успешного протекания процесса превращения и предотвращения значительного роста зерна!), произойдет превращение перлита в аустенит, феррит же останется неизменным. После непродолжительной выдержки при данной температуре сталь охлаждают в воде или в водном растворе соли. Это обеспечит такую скорость охлаждения, при которой аустенит превратится в мартенсит, а феррит – останется неизменным. Если представить работу такого изделия, то в процессе знакопеременных нагрузок мартенсит, твердый и хрупкий, будет противостоять им, а вот феррит, мягкий и пластичный, будет деформироваться и наклепываться (мы не забыли, что пластическая деформация вызывает наклеп!). В наклепанном феррите образуются трещины (феррит имеет малую прочность), а далее эта трещина в хрупком мартенсите легко развивается! Далее мы покажем, что с мартенситной структурой детали машин не используются. Но, так или иначе, наличие феррита крайне нежелательно. Отсюда следует, что надо избавляться при закалке от феррита в доэвтектоидных сталях.
Если мы нагреем конструкционную (доэвтектоидную) сталь до температуры Ас3 + (30 – 50) °С, получим структуру аустенит. При охлаждении в воде получим структуру мартенсита, что и требовалось. Таким образом, мы избавились от нежелательного феррита! Такая закалка носит название полной. Но надо помнить, термическая обработка не заканчивается закалкой!
Инструментальные углеродистые стали (0,8-1,2 % С). Изделия, изготовленные из этих сталей, должны обладать высокой твердостью, высокой износостойкостью и высокой прочностью. Эти стали, как правило, подвергаются закалке неполной, т. е. с температуры Ас1 + (30 – 50) °С,и вот по какой причине! Структура заэвтектоидных сталей, после нагрева до этих температур, будет представлена аустенитом и цементитом вторичным. Ранее было указано, что мартенсит приобретает максимальную твердость при содержании в нем углерода около 0,7 % и, следовательно, данный нагрев обеспечит максимальную твердость изделию при последующим охлаждении в водной среде. Наличие в структуре цементита наиболее желательно, так как цементит имеет большую твердость и износостойкость, чем мартенсит. После неполной закалки данные стали будут иметь структуру мартенсит и цементит вторичный,что обеспечивает высокие режущие и прочностные свойства!
Изучая закалку углеродистых сталей различного назначения, мы установили, что при закалке получаем структуру мартенсита, имеющего высокие твердость, прочность и хрупкость. Однако, если для режущего инструмента эти свойства нужны, то, положим для вала, работающего с большими изгибающими нагрузками, или для шестерни, работающей с ударами, пружины, такие свойства явно нежелательны! Следовательно, нужно применить способ, который обеспечивал бы получение требуемых свойств для различных изделий! Запомните, что какой-то половинчатой закалки сталей не существует и существовать не может!!! Всегда производится нормальная закалка с последующим отпуском, при необходимых температурах.
– Конец работы –
Эта тема принадлежит разделу:
Материаловедение
НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ... Е И Марр... Методическое пособие...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Термическая обработка металлов и сплавов
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов