Электрохимические процессы в гетерогенных системах.
Гальванические элементы
В отличие от гомогенных реакций, протекающих во всем объеме системы, гетерогенные взаимодействия осуществляются на границе раздела фаз.
Процессы взаимного превращения химической и электрической форм энергии называются электрохимическими процессами.
Рассмотрим процессы, протекающие при погружении металла в воду или раствор соли данного металла, в качестве примера гетерогенного взаимодействия.
Так как совершенно нерастворимых веществ не существует, то любой металл хотя бы в ничтожной степени растворяется в воде. При этом в раствор переходят положительно заряженные ионы металла Меn+, а в самом металле остаются электроны, в результате чего металл заряжается отрицательно. Уравнение, отражающее процесс ионизации атомов металла под действием полярных молекул воды имеет вид:
Ме0+ m H2O Û [Me(H2O)m]n+ + ne– (29)
в растворе в кристалле Ме
Катионы, перешедшие в жидкость, располагаются вблизи поверхности отрицательно заряженной пластинки металла, в результате чего образуется двойной электрический слой. На границе раздела раствора соли с металлом возникает определенная разность потенциалов, которая называется электродным потециалом – ЕМе/Меn+ [В].
Абсолютное значение электродного потенциала измерить невозможно. Поэтому измеряют разность потенциалов между данным электродом и стандартным водородным электродом, потенциал которого условно принимают равным нулю: Е02Н+/Н2 = 0В. Электродный потенциал, измеренный по отношению к стандартному водородному электроду в стандартных условиях (Т = 250C (298 К), Р = 1 атм, СМеn+ = 1 моль/л), называется стандартным электродным потенциалом (обозначается Е0).
Зависимость электродного потенциала от природы металла, температуры и концентрации ионов металла выражается уравнением Нернста:
Е=Е0 + (RT/nF)lg CMen+, (30)
Где (RT/F)=0,059 при Т=298 К. Тогда уравнение принимает вид:
ЕМеn+/Me0=Е0 Меn+/Me0 + (0,059/n)lg CMen+, (31)
Е0 Меn+/Me0 – стандартный электродный потенциал Ме;
n – число электронов, участвующих в электродном процессе;
CMen+ - концентрация ионов металла, моль/л (молярная концентрация).
В зависимости от величины Е0 Меn+/Me0 все металлы можно расположить в ряд, который называется ряд стадартных электродных потенциалов металлов (табл. 4). В этом ряду (слева направо) величина электродного потенциала возрастает, при этом восстановительная способность металлов уменьшается, а окислительная способность ионов металлов увеличивается.
Таблица 4
Ряд стандартных электродных потенциалов металлов
| Восст.форма | Li | K | Na | Mg | Zn | Fe | Ni | Pb | H2 | Cu | Ag | Au |
| Окисл.форма | Li+ | K+ | Na+ | Mg2+ | Zn2+ | Fe2+ | Ni2+ | Pb2+ | 2H+ | Cu2+ | Ag+ | Au3+ |
| ЕМе/Меn+, В | -3,04 | -2,92 | -2,71 | -2,36 | -0,76 | -0,44 | -0,25 | -0,13 | +0,34 | +0,80 | +1,50 |
Этот ряд характеризует химические свойства металлов:
Металлы, обладающие более отрицательным электродным потенциалом, способны вытеснять менее активные металлы (т.е. имеющие более положительные электродные потенциалы) из растворов их солей.
Металлы, имеющие более отрицательный электродный потенциал по отношению к водородному, вытесняют водород из кислот – HCl (разб. и конц.) и H2SO4 (разб.), так как окислителем в них является ион H+.
По восстановительной активности все металлы делят на три группы:
1) активные металлы: Е0 Меn+/Me0< -1В;
2) металлы средней активности: -1В < Е0 Меn+/Me0 <0 В;
3) малоактивные металлы: Е0 Меn+/Me0 >0 В.
В концентрированной серной кислоте H2SO4 (конц.) роль окислителя выполняет анион SO42- за счет иона S+6, который является более сильным окислителем, чем H+. Взаимодействие металлов с ней протекает по схеме:
Me0 + H2S+6O4 (конц.) = Me2+n (SO4)n + H2O + S+4O2 – для малоактивных металлов;
Me0 + H2S+6O4 (конц.) = Me2+n(SO4)n + H2O +S0 – для металлов средней активности;
Me0 + H2S+6O4 (конц.) = Me2+n(SO4)n + H2O + Н2S–2 – для активных металлов.
В азотной кислоте любой концентрации окислителем является анион NO3- за счет иона N+5. При взаимодействии HNO3 (конц.) с металлами она восстанавливается до иона N+4, образуя газ NO2, независимо от активности металла. При взаимодействии HNO3 (разб.) с металлами взаимодействие протекает по схеме:
Me0 + HN+5O3 (разб.) = Me+n (NO3)n + H2O + N+2O – для малоактивных металлов;
Me0 + HN+5O3(разб.)= Me+n (NO3)n+ H2O+ N2+1O – для металлов средней активности;
Me0 + HN+5O3(разб.)= Me+n (NO3)n+ H2O + N-3H4NO3 – для очень активных металлов.
Гальванический элемент (ГЭ) – это устройство, в котором энергия химической реакции превращается в электрическую. В основе работы гальванического элемента лежит ОВР. Гальванический элемент состоит из двух металлических электродов (анода и катода): пластин, изготовленных из разных металлов и погруженных в растворы своих солей. ГЭ имеет две цепи: внешнюю – металлический проводник, соединяющий пластины, по которому двигаются электроны от анода к катоду, и внутреннюю – электролитический ключ, соединяющий растворы солей, по которому двигаются ионы в направлении от катода к аноду.
Максимальная разность потенциалов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой гальванического элемента (ЭДС) – Еэдс [В]: Еэдс= Еок – Евос или Еэдс= Ек – Еа.




 Для рассмотрения электрохимического процесса, лежащего в основе работы любого гальванического элемента, следует использовать алгоритм, предложенный в примерах решения задач. Необходимо помнить, что в ГЭ анодом является металл с большей восстановительной активностью, т.е. с меньшим значением электродного потенциала, а катодом – металл с меньшей восстановительной активностью, т.е. с более высоким значением электродного потенциала. При написании уравнений электродных процессов следует учитывать, что более активный металл является восстановителем, а ион менее активного металла – окислителем.
Для рассмотрения электрохимического процесса, лежащего в основе работы любого гальванического элемента, следует использовать алгоритм, предложенный в примерах решения задач. Необходимо помнить, что в ГЭ анодом является металл с большей восстановительной активностью, т.е. с меньшим значением электродного потенциала, а катодом – металл с меньшей восстановительной активностью, т.е. с более высоким значением электродного потенциала. При написании уравнений электродных процессов следует учитывать, что более активный металл является восстановителем, а ион менее активного металла – окислителем.
Примеры решения задач
Пример 1. Вычислите ЭДС и определите направление тока во внешней цепи данного гальванического элемента:
Fe │FeSO4║AgNO3│Ag, учитывая, что концентрация ионов Fe2+ и Ag+ соответственно равна 0,1моль/л и 0,01моль/л.
Р е ш е н и е. 1) Составляем схему гальванического элемента и указываем концентрацию ионов Fe2+ и Ag+ в растворах электролитов:
Fe │FeSO4║AgNO3│Ag
C Fe2+ = 10-1 моль/л и С Ag+ = 10-2 моль/л.
2) Пользуясь уравнением Нернста, вычисляем значения электродных потенциалов железа и серебра в растворах заданной концентрации:
EFe2+/Fe0 = E0 Fe2+/Fe0 + (0,059/2) lg CFe2+ = – 0,44 + (0,059/2) lg10-1 = – 0,47B,
EAg+/Ag0 = E0 Ag+/Ag0 + 0,059) lg CAg+ = + 0,80 + 0.059 lg10-2 = + 0,68 В
EFe2+/Fe0 < EAg+/Ag0, следовательно, более активным металлом является железо, оно будет отрицательным электродом – анодом, а серебро – катодом.
Таким образом, Fe – анод (А) и Fe – восстановитель, Ag – катод.
3) Указываем направление движения электронов во внешней цепи, учитывая, что электроны движутся от анода к катоду:
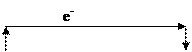
(–)Fe │FeSO4║AgNO3│Ag(+)
4) Составляем электронные уравнения процессов, протекающих на электродах, учитывая, что на аноде происходит окисление атомов железа, а на катоде – восстановление ионов серебра:
(-) (А) Fe0 – 2e– → Fe2+ 1– процесс окисления
(+) (K) Ag+ + e– → Ag0 2 – процесс восстановления
Fe0 +2 Ag+ → Fe2+ +2 Ag0
5) Записываем молекулярное уравнение окислительно-восстановительной реакции, лежащей в основе работы гальванического элемента:
Fe0 + 2AgNO3 → Fe(NO3)2 + 2Ag0↓
6) Рассчитываем ЭДС гальванического элемента:
Еэдс = ЕК – ЕА = E Ag+/Ag0 – E Fe2+/Fe0 = 0,68 – (–0,47) = 1,15 В.
Пример 2. Будет ли магний взаимодействовать с раствором сульфата никеля.
Р е ш е н и е. Для решения этой задачи необходимо сравнить стандартные электродные потенциалы магния и никеля:
E0Mg2+/Mg0 = – 2,34В, E0Ni2+/Ni0 = – 0,25В
Магний – металл, имеющий более отрицательное значение стандартного электродного потенциала и поэтому являющийся более сильным восстановителем. Следовательно, магний будет подвергаться окислению под действием ионов никеля, и электроны от магния будут переходить к никелю:
Mg0 – 2e– → Mg2+
Ni2+ +2e– → Ni0
Mg0 + Ni2+ → Mg2+ + Ni0
Mg + NiSO4 = MgSO4 + Ni