рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ
Реферат Курсовая Конспект
ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ
ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ - раздел Образование, ...

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение
высшего профессионального образования
«Дальневосточный федеральный университет»
(ДВФУ)

ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ
УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКС ДИСЦИПЛИНЫ
ХИМИЯ
Кораблестроение, океанотехника и системотехника объектов морской инфраструктуры
Школа естественных наук ДВФУАННОТАЦИЯ
Учебно-методического комплекса дисциплины
Учебно-методический комплекс дисциплины «Химия» разработан для студентов 1 курса по специальности 180100.62 – «Кораблестроение, океанотехника и… Дисциплина «Химия» включена в состав федерального компонента цикла… Общая трудоемкость освоения дисциплины составляет 108 часов.Учебным планом предусмотрены лекционные занятия (36…ABSTRACT
Educational complex discipline
"Chemistry"
Annotation
The subject of chemistry is included in contents of mathematics and science educational course of federal component . Total workload of the… The purposes f learning the subject of chemistry are:ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ
ХИМИЯКораблестроение, океанотехника и системотехника объектов морской инфраструктуры
Школа естественных наук ДВФУОборотная сторона титульного листа РПУД
I. Рабочая программа пересмотрена на заседании кафедры: Протокол от «10_____» ____09_____________ 2012 г. № ___1___ Заведующий кафедрой _______________________ Шапкин Н.П.Введение
Качество подготовки бакалавров и инженеров существенно зависит от уровня их образования в области фундаментальных наук: математики, физики, химии. Роль и место химии в системе естественнонаучных дисциплин определяется тем, что в области материального производства человеку всегда приходится иметь дело с веществом. Не зная свойств вещества, его строения, химической природы его частиц, механизмов их взаимодействия, возможных путей превращения одного вещества в другое, нельзя успешно освоить материал специальных дисциплин. Целью развития различных отраслей химической науки и совершенствование более полного и комплексного использования природных ресурсов является прогресс производительных сил общества.
Цели освоения дисциплины
Усвоить основы современной химии – это значит понять строение атомов и молекул на электронном уровне, а также принципы образования химических связей…Место дисциплины в структуре ООП бакалавриата
Теоретический и фактический материал курса излагается на основе общехимической логики – периодического закона, электронной теории строения вещества,…Начальные требования к освоению дисциплины
1. Символику химических элементов и устройство периодической системы элементов; 2. Строение атомов первых трех периодов; 3. Основные типы химических связей;А. Компетенции обучающегося, формируемые в результате освоения дисциплины
На основе модели матрицы обученности предлагается типология знаний и умений по уровням усвоения дисциплины:
Фактический уровень
1. Химическую терминологию при описании химических систем; 2. Классификацию элементов, простых и сложных веществ; 3. Стехиометрические законы химии, АМУ (атомно-молекулярное учение);Операционный уровень
1. Логически верно, аргументировано и ясно строить устную и письменную речь (ОК-2); 2. Уметь записывать уравнения и схемы процессов; 3. Проводить расчеты на основании стехиометричеких законов;Аналитический уровень
2. Интерпретировать полученные результаты термодинамических расчетов: оценивать термодинамическую устойчивость материала, делать вывод о возможности… 3. Делать вывод о направленности химического равновесия под действием… 4. Выводить следствия из расчетов количественных характеристик гомогенных и гетерогенных…Структура и содержание дисциплины
Общая трудоемкость дисциплины 3 зачетных единицы 108 часов.
Таблица 1
| № п/п | Модуль и раздел дисциплины | семестр | Неделя семестра | Виды учебной работы и трудоемкость (в часах) | Формы текущего контроля Форма промежуточной аттестации | |||
| Лекц. | Лаб. занятия | СРС | Трудоемкость | |||||
| Строение вещества, уровни его организации. 1.1 Атомно-молекулярная теория 1.2 Строение атома. Периодический закон и система элементов Д.И. Менделеева.. Общая характеристика s-, p-, d-, f- элементов и их соединений. 1.3 Химическая связь. Виды связи, энергия связи, пространственное строение молекул, комплексные соединения, их строение и диссоциация. Межмолекулярное взаимодействие. Агрегатное состояние вещества. | 1-5 | контрольный опрос; экспресс контрольная работа | ||||||
| Химическая термодинамика, энергетика процесса. 2.1 Термодинамические системы, их классификация и параметры. 2.2 Термохимические законы. 2.3 Термодинамический подход к химическим реакциям, возможность протекания и направленность. Учение о кинетике химического процесса 2.4 Кинетика процесса и факторы регулирующие скорость процесса. 2.5 Химическое равновесие. | 5-11 | контрольный опрос; контрольная работа “Закономерности протекания химических процессов” | ||||||
| Жидкие системы – растворы. 3.1 Общие свойства растворов неэлектролитов. 3.2 Количественные характеристики растворов слабых и сильных электролитов. 3.3 Обменные реакции в растворах. 3.4 Коллоидное состояние вещества. Поверхностные явления и сорбционные процессы. Классификация систем по степени дисперсности распределяемой фазы. | 11-14 | контрольный опрос; контрольная работа | ||||||
| Окислительно-восстановительные процессы. 4.1. Классификация окислительно-восстановительных процессов. 4.2. Электрохимические процессы, протекающие самопроизвольно и принудительно. 4.3 Коррозия металлов | 14-17 | Контрольная работа | ||||||
| 5.1 Специальная часть. Конструкционные материалы |
Краткое содержание лекционного курса
Строение вещества
Строение атома. Ядро и электроны. Атомный номер элемента. Изотопы. Волновые свойства электрона. Квантово-механическая модель атома. Квантовые числа.… Химическая связь. Характеристики связи. Природа связи. Типы химических связей.…Химическая термодинамика, энергетика процесса, кинетика и химическое равновесие
Второе начало термодинамики. Энтропия. Энергия Гиббса и направление химического процесса. Концентрационная зависимость скорости реакции. Константа скорости. Кинетика и механизмы химических реакций. Понятие о скорости и механизме химической реакции. Закон действующих масс.…Жидкие системы – растворы
Общие свойства растворов электролитов. Теория электролитической диссоциации. Растворы сильных электролитов и их термодинамические характеристики.… Кислоты и основания. Теория кислот и оснований Аррениуса. Ионное произведение… Коллоидное состояние вещества. Поверхностные явления. Адсорбция на различных межфазных границах. Двойной электрический…Окислительно-восстановительные процессы
Электрохимические процессы. Проводники электрического тока I и II рода. Потенциалы металлических и газовых электродов. Гальванические элементы.… Коррозия и защита металлов. Определение и классификация коррозионных…Конструкционные материалы
Важнейшие конструкционные материалы: металлы, сплавы, композитные материалы, ВМС.
Содержание лабораторных занятий
Таблица 2
| № п/п | Номер раздела | Наименование и № лабораторной работы | Форма контроля |
| 1. | 1.1. 1.3. | № 1. АМУ(атомно-молекулярное учение). Стехиометрические расчеты. Определение мольной массы эквивалента металла. Строение электронной оболочки атома № 2. Качественные и количественные характеристики различных видов химической связи. Комплексные соединения | Защита отчетов по лабораторным работам №№ 1,2; экспресс контрольная работа |
| 2. | 2.3. 2.4. | № 3. Определение теплового эффекта реакции нейтрализации Термодинамическое описание химической системы и процессов протекающих в ней. № 4. Химическая кинетика Кинетическое описание процессов в химической системе Закономерности протекания химических процессов | Защита отчетов по лабораторным работам №№ 3,4; экспресс контрольная работа; контрольная работа |
| 3. | 3.3. 3.4. | № 5. Количественные характеристики растворов электролитов. Обменные реакции в растворах. Гидролиз солей. № 6. Коллоидные растворы | Защита отчетов по лаб. работам №№ 5,6; экспресс контрольная работа |
| 4. | 4.2 4.3 | Окислительно-восстановительные процессы. № 7. Электрохимические процессы. № 8. Коррозия металлов | Защита отчетов по лаб. работам №№7,8; экспресс контрольная работа |
| 5. | 5.1 | № 9. Общие свойства металлов | Отчет по лаб. работе |
График изучения дисциплины
Образовательные технологии
В соответствии с требованиями ФГОС ВПО по данному направлению подготовки реализация компетентного подхода предусматривает использование активных и… Самостоятельной работы студента (СРС)Учебно-методическое и информационное обеспечение дисциплины
1. Глинка, Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка; под ред: А.И. Ермакова – 30-е изд., испр. – М.: Интеграл-Пресс, 2009 – 727 с. –… 2. Коровин, Н.В. Общая химия: учеб. для студ. учреждений высш. проф.… 3.Глинка, Н.Л. Сборник задач и упражнений по общей химии: учеб. пособие для студ. нехимических спец. вузов / Н.Л.…Материально-техническое обеспечение и электронные средства обучения, иллюстрационный материал, специализированное и лабораторное оборудование
2. Наборы химических реактивов, необходимых для выполнения лабораторных работ по неорганической, аналитической и физической химии. 3. Различная лабораторная посуда. 4. Приборы: для проведения электрохимического анализа, для проведения молекулярно-спектроскопического анализа,…Текущий и итоговый контроль
Формы и методы для текущего контроля
Проведение экспресс-контрольных опросов на лекциях по основным разделам курса:
1) Строение вещества.
2) Химическая термодинамика. Кинетика и равновесие.
3) Растворы, процессы в жидких системах.
4) Коллоидное состояние вещества.
5) Электрохимия.
6) Химия элементов.
Формы текущего контроля по лабораторным занятиям приведены в табл. 2
Перечень типовых экзаменационных вопросов
2. Строение и свойства молекул по типу химических связей. 3. Состав и природа сил взаимодействия частиц на каждом уровне организации… 4. Закономерности протекания химических процессов. Термохимические законы и расчеты. Термодинамические функции…Рейтинговая оценка по дисциплине
Таблица 4 № п/п Виды учебной деятельности студента, учитываемые в рейтинговой оценке Оценка в % …ШКОЛА ЕСТЕСТВЕННЫХ НАУК
КОНСПЕКТЫ ЛЕКЦИЙ
по дисциплине «Химия»
Кораблестроение, океанотехника и системотехника объектов морской инфраструктуры
г. Владивосток
Конспект лекций представлен в виде развернутого плана лекций, разработанного в соответствии со структурой и содержанием дисциплины «Химия», определенном в РПУД в соответствии с требованиями ФГОС. С полным курсом лекций (теоретической частью дисциплины) можно ознакомиться по учебным пособиям, рекомендованным данным УМКД (см. список литературы).
Модуль 1. Атомно-молекулярный уровень организации вещества
Раздел 1. Основы атомно-молекулярного учения (6 часов)
Тема 1. Основные классы неорганических соединений
Цели, задачи:
На фактическом уровне получения знаний:
1. Классификация соединений по составу;
2. Классификация соединений по свойствам (функциональным признакам);
3. Номенклатура неорганических соединений;
4. Теории кислот и оснований.
На операционном уровне получения знаний:
Обучить студента:
1. Приводить молекулярные и составлять графические формулы химических соединений;
2. Рассчитывать молярную массу химических соединений.
На аналитическом уровне получения знаний:
Обучить студента определять:
1. Принадлежность соединений к определенному классу;
2. Способность к диссоциации в водной среде соединений определенного класса;
3. Кислотно-основные свойства оксидов и гидроксидов;
4. Влияние центрального атома на природу гидроксида;
5. Основность кислот и кислотность оснований.
Фактический материал:
I. Основные бинарные соединения (оксиды, галогениды, нитриды, карбиды, сульфиды, гидриды) и многоэлементные соединения.
II. Классификация неорганических соединений с позиции функциональных признаков: оксиды, кислоты, основания, соли. Классификация оксидов: солеобразующие и несолеобразующие; кислотные, основные, амфотерные. Классификация кислот по их силе, основности, наличию или отсутствию кислорода в их составе. Классификация оснований по их силе и кислотности. Классификация солей: средние, кислые, основные; двойные, смешанные и комплексные.
III. Номенклатура основных классов неорганических соединений.
IV. Понятия "кислота - основание" с позиции теорий электролитической диссоциации.
Выводы по теме:
1. По составу все неорганические соединения подразделяются на двухэлементные и многоэлементные. В эти группы могут входить соединения различных классов.
2. По функциональным признакам неорганические соединения подразделяются на классы в зависимости от характерных функций и поведения в химических реакциях.
3. Классификация определяет систему наименования (номенклатуру) веществ.
Вопросы для самопроверки:
1. Написать формулы оксидов, соответствующих указанным гидроксидам: H2SiO3, Cu(OH)2, H3AsO4, HMnO4, Al(OH)3.
2. Для оксидов CrO, Cr2O3, CrO3 привести формулы соответствующих гидроксидов.
3. Доказать характер (основный, кислотный, амфотерный) следующих соединений: ZnO, Cr(OH)3, Ba(OH)2, CO2.
4. Какие кислоты могут быть получены непосредственным взаимодействием с водой следующих оксидов: SO2, SO3, N2O5, NO2 ?
5. Какие из перечисленных кислот образуют кислые соли: HBr, H2S, H3AsO4 ?
6. Какие из приведенных оснований образуют основные соли: Cu(OH)2, NaOH, Al(OH)3?
7. Составить формулы средних и кислых солей ортофосфорной кислоты для натрия и кальция.
8. Составить формулы средних и основных солей для гидроксида железа (III) и гидроксида цинка.
9. Составить уравнения реакций, приводящих к образованию солей: KHSO3, K2SO3, CuOHCl, CuCl2.
10. Привести графические формулы для следующих соединений: Mn(OH)2, KMnO4, H2SeO4, K2HPO4, SO3.
Тема 2. Основные понятия и законы химии
Цели, задачи:
На фактическом уровне получения знаний:
1. Основные положения атомно-молекулярного учения;
2. Основные стехиометрические законы и законы идеальных газов;
3. Понятия эквивалента и фактора эквивалентности;
4. Закон эквивалентов.
На операционном уровне получения знаний:
Обучить студента:
1. Рассчитывать молярную массу и количества вещества;
2. Определять молярные массы эквивалентов простых и сложных веществ, участвующих в кислотно-основных и окислительно-восстановительных реакциях;
3. Определять молярные объемы эквивалентов газов, участвующих в кислотно-основных и окислительно-восстановительных реакциях;
4. Проводить рассчеты по химическим уравнениям, используя основные стехиометрические и газовые законы.
На аналитическом уровне получения знаний:
Обучить студента:
Использовать современные представления атомно-молекулярного учения для решения комплексных расчетных задач, сформулированных с учетом проблем, соответствующих будущей специальности студента.
Фактический материал:
I. Основные положения атомно-молекулярного учения. Понятия химического элемента, атома, молекулы. Химические формулы вещества: эмпирическая, молекулярная, графическая, структурная, пространственная. Простые и сложные вещества. Аллотропия. Абсолютные массы атомов и молекул. Относительная атомная масса. Относительная молекулярная масса. Количество вещества. Моль – единица измерения количества вещества. Молярная масса вещества. Расчеты по химическим уравнениям.
II. Основные стехиометрические законы. Закон сохранения массы вещества. Закон постоянства состава вещества. Закон объемных отношений. Объединенный газовый закон. Закон Авогадро и следствия из него. Абсолютная и относительная плотность газов. Понятие нормальных условий для газов. Молярный объем газов. Число Авогадро. Уравнение Клапейрона – Менделеева. Универсальная газовая постоянная.
III. Понятия эквивалента, фактора эквивалентности, молярной массы эквивалента, молярного объема эквивалента вещества. Нахождение молярных масс эквивалентов и молярных объемов эквивалентов простых и сложных веществ в кислотно-основных и окислительно-восстановительных реакциях. Закон эквивалентов и его практическое использование.
Выводы по теме:
1. Все вещества состоят из атомов. Состав и строение молекул определяют состояние вещества при выбранных условиях и его свойства. При химических явлениях молекулы разрушаются, но атомы сохраняются.
2. Расчеты количественных соотношений между элементами в соединениях или между веществами в химических реакциях называются стехиометрическими расчетами. В основе их лежат законы сохранения массы, постоянства состава, кратных отношений, а также газовые законы.
Вопросы для самопроверки:
1.Что является предметом изучения химии? Дать наиболее развернутое определение химии как науки. Выбрать любую из современных технологий и показать, какие химические процессы используются в этой технологии.
2. Дать определение понятий: а) химический элемент, атом, молекула; б) простое и сложное вещество; в) относительные атомная и молекулярная массы. Определить связь между понятиями « химический элемент» и « простое вещество». Применить эти понятия к молекулам О2 и О3.
3. Указать различия гомогенной смеси и химического соединения. Какие методы позволяют установить, является ли сложное вещество смесью более простых веществ или соединением?
4. Проиллюстрировать закон кратных отношений на примере оксидов азота, если по результатам химического анализа их проб установлены следующие массы элементов:
а) 18,662 г N и 10,672 г О;
б) 1,260 г N и 1,440 г О.
Составить эмпирические формулы соответствующих оксидов азота.
5. Какие параметры определяют физическое состояние газа, и какие условия состояния газа называют нормальными? Привести формулировки газовых законов и их математические выражения. Универсальная газовая постоянная, единицы измерения, области использования.
6. Что называют парциальным давлением газа? Сформулировать закон парциальных давлений Дальтона.
7. Привести определения эквивалента и фактора эквивалентности. Значения фактора эквивалентности для элементов, кислот, оснований, оксидов и солей, для веществ в окислительно-восстановительных реакциях.
8. Определить молярные массы эквивалентов веществ, участвующих в следующих реакциях:
а) Н3РО4 + 3NaOH = K3PO4 + 3H2O;
б) 4 Аl + 3O2 = 2 Al2O3 .
Раздел 2. Строение атома и химическая связь (6 часов)
Тема 1. Строение атома, периодический закон Д.И. Менделеева
Цели, задачи: На фактическом уровне получения знаний: 1. Основные положения квантовой механики, квантово-механическая модель атома, квантовые числа;Тема 2. Химическая связь
На фактическом уровне получения знаний: 1. Понятие молекулы и иона;Модуль 2. Надмолекулярный уровень организации вещества
Раздел 1 Межмолекулярное взаимодействие (6 часов)
Тема 1. Межмолекулярное взаимодействие
На фактическом уровне получения знаний: 1. Понятие межмолекулярного взаимодействия и его особенности; 2. Виды межмолекулярных взаимодействий и условия их возникновения.Тема 2. Агрегатные состояния вещества
На фактическом уровне получения знаний: 1. Понятия твердого, жидкого, газообразного и плазменного, конденсированного,… 2. Основные положения молекулярно-кинетической теории газов: модель идеального газа, параметры газов: T, P, V, С…Модуль 3. Закономерности протекания химических процессов
Раздел 1. Химическая термодинамика (18 часов)
Тема 1. I и II закон термодинамики
На фактическом уровне получения знаний: 1. Термодинамическое описание системы. Классификация систем и… 2. Термохимические законы;Тема 1. Кинетика химических процессов и химическое равновесие
На фактическом уровне получения знаний: 1. Понятие химической кинетики;Модуль 4. Растворы
Раздел 1. Общие сведения о растворах (12 часов)
Тема 1. Физико-химические свойства растворов
На фактическом уровне получения знаний: 1. Основные понятия, используемые для описания водных растворов: компонент,… 2. Состав растворов, способы выражения состава растворов;Тема 2. Растворы электролитов
На фактическом уровне получения знаний: 1. Электролиты сильные и слабые, кислоты, основания, соли, Изотонический… 2. Самоионизация растворителя, ионное произведение воды (Кw), водородный и гидроксильный показатели - pH и pOH,…Тема 1. Коллоидные растворы
На фактическом уровне получения знаний: 1. Коллоидное состояние вещества и основные условия возникновения такого… 2. Классификации дисперсных систем;Модуль 5. Основы электрохимии
Раздел 1. Окислительно–восстановительные процессы (6 часов)
Тема 1. Окислительно–восстановительные реакции
На фактическом уровне получения знаний: 1. Понятие эффективного заряда атома в молекуле. Окислители и восстановители.… 2. Окислительно-восстановительный потенциал, как мера окислительно-восстановительной способности химического элемента,…Тема 1. I род электродных процессов. Электродные процессы и электродвижущие силы в гальванических элементах.
На фактическом уровне получения знаний: 1. Предмет изучения электрохимии. Электродный потенциал металла, механизм его… 2. Гальванический элемент как химический источник тока. Принципиальная схема. Анод и катод как проводники первого…Тема 2. Электролиз
На фактическом уровне получения знаний: 1. Электролиз, как окислительно-восстановительный процесс; 2. Катод и анод, их поляризация от внешнего источника, характер процессов и их последовательность;Тема 3. Коррозия и защита металлов
На фактическом уровне получения знаний: 1. Определение процесса коррозии; 2. Виды коррозионных разрушений;Модуль 6. Специальные вопросы химии
Раздел 1. Высокомолекулярные соединения (8 часов)
Тема 1. Полимерные материалы
На фактическом уровне получения знаний: 1. Классификация и номенклатура высокомолекулярных соединений; 2. Методы получения полимеров;ШКОЛА ЕСТЕСТВЕННЫХ НАУК
МАТЕРИАЛЫ ЛАБОРАТОРНЫХ ЗАНЯТИЙ
по дисциплине «Химия»
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. ВладивостокЛабораторная работа №1
Определение молярной массы эквивалента металла
Рекомендации: при подготовке к работе необходимо уделить внимание понятию эквивалент и закону эквивалентов, а также обозначениям и единицам… Важнейшие понятия: атом, молекула, ион, эквивалент; относительная атомная… Следует уметь: давать определения важнейшим понятиям; формулировать стехиометрические законы: определять эквивалент…Экспериментальная часть
В работе для нахождения молярной массы эквивалента металла используется метод вытеснения водорода из кислоты с последующим измерением его объёма. Необходимо учитывать, что водород собирает вместе с парами воды. Поэтому требуется ввести поправку на парциальное давление водяных паров при температуре проведения опыта.
Методика выполнения опыта
Расчёты и обсуждение результатов
Первый способ: 1. Применив уравнение состояния идеального газа Клапейрона-Менделеева и, введя… 2. На основании закона эквивалентов вычислите молярную массу эквивалента металла:Лабораторная работа №2
Комплексные соединения
Рекомендации:при подготовке к работе повторите химические связи и механизмы образования связей; ответьте на контрольные вопросы. Важнейшие понятия: комплексное соединение, комплексообразователь, лиганд,… Следует уметь:характеризовать состав комплексного соединения; давать определение понятиям: комплексообразователь,…Экспериментальная часть
Опыт 1. Получение комплексных соединений
Таблица 2.1 Данные к опыту 1 Вариант Реакции Вариант … *)продукт реакции сохранить для опыта 2;Опыт 2. Разрушение комплексных ионов
Таблица 2.2 Данные к опыту 2 Вариант Реакция Вариант Реакция NaF …Опыт 3. Участие комплексных ионов в реакциях обмена
Таблица 2.3 Данные к опыту 3 Вариант Реакция Вариант Реакция …Опыт 4. Диссоциация комплексных и двойных солей
Таблица 2.4 Данные к опыту 4 Вариант Исследуемые вещества …Лабораторная работа №3
Определение теплового эффекта реакции нейтрализации
Рекомендации:при подготовке к работе необходимо повторить раздел «Химическая термодинамика», ответить на все контрольные вопросы. Важнейшие понятия:система (гомогенная и гетерогенная); термодинамические… Следует уметь:объяснять все важнейшие понятия и давать им определения; определять тип системы; записывать…Экспериментальная часть
Методика проведения опыта
Таблица 3.1 Объемы исходных веществ Вариант …Обработка результатов эксперимента
2. Рассчитайте количество теплоты Q(Дж), выделившейся в ходе реакции: Q =(mкис + mшел)∆ТС+W∆T, где mкис и mшел – массы кислоты и щелочи, равные их объемам (ρ=1г/см3); С – удельная теплоемкость разбавленного…Лабораторная работа №4
Химическая кинетика
Рекомендации: познакомьтесь с теоретическими основами работы по литературным источникам. Важнейшие понятия: истинная и средняя скорости, константа скорости,… Следует уметь: записывать кинетическое уравнение для гомогенной и гетерогенной реакции; рассчитывать скорость…Экспериментальная часть
Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓ + H2O Реакция в ионно-молекулярном виде: S2O3-2 + 2Н+ = SO2 + S↓ + Н2О.Опыт 2. Зависимость скорости реакции от температуры
Методика выполнения опыта В три пробирки налейте по 2 мл раствора Na2S2O3, поставьте в стакан с горячей… Рассчитайте средний температурный коэффициент реакции:Лабораторная работа №5
Гидролиз солей
Цель работы:изучение процесса гидролиза солей разного типа, установление количественных характеристик процесса гидролиза, изучение влияния различных… Рекомендации:по литературным источникам ознакомиться со следующими… Важнейшие понятия:гидролиз солей, образование многоядерных комплексов, водородный показатель, степень и константа…Экспериментальная часть
Опыт 1. Реакция среды водного раствора соли
Таблица 5.1 Данные к опыту 1 Вариант Соли …Опыт 2. Влияние различных факторов на степень гидролиза
В сухую пробирку внесите с помощью пипетки 10-15 капель насыщенного раствора ацетата натрия и 1 каплю раствора фенолфталеина. Отметьте появление… Опыт 2.2. Влияние температуры на степень гидролиза солиЛабораторная работа № 6
Коллоидные растворы
Цель работы: получить конденсационным методом ряд коллоидных растворов, определить знак коллоидных частиц, провести их коагуляцию. Краткие теоретические основы: Коллоидным раствором называется система, состоящая из частиц дисперсной фазы и дисперсионной среды. Частицы…Экспериментальная часть
Опыт 1. Получение золя канифоли
В колбочку, содержащую 50 мл воды, добавьте 3 – 4 капли спиртового раствора канифоли, перемешайте. Что при этом наблюдаете? Посмотрите полученный раствор в проходящем и отраженном свете. К какому методу относится данный способ получения золей? Сохраните золь для определения знака заряда его частиц.
Опыт 2. Получение золя гидроксида железа
Опыт 3. Капельный метод определения знака заряда коллоидных частиц
В случае положительного заряда коллоидных частиц капля золя, нанесенная на фильтровальную бумагу, расслаивается, так как бумага в воде заряжается отрицательно, положительно заряженные частицы адсорбируются в центре капли.
В случае отрицательного заряда коллоидных частиц такого резкого расслоения на бумаге не наблюдается.
Нанесите по капле полученных ранее золей на фильтровальную бумагу. Определите в каждом случае знак заряда коллоидных частиц.
Опыт 4. Коагуляция золей от действия электролитов
Через несколько минут посмотрите, что произошло в пробирках. Отметьте, в какой из пробирок быстрей выпадает осадок и почему? б) в три пробирки налейте одинаковое количество гидрозоля сульфида сурьмы и…Опыт 5. Практическое использование явления коагуляции
В две пробирке налейте по 2 – 3 мл мутной воды, содержащей глину или коалин Al2O3·2SiO2·2H2O. В одну пробирку прилейте 2 – 3 мл раствора алюмокалиевых квасцов KAl(SO4)2, а другую пробирку оставьте для сравнения.
Что при этом наблюдаете? Объясните происходящее явление и укажите, где оно находит практическое использование?
Лабораторная работа № 7
Электрохимические процессы
Цель работы: познакомиться с процессами взаимного превращения химической и электрической энергий. Рекомендации:повторите теорию окислительно-восстановительных процессов,… Важнейшие понятия:электрод, типы электродов, стандартный электродный потенциал, водородная шкала потенциалов,…Экспериментальная часть
Опыт 1. Медно - цинковый гальванический элемент
Опыт 2. Гальванический элемент Вольта Собрать такую же схему, что и в опыте 1, но в качестве катодного раствора взять 1М раствора H2SO4. Замкнуть внутреннюю…Опыт 5. Электролиз раствора серной кислоты с активным (растворимым) анодом
В электролизер поместить 2М раствор серной кислоты. В качестве катода использовать угольный электрод, анода - медный. Включить выпрямитель. Какие процессы протекают на электродах? Что наблюдаете?
Лабораторная работа № 8
Коррозия металлов
Цель работы: изучение важнейших процессов, протекающих при коррозии металлов. Контрольные вопросы:Экспериментальная часть
Опыт 1. Исследование относительной скорости коррозии железа в присутствии различных металлов
При электрохимической коррозии одни участки поверхности металла служат анодами, другие – катодами. На катодные участки притекают избыточные… Роль анода выполняет более активный металл, имеющий меньшую величину… Возьмите три одинаковых куска железной проволоки (гвозди). Один из них покройте медью. Для этого хорошо очистите…Опыт 2. Влияние ионов хлора на процесс коррозии алюминия
В две пробирки налейте по 2 – 3 мл 0,5 М CuSO4 и в каждую пробирку опустите по кусочку алюминиевой проволоки или стружки. Какие изменения произошли в пробирках? В одну из пробирок внесите немного кристаллов хлорида натрия. Что наблюдаете? Объясните влияние ионов хлора на процесс коррозии. Напишите реакции коррозии алюминия в растворе CuSO4. Назовите тип деполяризации и вид коррозии.
Опыт 3. Изучение защитных свойств металлических покрытий. Коррозия оцинкованного и луженого железа
В две пробирки налейте по 4 – 5 мл 0,1 М раствора серной кислоты и по 0,5 мл…Опыт 4. Ингибиторная защита металла от коррозии в кислой среде
На два часовых стекла поместите по грануле цинка и по несколько капель HCl, разбавленной 1 : 1. Когда начнется интенсивная реакция, на одно стекло добавьте несколько кристалликов уротропина. Запишите уравнение реакции цинка с кислотой. В выводе объясните суть ингибиторной защиты металлов от коррозии.
Лабораторная работа № 9
Общие свойства металлов
Цель работы: изучить химические свойства металлов – важнейших конструкционных материалов. Оценить химическую устойчивость металлов в различных… Контрольные вопросы и задания:Экспериментальная часть
Опыт 1. Ряд напряжений металлов
Установите сравнительную активность некоторых металлов на основании реакций вытеснения металлов из их солей другими металлами. Для этого налейте в пробирки растворы следующих солей: сульфата цинка, нитрата свинца, сульфата железа, сульфата меди и опустите в каждую пробирку по кусочку цинка. Через 2 – 3 минуты наблюдайте изменения, происходящие на поверхности цинка.
Аналогичные опыты проделайте с железом, свинцом и медью.
Опыт 2. Действие кислот на металлы
Характер действия кислот на металлы зависит от свойств и концентрации кислоты, а также от химического характера металла, определяемого положением металла в ряду напряжений.
В две пробирки опустите по кусочку цинка и прилейте в одну пробирку 1 – 2 мл концентрированной, а в другую – разбавленной серной кислоты. Что наблюдаете? Аналогичные опыты проделайте с металлами: Fe, Cu, Al, Zn.
Опыт 3. Действие щелочей на металлы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИШКОЛА ЕСТЕСТВЕННЫХ НАУК
МАТЕРИАЛЫ ДЛЯ ОРГАНИЗАЦИИ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ
по дисциплине «Химия
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. Владивосток
Модуль 1. Атомно-молекулярный уровень организации вещества
Основы атомно-молекулярного учения
При рассмотрении этой темы основное внимание уделить разделам: 1. Газовые законы; 2. Закон эквивалентов.Закон эквивалентов
Фактор эквивалентности f- число, показывающее какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода в… f=, где z- либо число ионов водорода, участвующих в реакции (для кислот); -…Модуль 3. Закономерности протекания химических процессов
Элементы химической термодинамики
1.Основные термодинамические функции: теплоту, работу, внутреннюю энергию, энтальпию, энтропию, изобарно-изотермический и изохорно-изотермический… 2. Виды термодинамических процессов; 3. Сущность первого закона термодинамики, его математическое выражение и применение к различным процессам;Химическая кинетика
1. скорость химической реакции: истинная и средняя 2. константа скорости химической реакции 3. порядок и молекулярность реакцииМодуль 4. Растворы
Способы выражения состава растворов
Способы выражения состава раствора: Массовая доля С(Х) или W(X) –число граммов растворенного вещества,… С(Х) = 100% или С(Х) = 100%,С(Х) = ; С(Х) = ; С(Х) = z C(X).
Мольная доля – отношение числа моль данного вещества к сумме числа моль всех веществ, находящихся в растворе.
 =
= 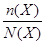 ,
,
где n(X) – количество вещества Х в растворе, моль
N(X) – общее количество всех веществ в растворе, моль.
Моляльная концентрация Сm - число моль растворенного вещества Х приходящееся на 1 кг чистого растворителя.
Сm =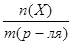 , [
, [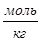 ]
]
Если для расчетов используются массы всех веществ в граммах, то формула имеет вид Сm = 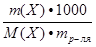 , [
, [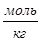 ]
]
Пример 1. Вычислить массу гидроксида натрия и воды, необходимые для приготовления 2 л 10% раствора гидроксида натрия (плотность раствора равна 1,109 г/мл).
Решение:а) Зная объем и плотность, находим массу раствора, который необходимо приготовить m = V
= V
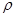

m = 2000 мл ∙1,109 г/мл = 2218 г
= 2000 мл ∙1,109 г/мл = 2218 г
10% раствор NaOH в 100 г раствора содержит 10 г NaOH,
следовательно в 2218 г раствора содержится х г NaOH
x =  = 221,8 (г)
= 221,8 (г)
Массу воды, в которой необходимо растворить 221,8 г NaOH, находим по формуле m(H O) = m(раствора) – m(NaOH) = 2218 – 221,8 = 1996,2 (г).
O) = m(раствора) – m(NaOH) = 2218 – 221,8 = 1996,2 (г).
б) Задачу можно решить, используя формулу массовой доли
C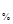 (NaOH) =
(NaOH) =  100%, откуда
100%, откуда
m(NaOH) = 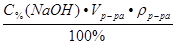
m(NaOH) =  = 221,8 г
= 221,8 г
m(H O) = m(раствора) – m(NaOH) = 2000 мл ∙ 1,109 г/мл – 221,8 г = 1996,2 г.
O) = m(раствора) – m(NaOH) = 2000 мл ∙ 1,109 г/мл – 221,8 г = 1996,2 г.
Ответ: 221,8 г NaOH и 1996,2 г H O
O
Пример 2. К 200 мл 28 % раствора соляной кислоты (плотность раствора равна 1,142 г/мл) добавили 500 мл воды. Вычислить молярную концентрацию полученного раствора и определить массовую долю HCl в растворе.
Решение: Находим массу 28 % раствора соляной кислоты
m = V
= V
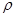
 = 200 мл ∙1,142 г/мл = 228,4 г
= 200 мл ∙1,142 г/мл = 228,4 г
Исходя из формулы массовой доли C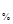 (HCl) =
(HCl) = 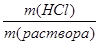 100%,
100%,
находим m(HCl) = 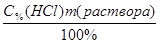 =
=  = 63,952 г.
= 63,952 г.
После добавления 500 мл воды количество HCl не изменилось.
С(HCl) = 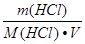 =
= 
С(HCl) = 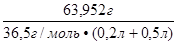 = 2,5 моль/л
= 2,5 моль/л
В 1 л раствора соляной кислоты содержится 2,5 моль HCl.
Массовую долю HCl в полученном растворе находим по формуле
C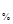 (HCl) =
(HCl) =  100%, =
100%, = 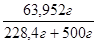 100% = 8,78 %, в т.ч. m(воды) = V(воды)
100% = 8,78 %, в т.ч. m(воды) = V(воды) 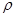 (воды) = 500 мл ∙1 г/мл = 500 г.
(воды) = 500 мл ∙1 г/мл = 500 г.
В 100 г полученного раствора содержится 8,78 г HCl.
Ответ: С(HCl) = 2,5 моль/л, C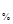 (HCl) = 8,78 %
(HCl) = 8,78 %
Пример 3. Сколько мл 96 % серной кислоты (плотность равна 1,84 г/мл) нужно взять для приготовления 500 мл 0,1 H раствора серной кислоты?
Решение:Исходя из формулы молярной концентрации эквивалента,
С( H
H SO
SO ) =
) = 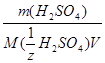
рассчитываем массу серной кислоты в 0,1 Н растворе
m(H SO
SO ) =C(
) =C( H
H SO
SO )∙M(
)∙M( H
H SO
SO )∙V
)∙V
m(H SO
SO ) = 0,1моль/л ∙ 49 г/моль 0,5 л =2,45 г
) = 0,1моль/л ∙ 49 г/моль 0,5 л =2,45 г
M( H
H SO
SO ) =
) =  M( H
M( H SO
SO ) =
) = 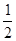 98 г/моль = 49 г/моль
98 г/моль = 49 г/моль
Из определения массовой доли следует, что в 100 г раствора содержится 96 г H SO
SO , а необходимая нам масса кислоты 2,45 г содержится в х г 96 % раствора . 100 г раствора - 96 г H
, а необходимая нам масса кислоты 2,45 г содержится в х г 96 % раствора . 100 г раствора - 96 г H SO
SO
х г раствора - 2,45 г H SO
SO
х = 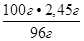 = 2,55 г раствора 96 % H
= 2,55 г раствора 96 % H SO
SO
Разделив массу раствора на его плотность, получим объем 96 % раствора H SO
SO .
.
V =
= 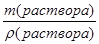 =
=  = 1,39 мл
= 1,39 мл
Если для решения использовать формулу массовой доли
С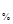 (H
(H SO
SO ) =
) = 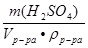 100 % , то V
100 % , то V =
= 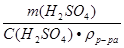 100 %
100 %
V =
= 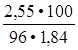 = 1,39 мл
= 1,39 мл
Ответ: нужно взять 1,39 мл 96 % раствора H SO
SO и
и
разбавить водой до 500 мл.
Пример 4. Для нейтрализации раствора, содержащего 0,04 г гидроксида натрия, потребовалось 10 мл раствора соляной кислоты. Вычислить молярную концентрацию эквивалента соляной кислоты.
Решение: NaOH + HCl = NaCl + H O
O
Cогласно закону эквивалентов, число моль эквивалентов всех веществ, участвующих в химической реакции одинаково: n( NaOH) = n(
NaOH) = n( HCl)
HCl)
или С( NaOH) ∙V(NaOH) = C(
NaOH) ∙V(NaOH) = C( HCl) ∙V(HCl).
HCl) ∙V(HCl).
Отсюда C( HCl) =
HCl) =  =
=  .
.
Зная массу гидроксида натрия, определяем n( NaOH) =
NaOH) =  =
=
= 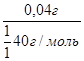 = 0,001 моль.
= 0,001 моль.
Следовательно, C( HCl) =
HCl) = 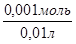 = 0,1 моль/л.
= 0,1 моль/л.
Ответ: C( HCl) = 0,1 моль/л
HCl) = 0,1 моль/л
Задания для самостоятельного решения:
1. Сколько граммов воды нужно взять для растворения 1 кг сахара, чтобы получить его 5 % раствор?
2. Определить молярную концентрацию эквивалента 8 % раствора серной кислоты (плотность раствора равна 1,06 г/мл).
3. Плотность 30 % раствора хлорида натрия равна 1,18 г/мл. Выразить состав раствора в мольных долях и в молях на 1 л раствора.
4. Плотность 2,3 % раствора аммиака равна 0,99 г/мл. Рассчитать молярную и моляльную концентрации раствора.
5. Сколько хлороводорода растворено в 50 мл 10 % раствора соляной кислоты (плотность раствора равна 1,05 г/мл)? Найти молярную концентрацию эквивалента соляной кислоты.
6. Сколько мл 70 % раствора нитрата калия (плотность раствора равна 1,6 г/мл) нужно взять, чтобы приготовить 500 мл раствора нитрата калия с молярной концентрацией 0,2 моль/л?
7. Вычислить массовую долю гидроксида калия в растворе с молярной концентрацией эквивалента 4,2 моль/л и плотностью 1,176 г/мл.
8. В каком объеме 0,2 Н раствора содержится 16 г сульфата меди (II)?
9. Смешали 100 мл 20 % раствора (плотность равна 1,1г/мл) и 200 мл 10 % раствора соляной кислоты (плотность равна 1,06 г/мл). Вычислить массовую долю и молярную концентрацию полученного раствора соляной кислоты.
10. Какова массовая доля азотной кислоты в растворе с молярной концентрацией 14,8 моль/л и плотностью 1,4 г/мл?
11. К 40 г фосфата натрия прилили 500 г 5 % раствора этого вещества. Вычислить массовую долю фосфата натрия в полученном растворе.
12. Рассчитать молярную концентрацию эквивалента 30 % раствора фосфорной кислоты (плотность раствора равна 1,18 г/мл).
13. Сколько мл раствора щелочи с молярной концентрацией эквивалента 0,1 моль/л потребуется для осаждения в виде Fe(OH) всего железа, содержащегося в 250 мл раствора хлорида железа (III) c молярной концентрацией эквивалента 0,2 моль/л?
всего железа, содержащегося в 250 мл раствора хлорида железа (III) c молярной концентрацией эквивалента 0,2 моль/л?
14. Сколько граммов 5 % раствора нитрата серебра требуется для обменной реакции со 120 мл раствора хлорида алюминия с молярной концентрацией эквивалента 0,6 моль/л?
15. Определить массовую долю, моляльную концентрацию и молярную концентрацию эквивалента следующих растворов:
а) в 600 мл раствора находится 5 г сульфата алюминия;
б) в 100 г воды растворили 1,71 г гидроксида бария;
в) 50 г хлорида кальция растворили в 250 мл воды;
г) 2,5 г карбоната калия в 400 мл раствора;
д) в воде объемом 300 мл растворили 50 г хлорида хрома (III).
Плотность растворов считать равной 1г/мл.
Равновесия в растворах электролитов
Электролитами называют вещества, расплавы и растворы которых проводят электрический ток. Неэлектролиты электрический ток не проводят. Электролиты… КА К+ А; HNOH+ NO, а слабые – частичноКоллигативные свойства растворов
Основной закон, определяющий коллигативные свойства – закон Рауля. Он устанавливает, что относительное понижение давления насыщенного пара… = N или = , где Р– давление насыщенного пара над чистым растворителем;Модуль 5. Основы электрохимии
1. окислитель, восстановитель, окисление, восстановление; 2. катод, анод; 3. электродный потенциал;Контрольные вопросы
1.Что такое окислитель; восстановитель? Приведите примеры типичных окислителей и восстановителей.
2. Какой процесс называется окислением; восстановлением?
3. Как рассчитать ЭДС окислительно-восстановительной реакции?
Каковы критерии самопроизвольного протекания окислительно-восстановительного процесса? Как связана ЭДС с изменением энергии Гиббса?
4. Как рассчитать молярную массу эквивалента вещества, участвующего в окислительно-восстановительном процессе?
5. В чем заключается механизм возникновения электродного потенциала?
6. Привести уравнение Нернста для расчета электродного потенциала. Какие факторы влияют на величину потенциала? Что называют стандартным электродным потенциалом?
7. Какой электрод называют катодом; анодом?
8. Что называют гальваническим элементом? Какой гальванический элемент называют концентрационным? Как вычислить ЭДС гальванического элемента?
9.Что такое электролиз? Указать порядок разрядки ионов на электродах при электролизе.
10. Сформулировать законы Фарадея. Определить понятие электрохимического эквивалента.
Пример 1.Определить для стандартных условий возможность протекания окислительно- восстановительной реакции между ионами олова  и церия
и церия 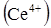 , если φ
, если φ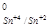 = 0,15 B; φ
= 0,15 B; φ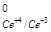 = 1,74 B.
= 1,74 B.
Решение: Термодинамическим условием самопроизвольного протекания окислительно-восстановительной реакции в водном растворе в прямом направлении является положительное значение ЭДС.
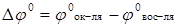 >0; это возможно в том случае, еслиφ0ок> φ0восс.
>0; это возможно в том случае, еслиφ0ок> φ0восс.
φ > φ
> φ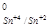 , значит окислитель необходимо искать в паре Се
, значит окислитель необходимо искать в паре Се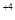 | Cе
| Cе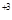 , а восстановитель – в паре Sn
, а восстановитель – в паре Sn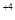 | Sn
| Sn .
.
Окислитель должен принимать электроны, а восстановитель – отдавать. Значит Се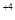 - окислитель, Sn
- окислитель, Sn - восстановитель.
- восстановитель.
Составляем процессы окисления, восстановления.
Sn - 2e
- 2e 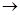 Sn
Sn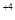 окисление
окисление
Се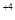 +1е
+1е 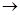 Се
Се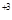 восстановление
восстановление
Sn + 2Ce
+ 2Ce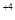 = Sn
= Sn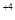 + 2Ce
+ 2Ce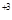 - суммарное ионное уравнение окислительно-восстановительной реакции
- суммарное ионное уравнение окислительно-восстановительной реакции
SnCl2 + 2СеCl4= SnCl4 + 2CeCl3 - cуммарное молекулярное уравнение.
ЭДС данной реакции рассчитываем по формуле:
 φ
φ = φ
= φ - φ
- φ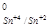 = 1,74 – 0,15 = 1,59 (B).
= 1,74 – 0,15 = 1,59 (B).
 φ
φ > 0, cледовательно процесс протекает самопроизвольно.
> 0, cледовательно процесс протекает самопроизвольно.
Ответ: реакция возможна между Се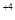 и Sn
и Sn
Пример 2. Покажет ли амперметр ток во внешней цепи гальванического элемента Pb|Pb ||Cu
||Cu |Cu, если С
|Cu, если С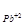 = 10
= 10 моль/л, а С
моль/л, а С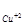 = 10
= 10 моль/л.
моль/л.
Для реакции, лежащей в основе работы гальванического элемента, рассчитайте энергию Гиббса и значение константы равновесия.
Решение: В гальваническом элементе Pb|Pb ||Cu
||Cu |Cu электродные реакции описываются следующими уравнениями:
|Cu электродные реакции описываются следующими уравнениями:
A: Pb – 2e 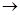 Pb
Pb окисление
окисление
К: Cu + 2e
+ 2e 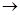 Cu восстановление
Cu восстановление
Pb + Cu
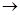 Pb
Pb +Cu токообразующая реакция
+Cu токообразующая реакция
Рассчитаем значения электродных потенциалов, пользуясь уравнением Нернста:
φ =φ
=φ
 +
+ lg C
lg C = - 0,13 +
= - 0,13 +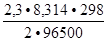 lg 10
lg 10 =
=
= - 0,13 + (-2) = - 0,13 – 0,059 = - 0,189 (B),
(-2) = - 0,13 – 0,059 = - 0,189 (B),
φ = φ
= φ +
+  lg C
lg C 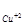 = 0,34 +
= 0,34 + 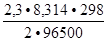 lg 10
lg 10 =
=
= 0,34 + (-1) = 0,34 – 0,0295 = 0,3105 (B).
(-1) = 0,34 – 0,0295 = 0,3105 (B).
ЭДС (Е, В) рассчитываем через электродные потенциалыЕ = φ к - φ а,
Е = 0,3105 – (- 0,189) = 0,4995 (B), т.к. Е > 0 , следовательно, амперметр ток покажет.
Изменение энергии Гиббса для токообразующей реакции рассчитываем по уравнению 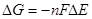 .
.
 G = - 2∙96500∙0,4995 = - 96403,5 Дж = - 96,4 кДж,
G = - 2∙96500∙0,4995 = - 96403,5 Дж = - 96,4 кДж,
 G < 0, токообразующая реакция протекает самопроизвольно.
G < 0, токообразующая реакция протекает самопроизвольно.
Значение константы равновесия находим по формуле
К = 10
= 10 , где n – число электронов, участвующих в реакции,
, где n – число электронов, участвующих в реакции,
E - стандартное ЭДС.
- стандартное ЭДС.
Е =
=  = 0,34 – (-0,13) = 0, 47 (B),
= 0,34 – (-0,13) = 0, 47 (B),
K = 10
= 10
 = 10
= 10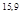 = 10
= 10 ∙10
∙10 = 8,3∙10
= 8,3∙10 >>10
>>10
Столь большое значение константы равновесия говорит о том, что процесс практически протекает полностью.
Ответ: амперметр покажет ток во внешней цепи.
Пример 3. Определите концентрацию ионов Fe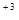 в растворе, при которой потенциал железного электрода Fe|Fe
в растворе, при которой потенциал железного электрода Fe|Fe при 250С равен потенциалу водородного электрода в растворе с рН = 2.
при 250С равен потенциалу водородного электрода в растворе с рН = 2.
Решение: По условию задачи φ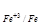 = φ
= φ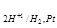 . Находим потенциал водородного электрода при 25
. Находим потенциал водородного электрода при 25 С: φ
С: φ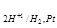 = - 0,059pH = - 0,059∙2 = - 0,118 B.
= - 0,059pH = - 0,059∙2 = - 0,118 B.
Cледовательно, φ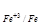 = - 0,118 B.
= - 0,118 B.
По уравнению Нернста φ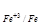 = φ
= φ +
+ ∙lgC
∙lgC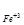 . Отсюда выражаем концентрацию ионов железа -0,118 = - 0,04 +
. Отсюда выражаем концентрацию ионов железа -0,118 = - 0,04 +  ∙lg C
∙lg C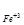 ,
,
- 0,118+ 0,04 =  ∙lg C
∙lg C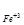 , - 0,078 = 0,0197∙ lg C
, - 0,078 = 0,0197∙ lg C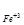 , - 3,96 = lg C
, - 3,96 = lg C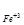 , C
, C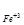 = 10
= 10 = 10
= 10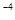 ∙10
∙10 = 1,1∙10
= 1,1∙10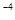 ( моль/л ).
( моль/л ).
Ответ: С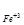 = 1,1∙10
= 1,1∙10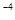 моль/л.
моль/л.
Задания для самостоятельного решения;
1. В следующих окислительно-восстановительных реакциях:
а) укажите окислитель и восстановитель, рассчитайте их молярные массы эквивалентов;
б) подберите коэффициенты в уравнениях реакций, используя соответствующие методы подбора;
в) определите направление самопроизвольного протекания реакций:
| № | Схема реакции
|
Al + S = Al2S3   SnCl4 + KJ = SnCl2 + J2 + KCl
SnCl4 + KJ = SnCl2 + J2 + KCl
| |
| NH3 + O2 = N2 + H2O KMnO4 + H2O2 + H2SO4 = MnSO4 + O2 + K2SO4 + H2O | |
| Ti + HCl = TiCl3 + H2 K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O | |
| Zn + NaOH + H2O = Na2 [Zn(OH)4] + H2 CdS + O2 = CdO + SO2 | |
| Cu(NO3)2 = CuO + NO2 + O2 Na2S + NaClO + H2SO4 = S + NaCl + Na2SO4 + H2O | |
| Cu + FeSO4 = CuSO4 + Fe K2SO3 + Cl2 + H2SO4 = K2SO4 + HCl + H2O | |
| FeCl3 + KBr = Br2 + FeCl2 + KCl K2Cr2O7 = K2CrO4 + Cr2O3 + O2 | |
| As2O3 + HclO + H2O = H3AsO4 + HCl Zn + AgNO3 = Zn(NO3)2 + Ag | |
| HJO3 + KCl = KclO3 + J2 + H2O Na2SO3 = Na2S + Na2SO4 | |
| MnSO4 + K2Cr2O7 + H2SO4 = HmnO4 + Cr2(SO4)3 + K2SO4 + H2O Cl2+ J2 + H2O = HCl + HJO3 | |
| Cr(OH) 3+ Br2 + KOH = K2CrO4+ KBr + H2O HNO3 + S = H2SO4 + NO | |
| Si + NaOH + H2O = Na2SiO3 + H2 H2S + J2 = HJ + S | |
| Cu + HNO3 = Cu(NO3)2 + NO2 + H2O Cl2 + NaOH = NaCl + NaClO3 + H2O | |
| KmnO4 + HCl = KCl + MnCl2 + Cl2 + H2O Mg + Al(NO3)3 = Mg(NO3)2 + AL | |
| HJ + H2SO4 = J2 + H2S + H2O Al + KOH + H2O = K[Al(OH)4] + H2 |
2. Используя метод ионно-электронного баланса, составьте молекулярные уравнения окислительно-восстановительных процессов в направлении их самопроизвольного протекания для следующих сопряженных пар:
φ
| φ
| |
φ
| φ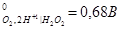
| |
φ
| φ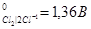
| |
φ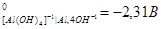
| φ
| |
φ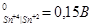  
| φ
| |
φ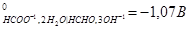
| φ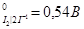
| |
φ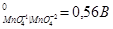
| φ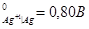
| |
φ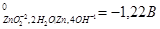
| φ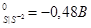
| |
φ
| φ
| |
φ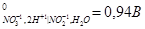
| φ
| |
φ
| φ
| |
φ
| φ
| |
φ
| φ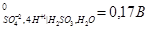
| |
φ = 0,42В = 0,42В
| φ
| |
φ
| φ
|
3. Вычислить константу равновесия окислительно-восстановительной реакции:
1. 2S2O3-2 + I2 = S4O6-2 + 2I-1;
2. 2MnO4-1 + 5HNO2 + H+1 = 2Mn+2 +5NO3-1 + 3H2O;
3. H2S + I2 = 2H+1 + S + 2I-1;
4. H2SO3 + I2 + H2O = SO4-2+2I-1+ 4H+1;
5. 3P + 5NO3-1 + 2H2O = 3PO4-3 + 5NO + 4H+1;
6. S + 6NO3-1 + 4H+1 = SO4-2 + 6NO2 + 2H2O;
7. Cl2 + 2OH-1 = ClO + Cl
+ Cl + H2O;
+ H2O;
8. 6Fe+2 + Cr2O7-2+ 14H+1 = 6Fe+3 + 2Cr+3 + 7H2O;
9. Fe+3 + Ce+3 = Fe+2 + Ce+4;
10. Cr2O7-2 + 6Cl-1 + 14H+1 = 2Cr+3 + 3Cl2 + 7H2O;
11. S + 2H2SO4 = 3SO2 + H2O;
12. Cu + 2Ag+1 = Cu+2 + 2Ag;
13. 10Fe+2 + 2ClO3-1 + 12H+1 = Cl + 10Fe+3 + 6H
+ 10Fe+3 + 6H O;
O;
14. 3N2H4 + 2BrO3-1 = 3N2 + 2Br-1 + 6H2O;
15. Sn+2 + 2Fe+3 = Sn+4 + 2Fe+2;
4. а) Составьте схемы работающих гальванических элементов, используя предложенные электроды;
б) Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций;
в) Рассчитайте значения электродных потенциалов при заданных условиях;
г) Рассчитайте значение электродвижущей силы гальванического элемента и энергию Гиббса токообразующей реакции;
д) Сравните полноту протекания токообразующих реакций в гальванических элементах.
| № | Схемы электродов | С катодного электpолита моль/л | С анодного электролита моль/л | Т |
Fe | Fe ,Zn | Zn ,Zn | Zn , Pt, H , Pt, H | 2H | 2H
| 0,1 | 0,01 | 18 C C
| |
Ni | Ni , Cu | Cu , Cu | Cu , Pt | Fe , Pt | Fe , Fe , Fe
| 0,01 | 10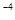
| 25 C C
| |
Sn | Sn , Ag | Ag , Ag | Ag , Pt, O , Pt, O | 2OH | 2OH
| 10
| 10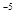
| 273 K | |
Mg | Mg , Cr | Cr , Cr | Cr , Fe | Fe , Fe | Fe
| 10
| 10
| 293 K | |
Al |Al , Pt, H , Pt, H | 2H | 2H , V | V , V | V
| 10
| 0,1 | 298 K | |
Pb | Pb , Fe | Fe , Fe | Fe , Ag | AgCl, Cl , Ag | AgCl, Cl
| 10
| 0,01 | 291 K | |
Cr | Cr , Ag | Ag , Ag | Ag , Pt | Pt , Pt | Pt
| 0,1 | 0,001 | 20 C C
| |
Cd | Cd , Zn | Zn , Zn | Zn , Pt, H , Pt, H | 2H | 2H
| 10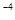
| 10
| 300 K | |
Al | Al , Pb | Pb , Pb | Pb , Mn | Mn , Mn | Mn
| 10
| 10
| 18 C C
| |
Cu | Cu , Pt, Cl , Pt, Cl | 2Cl | 2Cl , Co | Co , Co | Co
| 0,01 | 0,1 | 25 C C
| |
Au |Au , Sn | Sn , Sn | Sn , Zn | Zn , Zn | Zn
| 10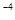
| 10
| 291 K | |
Mg | Mg ,Cu | Cu ,Cu | Cu , Ag|AgCl, Cl , Ag|AgCl, Cl
| 10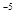
| 10
| 310 K | |
Fe | Fe , Ag | Ag , Ag | Ag , Ni | Ni , Ni | Ni
| 10
| 10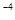
| 10 C C
| |
Pt,H | 2H | 2H , Al | Al , Al | Al , Cu | Cu , Cu | Cu
| 10
| 10
| 25 C C
| |
Zn | Zn , Ni | Ni , Ni | Ni , Mg | Mg , Mg | Mg
| 10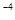
| 10
| 298 K |
Пример 1. Будут ли отличаться по составу продукты электролиза расплава и водного раствора хлорида кальция? Электроды графитовые.
Решение: а) Электролизом называют окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита. При этом на катоде происходит процесс восстановления – присоединения электронов
из внешней электрической цепи, а на аноде происходит процесс окисления – отдача электронов в цепь.
При прохождении тока через расплав хлорида кальция катионы кальция Са движутся к отрицательно-заряженному электроду (катоду), на котором восстанавливаются. Анионы хлора Cl
движутся к отрицательно-заряженному электроду (катоду), на котором восстанавливаются. Анионы хлора Cl перемещаются к положительно-заряженному электроду (аноду) и, отдавая электроны, окисляются.
перемещаются к положительно-заряженному электроду (аноду) и, отдавая электроны, окисляются.
Электролиз расплава хлорида кальция можно представить схемой:
CaCl = Ca
= Ca + 2Cl
+ 2Cl
(-) катод | Ca 2Cl
2Cl | анод (+)
| анод (+)
К: Са + 2е = Са
+ 2е = Са
А: 2Cl - 2e = Cl
- 2e = Cl
Ca + 2Cl
+ 2Cl = CaCl
= CaCl или CaCl
или CaCl = Сa + Cl
= Сa + Cl
б) На ход электролиза из водных растворов большое влияние оказывают растворитель и материал электродов. При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Используют следующие правила:
На катоде:
1) катионы металлов со стандартным электродным потенциалом большим, чем φ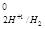 почти полностью восстанавливаются и выделяются в виде металла Me+n + ne = Me;
почти полностью восстанавливаются и выделяются в виде металла Me+n + ne = Me;
2) катионы металлов с малой величиной стандартного электродного потенциала (металлы начала ряда Li , Na
, Na , K
, K … до Al
… до Al включительно) не восстанавливаются, в этом случае восстанавливается водород из воды по уравнению
включительно) не восстанавливаются, в этом случае восстанавливается водород из воды по уравнению 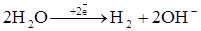 ;
;
3) катионы металлов, характеризующиеся средними значениями стандартных электродных потенциалов ( φ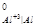 < φ
< φ < φ
< φ ) восстанавливаются одновременно с молекулами воды.
) восстанавливаются одновременно с молекулами воды.
На аноде:
1) нерастворимые аноды (графитовые, платиновые и т.д.) не претерпевают окисления в ходе электролиза, растворимые – могут окисляться и переходить в раствор в виде ионов;
2) при электролизе растворов, содержащих в своем составе анионы F-1, SO , NO
, NO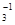 , PO
, PO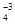 …, а также растворов щелочей (OH-1) выделяется кислород;
…, а также растворов щелочей (OH-1) выделяется кислород;
2H2O – 4e = O2 + 4H+1 или 4OH-1 – 4e = 2H2O + O2;
3) при окислении анионов Cl-1, Br-1, I-1 выделяются Cl2, Br2, I2;
4) при окислении анионов органических кислот происходит процесс
2RCOO-1 – 2e = R-R + 2CO2;
5) анионы, содержащие неметалл в промежуточной степени окисления (SO , NO
, NO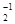 и т.п.) сами окисляются на аноде: SO
и т.п.) сами окисляются на аноде: SO + H
+ H O – 2e = SO
O – 2e = SO + 2H
+ 2H ,
,
NO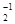 + H
+ H O – 2e = NO
O – 2e = NO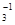 + 2H
+ 2H .
.
Электролиз водного раствора хлорида кальция можно представить схемой:
CaCl = Ca
= Ca + 2Cl
+ 2Cl

 (-) катод Ca
(-) катод Ca Cl
Cl анод (+)
анод (+)
H O H
O H O
O
φ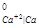 = - 2,9 B φ
= - 2,9 B φ = 1,36 B
= 1,36 B
φ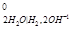 = - 0,82 B φ
= - 0,82 B φ = 1,5 B
= 1,5 B
На катоде разряжается самый сильный окислитель (с максимальным значением потенциала), на аноде – самый сильный восстановитель (с минимальным значением потенциала): А: 2Cl-1 – 2e = Cl2
K: 2Н2O +2e = H2 + 2OH-1
2Cl-1 + 2H2O = Cl2 + H2 + 2OH-1.
Молекулярное уравнение электролиза: CaCl2 + 2H2O = Cl2 + H2 + Ca(OH)2.
Ответ: продукты электролиза расплава и водного раствора хлорида кальция различаются.
Пример 2. Как изменилась масса анода при электролизе раствора сульфата никеля с электродами из никеля, если через этот электролит пропускали ток в 0,5 A в течение 5 ч?
Решение: Схема электролиза водного раствора сульфата никеля с растворимыми никелевыми электродами:
NiSO4 = Ni + SO
+ SO

 (-) катод Ni+2 SO
(-) катод Ni+2 SO анод (+)
анод (+)
H2O H2O
Ni
φ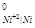 = - 0,25 B φ
= - 0,25 B φ = 2,05 B
= 2,05 B
φ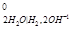 = - 0,82 B φ
= - 0,82 B φ = 1,23 B
= 1,23 B
φ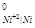 = - 0,25 B
= - 0,25 B
Самый вероятный восстановитель на аноде – металлический никель (материал анода), на катоде восстанавливается самый сильный окислитель Ni+2.
A: Ni – 2e = Ni+2
K: Ni+2 + 2e = Ni
Используя закон Фарадея, рассчитываем массу никеля, растворившегося на аноде m (Ni) = =
=  = 2,75 г.
= 2,75 г.
Ответ: масса анода уменьшилась на 2,75 г.
Задания для самостоятельного решения:
Для водного раствора данного электролита:
а) напишите уравнения процессов, идущих на электродах при электролизе;
б) рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока I в течение времени (τ, ч);
в) будет ли меняться рН в приэлектродном пространстве в процессе электролиза;
г) как изменится анодный процесс, если анод заменить на другой, выполненный из …
| № | электролит | электроды | I, A | τ, ч | замена |
| ZnSO4 | платиновые | 0,5 | цинка | ||
| MgCl2 | магниевые | 1,5 | графита | ||
| AgNO3 | графитовые | серебра | |||
| NiSO4 | никелевые | 1,5 | графита | ||
| SnCl2 | платиновые | 2,75 | олова | ||
| H2SO4 | графитовые | цинка | |||
| Cd(NO3)2 | графитовые | 0,1 | кадмия | ||
| CuBr2 | золотые | меди | |||
| Co(NO2)2 | платиновые | 0,7 | железа | ||
| FeI3 | железные | 0,9 | графита | ||
| K2SO4 | графитовые | 0,5 | меди | ||
| BaCl2 | графитовые | 1,3 | серебра | ||
| Pb(CH3 COO)2 | платиновые | графита | |||
| NaOH | графитовые | 2,5 | цинка | ||
| PtCl2 | платиновые | 0,8 | 1,75 | меди |
Коррозия металлов
а) химическую коррозию в средах, не проводящих электрический ток (газовая коррозия, коррозия в неэлектролитах); б) электрохимическую коррозию в средах, имеющих ионную проводимость (коррозия… При электрохимической коррозии разрушение металла происходит в результате работы огромного количества коррозионных…ШКОЛА ЕСТЕСТВЕННЫХ НАУК
КОНТРОЛЬНО-ИЗМЕРИТЕЛЬНЫЕ МАТЕРИАЛЫ
по дисциплине «Химия
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. Владивосток
Контрольно-измерительные материалы по дисциплине «Химия» представлены экзаменационными вопросами и вариантами тестовых заданий, предусмотренных РПУД в качестве промежуточной аттестации контроля освоения теоретической и лабораторно-практической составляющих дисциплины. Итоговая аттестация проходит в виде экзамена, согласно учебному плану. Экзаменационные билеты состоят из трех вопросов: теоретического и двух задач.
Тестовые задания
I. Атомно-молекулярное учение
а) 101,3 кПа, 273 К; б) 1 кПа, 00 С; в) 100 Па, 250 С. 2. Значение универсальной газовой постоянной R в международной системе единиц… а) 8,314; б) 62,36 ; в) 0,082.II. Строение атома. Периодическая система
а) Ge; б) Са; в) Zn. 2. Укажите полное число электронов в атоме, у которого электронная валентная… а) 30; б) 18; в) 20.III. Химическая связь
а) ковалентной; б) ионной; в) водородной. 2. Связь, обусловленная электростатическим притяжением ионов, называется: а) ионной; б) ковалентной полярной; в) ковалентной неполярной,IV. Химическая термодинамика
а) ∆Н0 = 2∆Н0Fe + 3∆Н0СО – ∆Н0 – 3∆Н0С; б) ∆Н0 = 2∆Н0Fe + 3∆Н0СО; в) ∆Н0 = ∆Н0+ 3∆Н0С – 2∆Н0Fe – 3∆Н0СО.V. Химическая кинетика и равновесие
а) увеличить в 2 раза; б) увеличить в 4 раза; в) увеличить в 8 раз. 2. Как влияет катализатор на скорость прямой и обратной реакции: H2(г) + I2(г)… а) не влияет на равновесие;VI. Растворы неэлектролитов
а) 1,6 г; б) 32 г; в) 3,2 г. 2. Какую массу этанола (С2Н5ОН) должен содержать раствор с концентрацией 1… а) 11,5 г; б) 46 г; в) 23 г.VII. Растворы электролитов
а) 0,15 М; б) 1,5 М; в) 0,75 М. 2. Какова концентрация ионов водорода в 0,1 М растворе HCN, если константа… а)М; б) М; в) М.VIII. Ионообменные реакции
1. Закончите уравнение, указав в ответе значение молекулярной массы газообразного продукта реакции: HNO3 + K2CO3 ®
а) 44; б) 101; в) 18.
2. Закончите уравнение, указав в ответе значение молекулярной массы малорастворимого продукта реакции: AgNO3 + CaCl2 ®
а) 143,5; б) 170; в) 164.
Какие пары ионов могут быть использованы при составлении молекулярного уравнения, которому отвечает ионное уравнение
H+ + CO32– ↔ H2O + CO2 ?
А) Cs+ и NO3–; б) К+ и S2-; в) Ca2+ и Cl-.
а) CuSO4; б) HNO3; в) LiOH. 5. Какие ионы могут одновременно находиться в водном растворе: а) Fe2+, NO3–, SO, Na+, NH4+; б) Cu2+, Br, S2-, Ag+ , NO3–;IX. Дисперсные системы и поверхностные явления
а) гетерогенные; б) гомогенные; в) однофазные. 2. Дисперсность системы характеризует… а) меру раздробленности дисперсной фазы; б) количество компонентов в системе; в) природу дисперсионной среды.X. Окислительно-восстановительные процессы
а) ; б) ; в) . 2. Определите, к какому типу окислительно-восстановительных процессов… а) реакция межмолекулярного окисления-восстановления;XI. Электрохимические процессы
а) происходит преобразование химической энергии окислительно-восстановительного процесса в электрическую энергию; б) происходит преобразование… 2. Каким типом проводимости должен обладать материал электрода в… а) электронной проводимостью; б) дырочной проводимостью;XII. Коррозия
а) электрохимическая; б) химическая; в) биохимическая. 2. Какой вид коррозии стали вызывает горение жидкого топлива, содержащего… а) химическую; б) электрохимическую; в) биохимическую.Перечень типовых экзаменационных вопросов
2. Строение и свойства молекул по типу химических связей. 3. Состав и природа сил взаимодействия частиц на каждом уровне организации… 4. Закономерности протекания химических процессов. Термохимические законы и расчеты. Термодинамические функции…ШКОЛА ЕСТЕСТВЕННЫХ НАУК
СПИСОК ЛИТЕРАТУРЫ
по дисциплине «Химия»
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. ВладивостокШКОЛА ЕСТЕСТВЕННЫХ НАУК
ГЛОССАРИЙ
по дисциплине «Химия»
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. Владивосток Адсорбирующиеся ингибиторы - вещества имеющие высокую адгезию к поверхности металла и создающие изоляционный слой.…ШКОЛА ЕСТЕСТВЕННЫХ НАУК
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
по дисциплине «Химия»
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. Владивосток
Таблица 1
Константы диссоциации слабых кислот
Селеноводородная H2Se (I) 1,7×10-4 (II) 1×10-11 Серная H2SO4 (I) …Константы диссоциации слабых оснований
Таблица 3Стандартные окислительно-восстановительные потенциалы
Некоторых систем в водных растворах при 25 °С
Таблица 4 Стандартные окислительно-восстановительныеПотенциалы металлов
Таблица 5Произведение растворимости веществ в воде
Таблица 6Термодинамические константы
Некоторых веществ и ионов
– Конец работы –
Используемые теги: школа, естественных, наук, двфу0.08
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов