Тема 2. Химическая связь - раздел Образование, ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ Цели И Задачи:
На Фактическом Уровне Получени...
Цели и задачи:
На фактическом уровне получения знаний:
1. Понятие молекулы и иона;
2. Основные положения теории химического строения А.М. Бутлерова;
3. Понятие химической связи;
4. Условия и механизмы образования химической связи;
5. Методы описания химической связи, ВС и МО;
6. Характеристики, виды и свойства химических связей;
7. Теории гибридизации и валентность;
На операционном уровне получения знаний:
Обучить студента:
1. Определять виды химической связи в молекулах, ионах, кристаллах;
2. Оценивать полярность связи;
3. Рассчитывать степени окисления атомов в молекулах и ионах;
4. Составлять валентные схемы молекул и комплексных ионов;
5. Определять основные типы гибридизации атомов и геометрию молекул.
На аналитическом уровне получения знаний:
Обучить студента:
1. Оценивать основные свойства газов, жидких и твердых веществ на основании знаний о химических связях в их молекулах;
2. Прогнозировать физические и химические свойства твердого вещества по природе частиц и типу химической связи между ними;
3. Оценивать донорно-акцепторные свойства ионов и атомов элементов.
Фактический материал:
I. Основное условие образования химической связи между атомами -выброс энергии из системы взаимодействующих атомов, рассмотреть на примере функциональной зависимости энергии системы от межядерного расстояния при образовании молекулы водорода. Привести основные виды химической связи в веществе: ковалентная (неполярная, полярная), ионная, металлическая.
Механизмы образования ковалентной связи:
1) Обменный механизм, основные положения теории химической связи – метода валентных связей (ВС): а) взаимодействие одноэлектронных атомных орбиталей двух атомов с антипараллельными спинами с образованием общей электронной пары; б) возникновение в межядерном пространстве области увеличенной электронной плотности, несущей избыточный отрицательный заряд; в) притяжение положительно заряженный ядер атомов к области увеличенной электронной плотности при строго фиксированном межядерном расстоянии, которое соответствует минимальному энергетическому запасу возникшей молекулы.
2) Донорно-акцепторный механизм, понятие донора и акцептора (на примере образования молекулы водорода при взаимодействии двух ионов водорода  ).
).
II. Изложить основные характеристик ковалентной связи: а) что такое энергия связи и от чего зависит ее величина; б) длина связи (величина межядерного расстояния), как влияет длина связи и ее энергия на прочность молекулы (энергию диссоциации молекулы на атомы); в) насыщаемость ковалентной связи, ковалентность атома (понятие валентности элемента, как количества квантовых орбиталей, предоставленных атомом на образование определенного количества общих электронных пар с другими атомами), рассмотреть на примере образования водородных соединений бора, углерода и азота; г) направленность ковалентной связи (образование 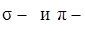 связи); д) поляризуемость ковалентной связи (образование неполярной и полярной связи), характеристика полярности связи – дипольный момент молекулы. Понятие электроотрицательности атома (как полусуммы энергий ионизации и сродства к электрону), определяющей сдвиг общей электронной пары на один из атомов при образовании связи. Таблица относительных значений электроотрицательности.
связи); д) поляризуемость ковалентной связи (образование неполярной и полярной связи), характеристика полярности связи – дипольный момент молекулы. Понятие электроотрицательности атома (как полусуммы энергий ионизации и сродства к электрону), определяющей сдвиг общей электронной пары на один из атомов при образовании связи. Таблица относительных значений электроотрицательности.
III. Явление гибридизации валентных орбиталей атомов элементов второго периода ( гибридизация), показать на примере углерода в его водородных соединениях, графите и алмазе. Привести примеры и объяснить пространственное строение и полярность: линейных неполярных 3-х атомных молекул (
гибридизация), показать на примере углерода в его водородных соединениях, графите и алмазе. Привести примеры и объяснить пространственное строение и полярность: линейных неполярных 3-х атомных молекул ( ), угловых 3-х атомных полярных молекул (
), угловых 3-х атомных полярных молекул (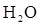 ), 4-х атомных неполярных молекул (
), 4-х атомных неполярных молекул ( ), полярных (
), полярных (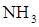 ).
).
IV. Предельный случай сильно полярной ковалентной связи является связь ионная, ее характеристики (ненаправленность и ненасыщенность). Энергия ионной связи, которая пропорциональна произведению зарядов ионов и обратно пропорциональна длине ионной связи. Неполное разделение зарядов в ионных соединениях, взаимная поляризация ионов, как следствие деформации электронных оболочек ионов. Факторы влияющие на поляризуемость ионов и поляризующую способность: а) величина ионного радиуса (чем больше значение радиуса, тем выше поляризуемость иона и меньше поляризующая способность); б)степень гидратации иона (чем выше степень гидратации, тем меньше его поляризуемость); в) величина заряда иона (чем больше заряд иона, тем выше поляризующая способность). Т.к. размеры анионов ,как правило, больше радиусов катионов, анионы обладают меньшей поляризующей способностью, но сильной поляризуемостью.
V. Дать общее понятие о комплексных соединениях, как соединениях характеризуемых наличием двух видов связи: а) ионной (во внешней координационной сфере); б) ковалентной донорно-акцепторной (во внутренней координационной сфере). Привести координационную формулу комплексного соединения (например 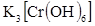 ). Кратко изложить: а) теорию строения комплексов (понятия: комплексообразователь, лиганд, координационное число); б)процессы первичной и вторичной диссоциации; в) количественную характеристику устойчивости комплексной частицы (выражение константы нестойкости).
). Кратко изложить: а) теорию строения комплексов (понятия: комплексообразователь, лиганд, координационное число); б)процессы первичной и вторичной диссоциации; в) количественную характеристику устойчивости комплексной частицы (выражение константы нестойкости).
VI. Общие представления о теории молекулярных орбиталей (расщепление энергии валентных орбиталей взаимодействующих атомов), на примере энергетических диаграмм образования молекул водорода и кислорода. Основные положения зонной теории кристаллов металлов: а) образование непрерывной энергетической зоны (НЭЗ); б) заполнение электронами энергетических уровней НЭЗ согласно правилам квантовой механики; в) деление НЭЗ на две подзоны (валентную зону и зону проводимости); г) возникновение электронного газа в кристалле, как совокупности делокализованных электронов в зоне проводимости. Понятие металлической связи, как общей электронной плотности, обусловленной совокупностью делокализованных электронов. Основные физико-механические свойства кристаллов металлов, обусловленные наличием металлической связи: электропроводность, теплопроводность, пластичность (способность к упругой деформации), ковкость и др.
Выводы по теме:
1. Виды химичесих связей в зависимости от природы образующих их частиц подразделяются на ковалентную, ионную, металлическую и водородную.
2. Ковалентная связь формируется обменным и донорно-акцепторным взаимодействиями. Характеристиками связи являются энергия, длина, насыщаемость, направленность, кратность. Свойства соединений определяются типом их решетки.
3. Ионная связь образуется вследствие электростатического взаимодействия атомов диаметрально противоположной природы. Ионные соединения представлены ионной кристаллической решеткой, параметры и характеристики которой определяют свойства ионных соединений.
4. Металлическая связь является многоценровой, ненаправленной, ненасыщаемой. Свойства металлической кристаллической решетки определяют свойства металлических тел..
Вопросы для самопроверки:
1. Сколько электронов участвует в образовании химических связей в молекуле аммиака:
а) 8; б)6; в)3.
2. Выбрать вещества, все связи которых ковалентные:
а)NaCl, HCl,Cu,H2O;
б)CO2, CH4, H2SO4, J2;
в)SO2, HNO2, NaOH, PbO.
3. В каком ряду молекулы расположены в порядке увеличения полярности связей:
а)HF, HCl, HBr;
б) NH3, PH3, AsH3;
в)H2Se, H2S, H2O.
4. Отметить формулы соединений с одинаковой степенью окисления азота:
а) Mg3N2; б)NO; в) NO2; г)NH3.
5. В каких частицах наблюдается только sp3- гибридизация центрального атома:
а) NH3, H2O, C2H4, [Zn(NH3)4]2+;
б)H2O, NH3, C2H2, [HgJ4]2-;
в)NH3, NH4+, CH4 , [Zn(NH3)4]2+ .
Указать другие типы гибридизации в этих соединениях.
6. Валентность атома азота численно равна его степени окисления в молекуле:
а) аммиака; б) азотной кислоты; в) азота; г) оксида азота (II).
Все темы данного раздела:
ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ
Согласовано
«УТВЕРЖДАЮ»
Инженерная школа ДВФУ
Заведующий кафедрой
общей, неорганической
и элементоорганической химии
Кораблестроение, океанотехника и системотехника объектов морской инфраструктуры
Форма подготовки (очная)
Школа естественных наук ДВФУ
Кафедра общей, неорганической и элементоорганической химии
курс 1 с
Учебно-методического комплекса дисциплины
«Химия»
Учебно-методический комплекс дисциплины «Химия» разработан для студентов 1 курса по специальности 180100.62 – «Кораблестроение, океанотехника и системотехника объе
Annotation
The given Chemistry Courseware is worked out specially for first year students, whose branch of study is construction, university discipline number 180100.62 «Shipbuilding, ocean engineering and sy
ШКОЛА ЕСТЕСТВЕННЫХ НАУК ДВФУ
Согласовано
«УТВЕРЖДАЮ»
Инженерная школа ДВФУ
Заведующий кафедрой
общей, неорганической
и элементоорганической химии
Кораблестроение, океанотехника и системотехника объектов морской инфраструктуры
Форма подготовки (очная)
Школа естественных наук ДВФУ
Кафедра общей, неорганической и элементоорганической химии
курс 1 с
Оборотная сторона титульного листа РПУД
I. Рабочая программа пересмотрена на заседании кафедры:
Протокол от «10_____» ____09_____________ 2012 г. № ___1___
Заведующий кафедрой __________
Цели освоения дисциплины
Требования к образованию бакалавров включают определенный минимум знаний в области химии. Данный курс предназначен для подготовки дипломированных бакалавров и ставит своей целью помочь будущим бака
Место дисциплины в структуре ООП бакалавриата
Необходимо отметить, что темпы развития современной науки, и химии в том числе, исключительно высоки: каждые десять лет общий объем научной информации возрастает в три – четыре раза. При этом основ
Начальные требования к освоению дисциплины
Дисциплина «Химия» изучается на базе курса химии средней школы. В связи с этим для освоения курса студент должен знать:
1. Символику химических элементов и устройство периодической системы
Фактический уровень
В результате теоретического изучения дисциплины студент должен знать:
1. Химическую терминологию при описании химических систем;
2. Классификацию элементов, простых и сложных веще
Операционный уровень
В результате практического изучения дисциплины студент должен уметь:
1. Логически верно, аргументировано и ясно строить устную и письменную речь (ОК-2);
2. Уметь записывать уравне
Аналитический уровень
1. Выделять и формулировать химическую проблему или ее аспекты в процессе решения конкретной научно-технической задачи (ОК-10);
2. Интерпретировать полученные результаты термодинамических
Строение вещества
Атомно-молекулярная теория. Основные определения. Моль. Законы стехиометрии. Язык химии.
Строение атома. Ядро и электроны. Атомный номер элемента. Изотопы. Волновые свойства электрона. Ква
Химическая термодинамика, энергетика процесса, кинетика и химическое равновесие
Основные понятия и определения. Гомогенные и гетерогенные системы. Условия существования систем. Термодинамические функции состояния системы. Термодинамический подход к химическим реакциям. Основны
Жидкие системы – растворы
Жидкие системы. Область жидкого состояния. Жидкие растворы. Растворение и растворимость. Общие свойства растворов неэлектролитов. Законы Рауля и Вант-Гоффа. Особенности химических реакций в жидких
Окислительно-восстановительные процессы
Окислители и восстановители. Уравнения реакций окисления-восстановления. Направление реакций. Сила окислителей и восстановителей. Стандартные окислительно-восстановительные потенциалы.
Эле
График изучения дисциплины
Таблица 3
Вид учебных
занятий
№ недели; (кол. часов в неделю); I семестр
Образовательные технологии
В соответствии с требованиями ФГОС ВПО по данному направлению подготовки реализация компетентного подхода предусматривает использование активных и интерактивных форм проведения заня
Учебно-методическое и информационное обеспечение дисциплины
1. Основная литература:
1. Глинка, Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка; под ред: А.И. Ермакова – 30-е изд., испр. – М.: Интеграл-Пресс, 2009 – 727 с. –
Материально-техническое обеспечение и электронные средства обучения, иллюстрационный материал, специализированное и лабораторное оборудование
1.Специализированная химическая лаборатория, оснащенная приборами, системой вентиляции и лабораторной мебелью.
2. Наборы химических реактивов, необходимых для выполнения лабораторных работ
Перечень типовых экзаменационных вопросов
1. Характеристика свойств элемента и его соединений по электронной формуле и по положению в периодической системе элементов.
2. Строение и свойства молекул по типу химических связей.
Рейтинговая оценка по дисциплине
Распределение баллов по видам учебных работ
Таблица 4
№ п/п
Виды учебной деятельности студента, учитываемые в рейтинговой оценке
Оц
Тема 1. Строение атома, периодический закон Д.И. Менделеева
Цели, задачи:
На фактическом уровне получения знаний:
1. Основные положения квантовой механики, квантово-механическая модель атома, квантов
Тема 1. Межмолекулярное взаимодействие
Цели и задачи:
На фактическом уровне получения знаний:
1. Понятие межмолекулярного взаимодействия и его особенности;
2. Виды межмолекулярных взаим
Тема 2. Агрегатные состояния вещества
Цели, задачи:
На фактическом уровне получения знаний:
1. Понятия твердого, жидкого, газообразного и плазменного, конденсированного, кристаллического и амор
Тема 1. I и II закон термодинамики
Цели, задачи:
На фактическом уровне получения знаний:
1. Термодинамическое описание системы. Классификация систем и термодинамические параметры системы;
Тема 1. Кинетика химических процессов и химическое равновесие
Цели, задачи:
На фактическом уровне получения знаний:
1. Понятие химической кинетики;
2. Методы регулирования скорости химической реакции;
Тема 1. Физико-химические свойства растворов
Цели, задачи:
На фактическом уровне получения знаний:
1. Основные понятия, используемые для описания водных растворов: компонент, фаза, раствор, растворите
Тема 2. Растворы электролитов
Цели, задачи:
На фактическом уровне получения знаний:
1. Электролиты сильные и слабые, кислоты, основания, соли, Изотонический коэффициент;
2. Сам
Тема 1. Коллоидные растворы
Цели, задачи:
На фактическом уровне получения знаний:
1. Коллоидное состояние вещества и основные условия возникновения такого состояния;
2. Класс
Тема 1. Окислительно–восстановительные реакции
Цели, задачи:
На фактическом уровне получения знаний:
1. Понятие эффективного заряда атома в молекуле. Окислители и восстановители. Окислительно–восстанови
Тема 1. I род электродных процессов. Электродные процессы и электродвижущие силы в гальванических элементах.
Цели, задачи:
На фактическом уровне получения знаний:
1. Предмет изучения электрохимии. Электродный потенциал металла, механизм его возникновения, способы
Тема 2. Электролиз
Цели, задачи:
На фактическом уровне получения знаний:
1. Электролиз, как окислительно-восстановительный процесс;
2. Катод и анод, их поляризация о
Тема 3. Коррозия и защита металлов
Цели, задач:
На фактическом уровне получения знаний:
1. Определение процесса коррозии;
2. Виды коррозионных разрушений;
3. Типы коррозион
Тема 1. Полимерные материалы
Цели, задачи:
На фактическом уровне получения знаний:
1. Классификация и номенклатура высокомолекулярных соединений;
2. Методы получения полимеров
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. Владивосток
Лабораторный практикум является важной составляющей естественнонаучной дисциплины «Химия» и представлен ла
Определение молярной массы эквивалента металла
Цель работы: познакомиться с газометрическим методом изучения химических реакций на примере определения молярной массы эквивалента металла.
Рекомендации
Методика выполнения опыта
В небольшую пробирку налейте 5 мл разбавленного раствора соляной кислоты при помощи пипетки так, чтобы не смочить кислотой стенки пробирки. Пробирку с кислотой осторожно наклоните и положите навеск
Расчёты и обсуждение результатов
Расчёт Мэ(Ме) можно выполнить двумя способами.
Первый способ:
1. Применив уравнение состояния идеального газа Клапейрона-Менделеева
Комплексные соединения
Цель работы:познакомиться со строением и свойствами комплексных соединений.
Рекомендации:при подготовке к работе повторите химические связи и меха
Опыт 1. Получение комплексных соединений
В две пробирки, согласно варианту работы, налейте по две – три капли вещества, в состав которого входит комплексообразователъ. Затем по каплям добавьте второе вещество до образования осадка и его р
Опыт 2. Разрушение комплексных ионов
К полученному в опыте 2 комплексному соединению (отмечено звездочкой) добавьте реактив (согласно варианту) до изменения окраски.
Таблица 2.2
Данные к опыту 2
Опыт 3. Участие комплексных ионов в реакциях обмена
В пробирку, согласно варианту, внесите две-три капли средней соли. Затем по каплям добавьте комплексного соединения до появления осадка.
Таблица 2.3
Данные к опыту
Опыт 4. Диссоциация комплексных и двойных солей
Возьмите две пробирки. Проведите качественные реакции на наличие и отсутствие в свободном виде в растворе исследуемого вещества центрального иона. Для этого внесите в пробирку по две – три капли ис
Определение теплового эффекта реакции нейтрализации
Цель работы:освоить методику экспериментального определения теплового эффекта реакции нейтрализации сильной кислоты сильным основанием.
Рекомендации:
Методика проведения опыта
Тепловой эффект реакции нейтрализации определяется в простейшем калориметре. Объемы исходных веществ приведены в табл.1 согласно варианту.
Таблица 3.1
Объемы исходных веществ
Обработка результатов эксперимента
1. Определите изменение температуры раствора ∆T =Тк – Тн.
2. Рассчитайте количество теплоты Q(Дж), выделившейся в ходе реакции:
Q =(mкис + m
Химическая кинетика
Цель работы: исследование зависимости скорости химической реакции от концентрации реагирующих веществ и температуры.
Рекомендации: познакомьтесь с
Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ
Для исследования предлагается реакция:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓ + H2O
Опыт 2. Зависимость скорости реакции от температуры
Исследуется полуэмпирическое правило Вант-Гоффа и уравнение Аррениуса, графическое решение которого позволяет определить энергию активации реакции.
Методика выполнения опыта
Гидролиз солей
Цель работы:изучение процесса гидролиза солей разного типа, установление количественных характеристик процесса гидролиза, изучение влияния различных факторов на
Опыт 1. Реакция среды водного раствора соли
Работа выполняется по вариантам (табл.5.1).
Таблица 5.1
Данные к опыту 1
Вариант
Соли
Опыт 2. Влияние различных факторов на степень гидролиза
Опыт 2.1. Влияние разбавления на степень гидролиза
В сухую пробирку внесите с помощью пипетки 10-15 капель насыщенного раствора ацетата натрия и 1 каплю раствора фенолфталеина. Отме
Коллоидные растворы
Цель работы: получить конденсационным методом ряд коллоидных растворов, определить знак коллоидных частиц, провести их коагуляцию.
Краткие теоретические осн
Опыт 2. Получение золя гидроксида железа
Нагрейте в колбочке около 30 мл дистиллированной воды до кипения и прибавьте в кипящую воду по каплям концентрированный раствор хлорида железа (III) до получения раствора устойчивого темно-красного
Опыт 4. Коагуляция золей от действия электролитов
а) в три пробирки налейте одинаковое количество полученного во втором опыте золя гидроксида железа (III) и прилейте в первую пробирку несколько капель раствора хлорида натрия, во вторую – фосфата н
Электрохимические процессы
Цель работы: познакомиться с процессами взаимного превращения химической и электрической энергий.
Рекомендации:повторите теорию ок
Опыт 1. Медно - цинковый гальванический элемент
В два микростакана налить 1М растворы: в первый – раствор ZnSO4 и туда же опустить зачищенный цинковый электрод, во второй – раствор CuSO4 с опущенным в него зачищенным медным
Коррозия металлов
Цель работы: изучение важнейших процессов, протекающих при коррозии металлов.
Контрольные вопросы:
1. Каковы
Опыт 1. Исследование относительной скорости коррозии железа в присутствии различных металлов
Коррозия как процесс самопроизвольный, протекает одновременно по всем возможным механизмам. Микроэлемент может возникнуть в любой точке изделия: достаточно попадания капли раствора на место соприко
Опыт 3. Изучение защитных свойств металлических покрытий. Коррозия оцинкованного и луженого железа
Коррозия металла, защищенного покрытием, начинается при нарушении сплошности покрытия (например, при нанесении глубокой царапины); при этом в контакте с окружающей средой находятся оба металла; и з
Общие свойства металлов
Цель работы: изучить химические свойства металлов – важнейших конструкционных материалов. Оценить химическую устойчивость металлов в различных агрессивных среда
Опыт 3. Действие щелочей на металлы
Испытайте действие щелочей на следующие металлы: алюминий, цинк и медь. Для этого в отдельные пробирки поместите по кусочку названных металлов и прилейте в каждую немного концентрированного раствор
Основы атомно-молекулярного учения
При рассмотрении этой темы основное внимание уделить разделам:
1. Газовые законы;
2. Закон эквивалентов.
Усвоить основные
Закон эквивалентов
Эквивалент fХ - некая реальная или условная частица вещества Х, которая м
Элементы химической термодинамики
Знать:
1.Основные термодинамические функции: теплоту, работу, внутреннюю энергию, энтальпию, энтропию, изобарно-изотермический и изохорно-изотермический потенци
Химическая кинетика
Выучитьпонятия:
1. скорость химической реакции: истинная и средняя
2. константа скорости химической реакции
3. порядок и молекулярность реакции
Способы выражения состава растворов
Растворами называют гомогенные системы, состоящие из двух и более компонентов. Компонент, агрегатное состояние которого не изменяется при образовании раствора, принято называть
Равновесия в растворах электролитов
Электролитами называют вещества, расплавы и растворы которых проводят электрический ток. Неэлектролиты электрический ток не проводят. Электролиты делят на две большие группы: cильны
Коллигативные свойства растворов
Свойства растворов, которые не зависят от природы растворенных частиц, а зависят только от их концентрации, называются коллигативными.
Основной закон, определяющий
Модуль 5. Основы электрохимии
Выучить следующие понятия:
1. окислитель, восстановитель, окисление, восстановление;
2. катод, анод;
3. электродный потенциал;
4. ЭДС
Коррозия металлов
Коррозиейназывают процесс самопроизвольного окисления металла в результате его физико-химического взаимодействия с окружающей средой (ΔG < 0). По механизму протекания р
I. Атомно-молекулярное учение
1. Для газов нормальными условиями считаются:
а) 101,3 кПа, 273 К; б) 1 кПа, 00 С; в) 100 Па, 250 С.
2. Значение универсальной газовой постоянной R в междуна
II. Строение атома. Периодическая система
1. Укажите элемент, которому соответствует электронная формула атома
а) Ge; б) Са;
III. Химическая связь
1. Связь, осуществляемая благодаря образованию общих электронных пар, называется:
а) ковалентной; б) ионной; в) водородной.
2. Связь, обусловленная электростатическим притяжением
IV. Химическая термодинамика
1. Тепловой эффект реакции Fe2O3(к) + 3С(к) = 2Fe(к) + 3СО(г) можно рассчитать используя стандартные энтальпии образования по уравнению:
V. Химическая кинетика и равновесие
1. Во сколько раз следует увеличить давление, чтобы начальная скорость образования NO2 по реакции: 2NO(г) + О2(г) → 2NO2(г) возросла в 8 раз?
VI. Растворы неэлектролитов
1. Какую массу метанола (СН3ОН) должен содержать раствор с концентрацией 0,1 моль/л, если объем раствора составляет 0,5 литра:
а) 1,6 г; б) 32 г; в) 3,2 г.
2. Какую мас
VII. Растворы электролитов
1. Чему равна концентрация ионов калия в 0,1 М растворе сульфита калия, если степень диссоциации соли равна 0,75?
а) 0,15 М; б) 1,5 М; в) 0,75 М.
2. Какова концентрация ионов водо
А) Cs+ и NO3–; б) К+ и S2-; в) Ca2+ и Cl-.
4. С каким из веществ вступит в реакцию обмена в водном растворе бромид бария?
а) CuSO4; б) HNO3; в) LiOH.
5. Какие ионы могут одновременно находиться в водн
IX. Дисперсные системы и поверхностные явления
1. Дисперсными системами являются системы…
а) гетерогенные; б) гомогенные; в) однофазные.
2. Дисперсность системы характеризует…
а) меру раздробленности дисперсной фазы;
X. Окислительно-восстановительные процессы
1. Укажите, какая из предложенных частиц: проявляет свойства только окислителя.
а)
XI. Электрохимические процессы
1. Гальваническим элементом называется устройство, в котором:
а) происходит преобразование химической энергии окислительно-восстановительного процесса в электрическую энергию; б) происходи
XII. Коррозия
1. Укажите механизм коррозионного процесса бронзовых деталей (сплав медь-олово) в воде:
а) электрохимическая; б) химическая; в) биохимическая.
2. Какой вид коррозии стали вызывает
Перечень типовых экзаменационных вопросов
1. Характеристика свойств элемента и его соединений по электронной формуле и по положению в периодической системе элементов.
2. Строение и свойства молекул по типу химических связей.
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. Владивосток
1. Основная литература:
1. Глинка, Н.Л. Общая химия: учеб. пособие для вузов / Н
Кораблестроение, океанотехника и системотехникаобъектов морской инфраструктуры
г. Владивосток
Адсорбирующиеся ингибиторы - вещества имеющие высокую адгезию к поверхности металла и создающие изоляционный слой. Ингибиторы коррозии - х
Константы диссоциации слабых кислот
Название
Формула
Константа
Азотистая
HNO2
4×10-4
Константы диссоциации слабых оснований
Название
Формула
Константа
Гидроксид
алюминия
Al(OH)3
(III) 1,38×10
Некоторых систем в водных растворах при 25 °С
Название
и символ
элемента
Электродный процесс
E°, B
Азот N
N2+4H2O+2ē=2NH2OH
Потенциалы металлов
Полуреакция
Е°, В
Полуреакция
Е°, В
Li+ + ē = Li
-3,045
Tl
Произведение растворимости веществ в воде
Вещество
Пр
Вещество
Пр
AgBr
5,3×10-13
CuI
1,1&
Некоторых веществ и ионов
Вещество
∆H°298,
кДж/моль
∆G°298,
кДж/моль
S°298,
Дж/(моль×град)
 ).
).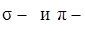 связи); д) поляризуемость ковалентной связи (образование неполярной и полярной связи), характеристика полярности связи – дипольный момент молекулы. Понятие электроотрицательности атома (как полусуммы энергий ионизации и сродства к электрону), определяющей сдвиг общей электронной пары на один из атомов при образовании связи. Таблица относительных значений электроотрицательности.
связи); д) поляризуемость ковалентной связи (образование неполярной и полярной связи), характеристика полярности связи – дипольный момент молекулы. Понятие электроотрицательности атома (как полусуммы энергий ионизации и сродства к электрону), определяющей сдвиг общей электронной пары на один из атомов при образовании связи. Таблица относительных значений электроотрицательности. гибридизация), показать на примере углерода в его водородных соединениях, графите и алмазе. Привести примеры и объяснить пространственное строение и полярность: линейных неполярных 3-х атомных молекул (
гибридизация), показать на примере углерода в его водородных соединениях, графите и алмазе. Привести примеры и объяснить пространственное строение и полярность: линейных неполярных 3-х атомных молекул ( ), угловых 3-х атомных полярных молекул (
), угловых 3-х атомных полярных молекул (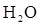 ), 4-х атомных неполярных молекул (
), 4-х атомных неполярных молекул ( ), полярных (
), полярных (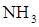 ).
).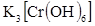 ). Кратко изложить: а) теорию строения комплексов (понятия: комплексообразователь, лиганд, координационное число); б)процессы первичной и вторичной диссоциации; в) количественную характеристику устойчивости комплексной частицы (выражение константы нестойкости).
). Кратко изложить: а) теорию строения комплексов (понятия: комплексообразователь, лиганд, координационное число); б)процессы первичной и вторичной диссоциации; в) количественную характеристику устойчивости комплексной частицы (выражение константы нестойкости).






Новости и инфо для студентов