рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Якісна реакція на сульфат-йон
Реферат Курсовая Конспект
Якісна реакція на сульфат-йон
Якісна реакція на сульфат-йон - раздел Образование, Реактиви: розчини: сульфатна кислота 1:5, натрій карбонат, барій хлорид, натрій гідроксид До Розчинів Сульфатної Кислоти, Натрій Сульфату Додати Об’Ємом 0,5 Мл Додати ...
До розчинів сульфатної кислоти, натрій сульфату додати об’ємом 0,5 мл додати розчин барій хлориду.
| Визначте формулу сульфатної кислоти: А) H3SO4 В) H2SO4 С) H2SO3 | Вкажіть йон, який є реагентом на SO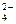 :
А) Ba2+;
В) Cu2+;
С) Cl— :
А) Ba2+;
В) Cu2+;
С) Cl—
| |||||||||||||||
| Ступінь окиснення атома Сульфура в сульфатній кислоті становить: А) +2; В) +4; С) +6 | Концентровану сульфатну кислоту не можна розбавляти доливанням до неї води, оскільки: А) може статися вибух; В) утворюється отруйний задушливий газ; С) утворений розчин може сильно розігрітися і розбризкуватися | |||||||||||||||
| Вкажіть колір універсального індикатора в розчині сульфатної кислоти: А) червоний; В) синій; С) зелений | Вкажіть групу речовин, що витісняє водень з розчину розведеної сульфатної кислоти: А) Cu, Fe, Zn; В) Ag, Fe, Mg; С) Mg, Zn, Fe | |||||||||||||||
| Реакція нейтралізації—це взаємодія: А) солі з більш сильною кислотою, з утворенням нової солі і нової кислоти; В) кислоти з металом з утворенням солі і виділенням водню; С) кислоти з лугом з утворенням солі і води | Розведена сульфатна кислота реагує з: А) основами, амфотерними металами і кислотами; В) основними і амфотерними оксидами, активними металами і основами; С) кислотними оксидами і активними металами | |||||||||||||||
| Як називаються кислі солі сульфатної кислоти: А) гідрогенсульфіти; В) гідрогенсульфіди; С) гідрогенсульфати. | Встановіть відповідність між сполукою і
ступенем окиснення Сульфуру:
| |||||||||||||||
| ЛАБОРАТОРНА РОБОТА № 2 ТЕМА: ДОБУВАННЯ АМОНІАКУ. ВИВЧЕННЯ ЙОГО ВЛАСТИВОСТЕЙ. СОЛІ АМОНІЮ МЕТА:дослідити властивості водного розчину амоніаку та солей амонію, навчитись проводити якісну реакцію на йон амонію. Література: 1.Буринська Н.М., Величко Л.П. Хімія —10,11 класи —К.: Перун, 2001. —198с. 2.Бабич Л.В., Балезин С.А. Практикум по неорганической химии— М.: Просвещение,1991.—320 с. Реактиви: розчини: амоній сульфат, натрій гідроксид, хлоридна кислота (ρ=1,18г/мл), барій хлорид тверді речовини: амоній хлорид, кальцій гідроксид індикатори: фенолфталеїн, універсальний індикаторний папір Обладнання: пробірки (4), штатив для пробірок, нагрівальне обладнання, сірники, скляна паличка, хімічний стакан, корк з газовідвідною трубкою, ступка. | ||||||||||||||||||||||||||||||||||
| № | Назва досліду та рівняння реакцій | Спостереження | Висновки | |||||||||||||||||||||||||||||||
Добування амоніаку та
дослідження його властивостей
У пробірку насипати на 1/3 об’єму ретельно розтертих амоній хлориду та кальцій гідроксиду, закрити корком з газовідвідною трубкою та нагрівати. Газ, що виділяється, збирати в іншу пробірку 2-3хв. Пробірку закрити корком. Розчинити газ у воді. Дослідити забарвлення індикаторів у розчині амоніачної води.
|
|
| ||||||||||||||||||||||||||||||||
| 2 | Взаємодія амоніаку з кислотами
Дві скляні палички змочити розчинами хлоридної кислоти та водним розчином амоніаку. З’єднати.
|
|
| |||||||||||||||||||||||||||||||
Якісна реакція на йон амонію
У пробірку налити 0,5 мл амоній
сульфату, додати 1 мл натрій гідрок-сиду та нагріти. До отвору пробірки піднести вологий індикаторний папір.
|
|
| ||||||||||||||||||||||||||||||||
| Лабораторна робота № 2 | ||||||||||||||||||||||||||||||||||
| зм | арк | № докум. | підп. | дата | ||||||||||||||||||||||||||||||
| розроб. | Добування амоніаку, вивчення його властивостей | літ | арк | арк | ||||||||||||||||||||||||||||||
| перевір. | Литвиненко | н | ||||||||||||||||||||||||||||||||
| ________________ | ||||||||||||||||||||||||||||||||||
| н. конт. | ||||||||||||||||||||||||||||||||||
| затверд | ||||||||||||||||||||||||||||||||||
Визначити за допомогою якісних
реакцій розчин амоніачної води, калій сульфату та натрій гідроксиду.
|
| пробірка № 1— пробірка № 2 — пробірка № 3 — | ||||||||||||||||||||||||||||||||||
| Висновок: | ||||||||||||||||||||||||||||||||||||
ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ:
| ||||||||||||||||||||||||||||||||||||
| ХХХХХ• | арк | |||||||||||||||||||||||||||||||||||
| вим | лист арк. | № док | підп | дата | ||||||||||||||||||||||||||||||||
| ЛАБОРАТОРНА РОБОТА № 3 ТЕМА: ДОБУВАННЯ КАРБОН(ІV) ОКСИДУ І ВИВЧЕННЯ ЙОГО ВЛАСТИВОСТЕЙ. ВЗАЄМОПЕРЕТВОРЕННЯ КАРБОНАТІВ ТА ГІДРОГЕНКАРБОНАТІВ МЕТА:навчитися добувати вуглекислий газ в лабораторії, дослідити умови взаємоперетворення карбонатів і гідрогенкарбонатів; навчитись проводити якісну реакцію на карбонат-йон. Література: 1.Буринська Н.М., Величко Л.П. Хімія —10,11 класи —К.: Перун, 2001. —198 . 2.Бабич Л.В., Балезин С.А. Практикум по неорганической химии— М.: Просвещение,1991.—320. Реактиви: розчини: хлоридна кислота, натрій карбонат, сульфатна кислота, вапняна вода, амоніачна вода, барій хлорид. тверді речовини: кальцій карбонат, натрій гідрогенкарбонат. індикатори: універсальний індикаторний папір. Обладнання: пробірки (11), штатив для пробірок, нагрівальне обладнання, сірники, корк з газовід водною трубкою, пробіркотримач. | |||||||||||||||||||||||||||
| № | Назва досліду та рівняння реакцій | Спостереження | Висновки | ||||||||||||||||||||||||
Добування карбон(ІV) оксиду
У пробірку покласти декілька шматочків крейди та долити хлоридної кислоти. Швидко закрити пробірку корком з газовідвідною трубкою,
кінець якої занурити в пробірку з
вапняною водою.
|
|
| |||||||||||||||||||||||||
Якісна реакція на карбонат-йон
Налити в пробірку 1 мл натрій карбонату, долити 0,5 мл хлоридної
кислоти й одразу закрити корком з газовідвідною трубкою, кінець якої
занурити в пробірку з вапняною
водою.
|
|
| |||||||||||||||||||||||||
| Лабораторна робота № 3 | |||||||||||||||||||||||||||
| зм | арк | № докум. | підп. | дата | |||||||||||||||||||||||
| розроб. | Добування карбон(ІV) оксиду і вивчення його властивостей. | літ | арк | арк | |||||||||||||||||||||||
| перевір. | Литвиненко | н | |||||||||||||||||||||||||
| ________________ | |||||||||||||||||||||||||||
| н. конт. | |||||||||||||||||||||||||||
| затверд | |||||||||||||||||||||||||||
Взаємоперетворення карбонатів та гідроген карбонатів
У суху пробірку насипати 1/5 її об’єму натрій гідрогенкарбонату, закрити корком з газовідвідною
трубкою, кінець якої занурити у розчин вапняної води. Нагрівати вміст пробірки до помутніння вапняної води. Продовжити нагрівання до змін у пробірці з вапняною водою.
|
|
| |||||||||||||||||||||||||||
Визначити за допомогою якісних реакцій розчин амоніачної води,
натрій карбонату та сульфатної
кислоти.
|
| пробірка № 1— пробірка № 2— пробірка № 3— | |||||||||||||||||||||||||||
| Висновок: | |||||||||||||||||||||||||||||
ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ:
| |||||||||||||||||||||||||||||
| ХХХХХ | арк | ||||||||||||||||||||||||||||
| зм | лист арк | № док | підп | дата | |||||||||||||||||||||||||
| ЛАБОРАТОРНА РОБОТА № 4 ТЕМА: РОЗПІЗНАВАННЯ СПОЛУК НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ МЕТА:навчитися розпізнавати сполуки неметалічних елементів за допомогою якісних реакцій на окремі йони. Література: 1.Буринська Н.М., Величко Л.П. Хімія —10,11 класи —К.: Перун, 2001. —198с. 2.Бабич Л.В., Балезин С.А. Практикум по неорганической химии— М.: Просвещение,1991.—320 с. Реактиви: розчини: хлоридна, сульфатна кислоти, натрій гідроксид, барій хлорид, амоній сульфат. тверді речовини: амоній хлорид, кальцій гідроксид. індикатори: фенолфталеїн, універсальний індикаторний папір Обладнання: пробірки (10), штатив для пробірок, нагрівальне обладнання, сірники, скляна паличка, хімічний стакан, корк з газовідвідною трубкою. | |||||||||||||
| № | Хід досліду та рівняння реакцій | Спостереження | Висновки | ||||||||||
| За допомогою якісних реакцій визначте речовини, що містяться у пронумерованих пробірках | Пробірка № 1_________ Пробірка № 2_________ Пробірка № 3_________ Пробірка № 4_________ | ||||||||||||
| Лабораторна робота № 4 | |||||||||||||
| зм | арк | № докум. | підп. | дата | |||||||||
| розроб. | Розпізнавання сполук неметалів | літ | арк | арк | |||||||||
| перевір. | Литвиненко | н | |||||||||||
| ________________ | |||||||||||||
| н. конт. | |||||||||||||
| затверд | |||||||||||||
| 2. | Здійсніть реакції, що виражені такими йонними рівняннями: 1. Cu2+ +2OH- → Cu(OH)2↓ |
|
| ||||||||||||||||||||
| 2. CO32- +2H+ →CO2 ↑+H2O | |||||||||||||||||||||||
Висновок: _____________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
| |||||||||||||||||||||||
| ХХХХХ | арк | ||||||||||||||||||||||
| вим | лист арк. | № док | підп | дата | |||||||||||||||||||
| ЛАБОРАТОРНА РОБОТА № 5 ТЕМА: ДОСЛІДЖЕННЯ ВЛАСТИВОСТЕЙ МАГНІЮ. ДОБУВАННЯ АЛЮМІНІЙ ГІДРОКСИДУ ТА ДОВЕДЕННЯ ЙОГО АМФОТЕРНОСТІ МЕТА:дослідити властивості магнію та його сполук. Навчитися добувати алюміній гідроксид реакцією обміну та експериментально довести його амфотерні властивості Література: 1.Буринська Н.М., Величко Л.П. Хімія —10,11 класи —К.: Перун, 2001. —198 . 2.Бабич Л.В., Балезин С.А. Практикум по неорганической химии— М.: Просвещение,1991.—320. Реактиви: розчини:алюміній хлорид, натрій гідроксид , сульфатна кислота, вода , фенолфталеїн тверді речовини: магній, алюміній Обладнання: пробірки (4 ), штатив для пробірок, нагрівальне обладнання, сірники | |||||||||||||||||||||||||||||||||
| № | Назва досліду та рівняння реакцій | Спостереження | Висновки | ||||||||||||||||||||||||||||||
| Ознайомлення зі зразками магнію та алюмінію Розглянути запропоновані зразки металів та описати їх зовнішній вигляд. Дослідити деякі властивості: колір, блиск, твердість, розчинність у воді, тощо. |
|
| |||||||||||||||||||||||||||||||
| 2 | Дослідження металевих властивостей магнію В пробірку покласти 1 г магнієвої стружки та долити 1 мл води. Суміш нагріти. В пробірку додати декілька крапель розчину фенолфталеїну 1)______________________________ У хімічну ложку покласти 1 г магнієвої стружки та нагріти у полум’ї спиртівки 2)______________________________ Вміст ложки висипати у хімічний стакан з водою, перемішати. До розчину додати декілька крапель фенолфталеїну 3)_________________________ |
|
| ||||||||||||||||||||||||||||||
| Лабораторна робота № 5 | |||||||||||||||||||||||||||||||||
| зм | арк | № докум. | підп. | дата | |||||||||||||||||||||||||||||
| розроб. | Дослідження властивостей магнію. Добування алюміній гідроксиду та доведення його амфотерності | літ | арк | арк | |||||||||||||||||||||||||||||
| перевір | Литвиненко | н | |||||||||||||||||||||||||||||||
| ________________ | |||||||||||||||||||||||||||||||||
| н. конт. | |||||||||||||||||||||||||||||||||
| затверд | |||||||||||||||||||||||||||||||||
| Взаємодія магнію та алюмінію з кислотами В дві пробірки покласти по 1 гранулі магнію та алюмінію. До обох пробірок долити по 1 мл сульфатної кислоти. До отвору пробірки піднести запалений сірник. Що спостерігаєте ? 1)_______________________________ 2)_______________________________ |
|
| ||||||||||||||||||||||
| Добування алюміній гідроксиду реакцією обміну. Доведення його амфотерності В пробірку налити 1 мл розчину алюміній хлориду та додати 1 мл розчину натрій гідроксиду. Отриманий осад розлити в дві пробірки. До однієї додати 1 мл розчину натрій гідроксиду, до другої – 1 мл розчину сульфатної кислоти. 1) _______________________________ 2)________________________________ 3)________________________________ |
|
| ||||||||||||||||||||||
| Висновок:____________________________________________________________ ______________________________________________________________________ ______________________________________________________________________ ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ: 1) Здійснити перетворення: Mg → MgO → Mg(OH)2 → MgCl2 → Mg(OH)2 _______________________________________________________ _______________________________________________________ _______________________________________________________ _______________________________________________________ 2) Здійснити перетворення: Al(OH)3 → Al2O3 → AlCl3 → Al(NO3)3 → Al(OH)3↓ ________________________________________________________ ________________________________________________________ ________________________________________________________ ________________________________________________________ ________________________________________________________ | ||||||||||||||||||||||||
| ХХХХХ | арк | |||||||||||||||||||||||
| вим | лист арк | № док | підп | дата | ||||||||||||||||||||
| ЛАБОРАТОРНА РОБОТА № 6 ТЕМА: ВЛАСТИВОСТІ ЗАЛІЗА. ДОБУВАННЯ ФЕРУМ(ІІ) ТА ФЕРУМ(ІІІ) ГІДРОКСИДІВ РЕАКЦІЯМИ ОБМІНУ. КОРОЗІЯ ЗАЛІЗА МЕТА: навчитися добувати в лабораторії ферум( ІІ ) та ферум( ІІІ ) гідроксиди реакціями обміну та дослідити їх властивості Література: 1.Буринська Н.М., Величко Л.П. Хімія —10,11 класи —К.: Перун, 2001. —198с. 2.Бабич Л.В., Балезин С.А. Практикум по неорганической химии— М.: Просвещение,1991.—320 с. Обладнання: розчини: сульфатна кислота (1:5) , ферум (ІІ) хлорид, натрій гідроксид, ферум ( ІІІ ) хлорид, калій роданід Пробірки, нагрівальний прилад, тримач для пробірок . | |||||||||||||||||||||||||
| № | Назва досліду та рівняння реакцій | Спостереження | Висновки | ||||||||||||||||||||||
| Властивості заліза а) Взаємодія з кислотами В пробірку покласти гранулу заліза та долити до неї 1 мл розведеної сульфатної кислоти. 1)______________________________ б) Взаємодія з солями менш активних металів В пробірку покласти залізний цвях і долити до нього 2 мл купрум сульфату 2)______________________________ |
|
| |||||||||||||||||||||||
| 2 |
– Конец работы – Эта тема принадлежит разделу: Реактиви: розчини: сульфатна кислота 1:5, натрій карбонат, барій хлорид, натрій гідроксидНа сайте allrefs.net читайте: Реактиви: розчини: сульфатна кислота 1:5, натрій карбонат, барій хлорид, натрій гідроксид. Реакція... Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Якісна реакція на сульфат-йон Что будем делать с полученным материалом:Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Хотите получать на электронную почту самые свежие новости?
Подпишитесь на Нашу рассылку
Наша политика приватности обеспечивает 100% безопасность и анонимность Ваших E-Mail
Реклама |






Новости и инфо для студентов