рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Кислотно-основные свойства
Реферат Курсовая Конспект
Кислотно-основные свойства
Кислотно-основные свойства - раздел Образование, СОЕДИНЕНИЯ АРОМАТИЧЕСКОГО РЯДА Амины Как Кислоты. Связь N–Н Расщепляется Гетерол...
Амины как кислоты. Связь N–Н расщепляется гетеролитически с трудом даже в тех случаях, когда аминогруппа связана с ароматическим кольцом или другой системой, способной к делокализации электронной плотности. Кислый характер алкиламинов выражен очень слабо и сравним по величине с кислотностью аммиака, для которого константа ионизации нижеприведенной реакции составляет 10–33:
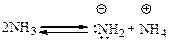
Поэтому первичные и вторичные амины способны к ионизации связи N–Н только в присутствии активных металлов (натрия, лития и др.) и сильных оснований – амидов щелочных металлов, металлорганических соединений. В результате образуются соли – алкил- и диалкиламиды металлов:

Алкиламиды щелочных металлов являются сильнейшими из всех известных гетероатомных оснований, их применяют в органическом синтезе для отрыва протонов и генерирования анионов.
У ариламинов константы кислотности несколько выше, так как электронная плотность от атома азота смещена в сторону кольца, что приводит к увеличению полярности связи N–H.
Основность аминов. Подобно аммиаку, амины, благодаря НЭП на атоме азота, обладают основными свойствами. Основность аминов проявляется уже в водных растворах (основанием в водном растворе является сам амин, а не гидроксид-ион). Амины являются более сильными основаниями, чем вода, и более слабыми основаниями, чем гидроксид-ион:
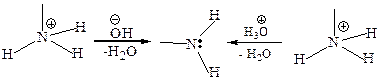
Как типичные основания, амины реагируют с разбавленными растворами протонных кислот и с кислотами Льюиса с образованием солей:

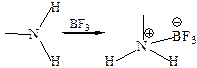
Равновесие в системах «основание – кислота» устанавливается довольно быстро и определяется разностью свободных энергий ∆G0 основания и сопряженной кислоты. На относительную устойчивость этих частиц влияют три основных фактора:
· структурные особенности молекул;
· электронные эффекты заместителей;
· природа растворителя.
Амины более сильные основания, чем вода, спирты и простые эфиры, вследствие меньшей электроотрицательности атома азота в сравнении с кислородом. Основность амина определяется тем, насколько легко атом азота предоставляет свою НЭП протону (или любой частице с вакантной орбиталью) для образования ковалентной связи. Любой структурный фактор, увеличивающий электронную плотность на азоте, будет увеличивать основность, а любой фактор, вызывающий оттягивание этой пары от азота, будет способствовать уменьшению основности.
Таким образом, последовательное замещение атомов водорода в аммиаке на алкильные группы, обладающие +I эффектом, будет приводить к увеличению электронной плотности на азоте, т. е. к увеличению основности. Константы основности аммиака и алифатических аминов с различной степенью замещения, измеренные в газовой фазе, показывают, что основность возрастает в следующем ряду:
аммиак < первичные амины < вторичные амины < третичные амины
Однако при изменении величины Кв в жидкой фазе характер этой зависимости несколько искажается, в частности, основность третичного амина уменьшается по сравнению со вторичным. Можно предположить, что наличие третьей алкильной группы в молекуле амина создает пространственные препятствия как для захвата протона, так и для сольватации образовавшегося катиона молекулами растворителя.
Существует еще один подход для сравнения основных свойств аминов. Предполагают, что основность зависит от степени компенсации положительного заряда на протонированном азоте. Алкильные заместители за счет +I эффекта рассредоточивают положительный заряд в катионе аммония, т. е. стабилизируют катион:
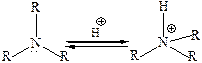
В отличие от алкиламинов ароматические амины являются более слабыми основаниями. Основность ариламинов так же, как и алкиламинов, определяется доступностью НЭП на азоте для протонирования. У анилина и его производных основность понижена, что связано со значительной делокализацией НЭП атома азота (+М эффект). В молекулах дифениламина и трифениламина степень делокализации π-электронов еще выше, вследствие чего дифениламин более слабое основание, чем анилин, а трифениламин вообще нельзя назвать основанием:
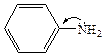
| 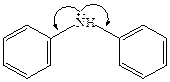
| 
|
| Кв = 4,2 × 10-10 | Кв = 7,0 × 10-14 | Кв – |
Как показано в таблице 7, влияние заместителей на основность ароматических аминов зависит от направления мезомерного и индуктивного эффектов: ЭД заместители повышают основность за счет +I или +М – эффектов, ЭА заместители действуют в обратном направлении, способствуя большей делокализации НЭП азота (–I, –М эффекты).
Таблица 7 – Константы основности замещенных анилина
| Заместители | Электронные эфекты | Константы основности (Кв) (Кв анилина = 4,2×10-10) | ||
| пара-изомеры | мета-изомеры | орто-изомеры | ||
| –CH3 | + Iэф | 12,5 × 10-10 | 4,9 × 10-10 | 2,5 × 10-10 |
| –NH2 | +Mэф | 110 × 10-10 | 7,6 × 10-10 | 3,2 × 10-10 |
| –CI | – Iэф | 1,5 × 10-10 | 0,3 × 10-10 | 0,05 × 10-10 |
| –NO2 | –I, –Mэф | 0,001 × 10-10 | 0,032 × 10-10 | 0,0003 × 10-10 |
Влияние заместителей на основность аминов зависит не только от электронных эффектов, но и от положения заместителей в кольце. Для СН3– группы характерен небольшой положительный индуктивный эффект, поэтому, можно ожидать, что введение группы ее в ароматическое кольцо вызовет небольшое повышение основности амина. Это и наблюдается для мета- и пара-замещенных анилина, но не для орто-изомера. Как следует из данных таблицы 7, такой аномальный орто-эффект наблюдается и для других заместителей. В случае N-алкилзамещенных ароматических аминов следует принимать во внимание стерические факторы (табл. 8).
Таблица 8 – Зависимость константы основности от стерических факторов
| Соединение | N-метиланилин | N,N-диметиланилин | N,N-диэтиланилин |
| Кв | 5×10-10 | 2,4×10-10 | 2,2×10-10 |
Увеличение числа и объема N-алкильных заместителей приводит к снижению степени делокализации электронов азота, т. е. к повышению силы основания.
Согласно другой интерпретации, электронодонорные заместители способствуют уменьшению положительного заряда катиона анилиния, что стабилизирует его и соответственно увеличивает основность амина. Оттягивание электронов приводит к увеличению положительного заряда иона анилиния и его дестабилизации, т. е. к снижению основности амина.

| Х– подает электроны, стабилизирует катион, увеличивает основность амина |
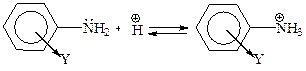
| Y– оттягивает электроны, дестабилизирует катион, уменьшает основность |
Благодаря своей основной природе амины сравнительно легко образуют соли как с неорганическими, так и с органическими кислотами:
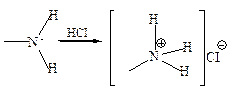

Соли аминов в водных растворах в большей или меньшей степени гидролизуются, причем соли ариламинов гидролизуются легче, чем соли аминов алифатического ряда. В случае сильных электроноакцепторных заместителей соли анилиния могут не растворяться в водных растворах минеральных кислот, как, например, соли 2,4-динитроанилина или дифениламина.
– Конец работы –
Эта тема принадлежит разделу:
СОЕДИНЕНИЯ АРОМАТИЧЕСКОГО РЯДА
На сайте allrefs.net читайте: СОЕДИНЕНИЯ АРОМАТИЧЕСКОГО РЯДА.
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Кислотно-основные свойства
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов