рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Вид работы: Контрольные Работы
- /
- Д.И. Менделеева
Реферат Курсовая Конспект
Д.И. Менделеева
Д.И. Менделеева - Контрольная Работа, раздел Образование, Методическое пособие для выполнения контрольной работы Пример 1. Какую Высшую Степень И Низшую Степени Окисле...
Пример 1. Какую высшую степень и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение. Высшую степень окисления элемента определяет номер группы периодической системы Д.И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6).
Данные элементы находятся соответственно в VA, VIA, VIIA-группах и имеют структуру внешнего энергетического уровня s2p3, s2p4 и s2p5. Ответ на вопрос см. в таблице 4.
Таблица 4 Степени окисления мышьяка, селена, брома
| Элемент | Степень окисления | Соединения | |
| высшая | низшая | ||
| As | +5 | -3 | H3AsO4, H3As |
| Se | +6 | -2 | SeO3, Na2Se |
| Br | +7 | -1 | KBrO4, KBr |
Пример 2. У какого из элементов четвертого периода – марганца или брома – сильнее выражены металлические свойства?
Решение. Электронные формулы данных элементов:
25Mn 1s22s22p63s23p63d54s2
35Br 1s22s22p63s23p63d104s24p5
Марганец – d-элемент VIIB-группы, а бром – p-элемент VIIA-группы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а, следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов.
Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы.
Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Пример 3. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления атомов элементов их образующих? Какие гидроксиды называются амфотерными (амфолитами)?
Решение. Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э–О и О–Н может протекать по двум типам:
 | |||
 | |||
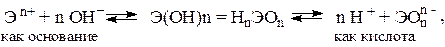 |
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами атомов. Диссоциация по кислотному типу (II) протекает, если ЕО-Н << ЕЭ-О (высокая степень окисления), и по основному типу (I), если ЕО-Н >> ЕЭ-О (низкая степень окисления). Если прочности связей О–Н и Э–О близки или равны, диссоциация гидроксила может одновременно протекать и по (I), и по (II) типам. В этом случае речь идет об амфотерных электролитах (амфолитах):
где Э – элемент;
n – его положительная степень окисления.
В кислой среде амфолит проявляет основной характер, а в щелочной среде – кислый характер:
Ge(OH)3 + 3 HCl = GeCl3 + 3 H2O
Ge(OH)3 + 3 NaOH = Na3GeO3 + 3 H2O
2.1 Контрольные вопросы
21. Исходя из положения германия и технеция в периодической системе, составьте формулы мета-, ортогерманиевой кислот и оксида технеция, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
22. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и p-элементов в группах периодической системы с увеличением порядкового номера? Почему?
23. Что такое электроотрицательность? Как изменяется электроотрицательность р-элементов в периоде, в группе периодической системы с увеличением порядкового номера? Почему?
24. Исходя из положения германия, молибдена и рения в периодической системе, составьте формулы водородного соединения германия, оксида молибдена и рениевой кислоты, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
25. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
26. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия.
27. Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте исходя из строения атомов данных элементов.
28. Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
29. У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой из элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
30. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
31. У какого из р-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атомов этих элементов.
32. Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ba(OH)2 или Mg(OH)2; Ca(OH)2 или Fe(OH)2; Cd(OH)2 или Sr(OH)2?
33. Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: CuOH или Cu(OH)2; Fe(OH)2 или Fe(OH)3; Sn(OH)2 или Sn(OH)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
34. Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой их степени окисления. Как называются соответствующие соединения?
35. Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и азот? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
36. Хром образует соединения, в которых он проявляет степени окисления +2, +3, +6. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида хрома (III).
37. Атомные массы элементов в периодической системе непрерывно увеличиваются, тогда как свойства простых тел изменяются периодически. Чем это можно объяснить? Дайте мотивированный ответ.
38. Какова современная формулировка периодического закона? Объясните, почему в периодической системе элементы аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя и имеют большую атомную массу?
39. Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
40. Атомы каких элементов четвертого периода периодической системы образуют оксид, отвечающий их высшей степени окисления Э2О5? Какой их них дает газообразное соединение с водородом? Составьте формулы кислот, отвечающих этим оксидам, и изобразите их графически.
– Конец работы –
Эта тема принадлежит разделу:
Методическое пособие для выполнения контрольной работы
На сайте allrefs.net читайте: Методическое пособие для выполнения контрольной работы. Р Х Кудашев...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Д.И. Менделеева
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов