рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Вид работы: Контрольные Работы
- /
- Электродные потенциалы и электродвижущие силы
Реферат Курсовая Конспект
Электродные потенциалы и электродвижущие силы
Электродные потенциалы и электродвижущие силы - Контрольная Работа, раздел Образование, Методическое пособие для выполнения контрольной работы При Решении Задач Этого Раздела См. Таблицу 8. Если Металличе...
При решении задач этого раздела см. таблицу 8. Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие:
Ме + m Н2О ® Ме(H2O)mn + nē ,
в растворе на металле
где п - число электронов, принимающих участие в процессе.
На границе металл - жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях - так называемые стандартные электродные потенциалы (Е0).
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 250 С условно принимается равным нулю (Е0 = 0; DG0 = 0).
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е0), получаем так называемый ряд напряжений. Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е0, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньше окислительные способности проявляют его ионы, и наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. В этом случае DG0<0, так как DG0 = -n F E0.
Таблица 8 Стандартные электродные потенциалы (Е0) некоторых металлов
(ряд напряжений)
| Электрод | Е0, В | Электрод | Е0, В |
| Li+/Li | -3,045 | Cd2+/Cd | -0,403 |
| Rb+/Rb | -2,925 | Co2+/Co | -0,277 |
| K+/K | -2,924 | Ni2+/Ni | -0,25 |
| Cs+/Cs | -2,923 | Sn2+/Sn | -0,136 |
| Ba2+/Ba | -2,90 | Pb2+/Pb | -0,127 |
| Ca2+/Ca | -2,87 | Fe3+/Fe | -0,037 |
| Na+/Na | -2,714 | 2H+/H2 | -0,000 |
| Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | -1,70 | Bi3+/Bi | +0,215 |
| Ti2+/Ti | -1,603 | Cu2+/Cu | +0,34 |
| Zr4+/Zr | -1,58 | Cu+/Cu | +0,52 |
| Mn2+/Mn | -1,18 | Hg22+/2Hg | +0,79 |
| V2+/V | -1,18 | Ag+/Ag | +0,80 |
| Cr2+/Cr | -0,913 | Hg2+/Hg | +0,85 |
| Zn2+/Zn | -0,763 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | -0,74 | Au3+/Au | +1,50 |
| Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (таблица 8). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциалы кобальта - в растворе с концентрацией 0,1 моль/л.
Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
 Е = Е0 +
Е = Е0 + 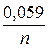 lgC ,
lgC ,
где Е0 - стандартный электродный потенциал;
n - число электронов, принимающих участие в процессе;
С - концентрация (при точных вычислениях - активность) гидратированных ионов металла в растворе, моль/л;
Е0 для никеля и кобальта соответственно равны -0,25 и -0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:

Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Решение. Подобные задачи решаются также на основании уравнения Нернста (см. пример 1):
2,41 = - 2,37 +  lgC
lgC
- 0,04 = 0,0295 lg C,
lgC = - = -1,3559
= -1,3559
С Mg2+ = 4,4×10 –2 моль/л.
Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнения окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента:
(-) Mg | Mg2+ || Zn2+ | Zn (+)
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 -2ē = Mg 2+ (1)
Цинк, потенциал которого -0,763 В, - катод, т. е. электрод, на котором протекает восстановительный процесс:
Zn 2+ + 2 ē = Zn 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg 0 + Zn 2+ = Mg 2+ + Zn 0
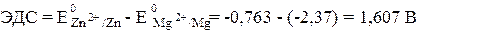 |
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
9.1 Контрольные вопросы
161. В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй - серебряную. В каком сосуде цвет раствора постепенно пропадет? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
162. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) СuSO4; б) МgSO4; в) Рb(NО3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
163. При какой концентрации Zn 2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала?
Ответ: 0,30 моль/л.
164. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) АgNО3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
165. Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn 2+ (в моль/л). Ответ: 1,89×10 -2 моль/л.
166. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Аg+ (в моль/л)? Ответ: 0,20 моль/л.
167. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Сd2+] = 0,8 моль/л, а [Сu2+] = 0,01 моль/л. Ответ: 0,68 B.
168. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и аноде.
169. При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 1,89×10 -12 моль/л.
170. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н, а второй - в 0,1 н растворы АgNO3.
Ответ: 0,059 В.
171. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод - в 0,01 М растворе сульфата никеля.
Ответ: 0,0295 В.
172. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb2+] = [Мg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
173. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
174. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
175. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg2+] = [Cd2+] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
176. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,001 моль/л? Ответ: 7,3×10 -15 моль/л.
177. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/л, а [Рb2+] = 0,0001 моль/л. Ответ: 0,064 В.
178. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
179. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
180. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
– Конец работы –
Эта тема принадлежит разделу:
Методическое пособие для выполнения контрольной работы
На сайте allrefs.net читайте: Методическое пособие для выполнения контрольной работы. Р Х Кудашев...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Электродные потенциалы и электродвижущие силы
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов