Розрахунок термодинамічної рівноваги в сплавах систем
Fe – Ti – C(B)
Розрахунок термодинамічної рівноваги сплавів систем Fe – Ti – C та Fe – Ti – В4C проводився за допомогою програми CHEQC (CHemical EQuilibriums Calculations) на базі пакету програм Astra. Попередній розрахунок вихідних даних виконувався з використанням хімічної довідкової системи PL Table.
Розрахунок проводився для систем сплавів складу:
1. Fe – (10 ÷ 80% мас)[Ti – (10 ÷ 25% мас)C],
2. Fe – (10 ÷ 80% мас)[Ti – ( 5 ÷ 95% мас)В4С].
Вихідні умови розрахунку (для обох систем сплавів) однакові, інтервал температур в якому здійснювався розрахунок термодинамічної рівноваги систем складає 500 – 1400 оС, а тиск в системі становить 105 Па.
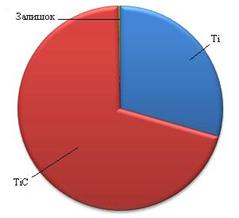
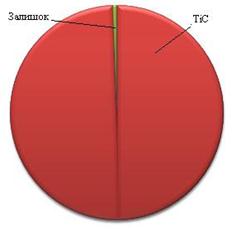
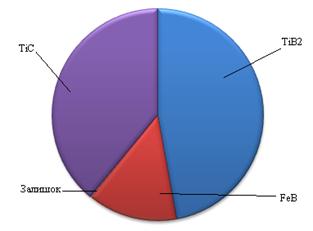
Виходячи з результатів отриманих при розрахунку вірогідності зміщення рівноваги при проходженні реакцій у вказаних системах можна сказати, що для системи Fe – (10 ÷ 80% мас)[Ti – (10 ÷ 25% мас)C] при досягненні відношення масової частки вуглецю до титану,як 20 до 80 в системі спостерігається утворення стехіометричного карбіду титану. У випадку меншої кількості вуглецю у суміші сплав складається зкарбіду титану, кількість якого напряму пов’язана з кількістю вуглецю у вихідні суміші, непрореагувавшого титану та заліза. Якщо кількість вуглецю перевищує кількість вуглецю необхідну для утворення стехіометричного карбіду титану, то система складається з карбіду титану та карбіду заліза (рис. 3.9).
| 
|
| а) | б) |
| |
| в) | |
| а) – з нестачею С до Ті та Fe; б) – з оптимальним співвідношенням С до Ті та Fe; в) – з надлишком С до Ті та Fe Рисунок 3.9 - Розподілення твердих фаз в системі Fe – Ti – C |
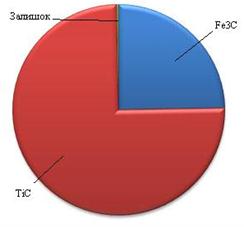
Дослідження термодинамічної рівноваги в системі Fe – Ti – В4С, в межах варьювання концентрацією утворюваної твердої фази 10 - 80% мас по відношенню до Fe, а також змінюючи вміст В4С по відношення до титану можна зробити висновок, що при вмісті В4С 5 - 20% мас по відношенню до титану в сисемі рівновага системи ззувається в бік утворення TiB та TiC з залишишимися, Ti, це повязано з недостатньою кількістю B та C при розкладанні В4С (рис. 3.10).
| 
|
| а) | б) |
| |
| в) | |
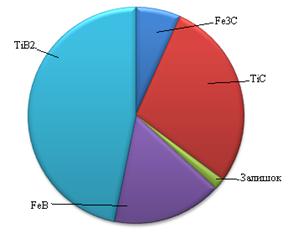
| а) – з нестачею В та С до Ті та Fe; б) – з оптимальним співвідношенням В та С до Ті та Fe; в) – з надлишком В та С до Ті та Fe Рисунок 3.10 - Розподілення твердих фаз в системі Fe – Ti – B4C |
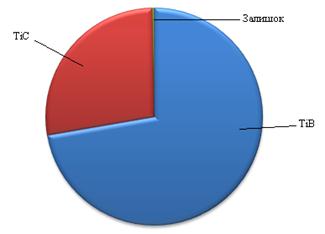
При досягненні концентрації В4С до Ti в системі до 25 % мас, всистемі утворюється TiB, TiB2, а також залишаються TiC та вільне Fe. З чого можна зробити висновок про те, що більш активний титан у порівнянні з залізом прямує до утворення карбідів та боридів у першу чергу ніж залізо, а кількість бору та вуглецю не достатня для взаємодії з залишившимся залізом.
Підвищуючи вміст В4С до 30% мас, ріновага зміщується з утворенням FeВ, TiB2, а також TiC та Fe, що пояснюється насиченням TiB бором та його переходом в TiB2. Така ситуація спостерігається аж до концентрації карбіду бору до 50 % мас по відношенню до титану. При концентрації 80 % мас твердої фази по відношенню до заліза, в системі залишається не прореагувавший карбід бору та вуглець, що залишився в системі внаслідок розкладу певної кількості карбіду бору та не звязався з Fe або Ti через їх недостатню кількість. Така ситуація спостерігається при високих вмістах твердої фази до заліза в інтервалі концентрацій В4С від 45 до 95 % мас.
В інтервалі концентрацій карбіду бору до титану 55 – 95 % мас система ззувається до утворення Fe, C, FeB, Fe3C, TiC та TiB2. Однак непрореагувавші залізо та вуглець вже при температурі в 873 К утворюють цементит та невелику кількість залишкового вуглецю.