Вывод давления идеального газа из молекулярно-кинетических представлений.
 Стенки сосуда, в котором заключен газ, подвергаются непрерывной бомбардировке молекулами. В результате элементу стенки DS сообщается за секунду некоторый импульс, который равен силе, действующей на DS. Отношение этой силы к величине DS дает давление, оказываемое газом на стенки сосуда. Вследствие хаотичности движения молекул давление газа на различные участки стенок сосуда одинаково. Если предположить, что молекулы отскакивают от стенки по закону зеркального отражения Стенки сосуда, в котором заключен газ, подвергаются непрерывной бомбардировке молекулами. В результате элементу стенки DS сообщается за секунду некоторый импульс, который равен силе, действующей на DS. Отношение этой силы к величине DS дает давление, оказываемое газом на стенки сосуда. Вследствие хаотичности движения молекул давление газа на различные участки стенок сосуда одинаково. Если предположить, что молекулы отскакивают от стенки по закону зеркального отражения 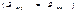 и модуль скорости молекулы не изменяется, то импульс, сообщаемый при ударе стенке молекулой, будет равен и модуль скорости молекулы не изменяется, то импульс, сообщаемый при ударе стенке молекулой, будет равен 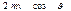 (рис.; m — масса молекулы). Этот импульс направлен по нормали к площадке. Каждая из (рис.; m — масса молекулы). Этот импульс направлен по нормали к площадке. Каждая из 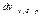 молекул сообщает стенке импульс молекул сообщает стенке импульс 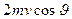 , а все эти молекулы , а все эти молекулы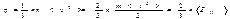 — импульс — импульс 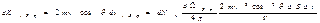 Просуммируем полученное выражение по направлениям в пределах телесного угла 2p. В результате получим импульс, сообщаемый молекулами, скорости которых имеют модуль от v до v+do:+
++
Просуммируем полученное выражение по направлениям в пределах телесного угла 2p. В результате получим импульс, сообщаемый молекулами, скорости которых имеют модуль от v до v+do:+
++ 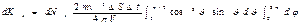 Интегрирование по dj дает 2p, интеграл по
Интегрирование по dj дает 2p, интеграл по 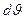 равен 1/3. Следовательно, равен 1/3. Следовательно, 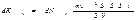 Проинтегрировав это выражение по скоростям от 0 до vmax , получим полный импульс, сообщаемый площадке DS за время Dt: Проинтегрировав это выражение по скоростям от 0 до vmax , получим полный импульс, сообщаемый площадке DS за время Dt: 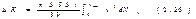 Выражение Выражение
 представляет собой среднее значение квадрата скорости молекул. Заменив в (2.26) интеграл произведением N<v2> получим, что представляет собой среднее значение квадрата скорости молекул. Заменив в (2.26) интеграл произведением N<v2> получим, что 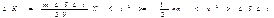 (n=N/V есть число молекул в единице объема). Наконец, разделив это выражение на DS и Dt, получим давление газа на стенки сосуда: (n=N/V есть число молекул в единице объема). Наконец, разделив это выражение на DS и Dt, получим давление газа на стенки сосуда:
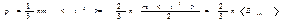
|
2. Уравнение состояния ИГ. Изопроцессы.
При обычных условиях (т.е. при комнатной температуре и атмосферном давлении) параметры состояния таких газов, как кислород и азот, довольно хорошо подчиняются уравнению: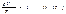 где b — константа, пропорциональная массе газа, когда количество газа равно 1 моль, константа b в уравнении (1.15) будет одинаковой для всех газов. Обозначив константу для одного моля буквой R, напишем уравнение состояния идеального газа: pVM=RT . Индекс «м» при Vуказывает на то, что имеется в виду объем 1 моль газа (молярный объем). Чтобы получить уравнение состояния для произвольной массы m идеального газа, умножим обе части уравнения (1.16) на отношение m/M, где М — молярная масса газа:
где b — константа, пропорциональная массе газа, когда количество газа равно 1 моль, константа b в уравнении (1.15) будет одинаковой для всех газов. Обозначив константу для одного моля буквой R, напишем уравнение состояния идеального газа: pVM=RT . Индекс «м» при Vуказывает на то, что имеется в виду объем 1 моль газа (молярный объем). Чтобы получить уравнение состояния для произвольной массы m идеального газа, умножим обе части уравнения (1.16) на отношение m/M, где М — молярная масса газа: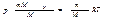 При одинаковых р и T газ массы m будет занимать объем V, в m/М раз больший, чем VM поэтому Vм/М =V. Таким образом, мы приходим к уравнению:
При одинаковых р и T газ массы m будет занимать объем V, в m/М раз больший, чем VM поэтому Vм/М =V. Таким образом, мы приходим к уравнению: 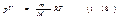 Это есть уравнение состояния для массы m идеального газа. Умнож. и разд. правую часть уравнения (1.18) на постоянную Авогадро NA:
Это есть уравнение состояния для массы m идеального газа. Умнож. и разд. правую часть уравнения (1.18) на постоянную Авогадро NA: 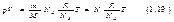 Здесь N=(m/M)NA — число молекул, содержащихся в массе m газа. Величина
Здесь N=(m/M)NA — число молекул, содержащихся в массе m газа. Величина 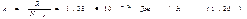 называется постоянной Больцмана. Она определяет «долю» газовой постоянной, приходящуюся на одну молекулу. С учетом (1.20) уравнению (1.19) можно придать вид: pV=NkT. (1.21). Разделим обе части этого уравнения на объем газа V. Отношение N/V дает число молекул в единице объема газа, которое мы будем обозначать буквой n и называть плотностью молекул. Следовательно, p=nkT.
называется постоянной Больцмана. Она определяет «долю» газовой постоянной, приходящуюся на одну молекулу. С учетом (1.20) уравнению (1.19) можно придать вид: pV=NkT. (1.21). Разделим обе части этого уравнения на объем газа V. Отношение N/V дает число молекул в единице объема газа, которое мы будем обозначать буквой n и называть плотностью молекул. Следовательно, p=nkT.
изопроцессы.
1)изобарический
p=const
V=((m/μ)R(1/p))T
2)изохорический
V=const
p=((m/μ)R(1/V))T
3)изотермический
T=const, pV=const
3.Закон о равнораспределении энергии по степеням свободы.
В классической статистической физике выводится закон равнораспределения, согласно которому на каждую степень свободы молекулы приходится в среднем одинаковая кинетическая энергия, равная (1/2)kT.