Осмос і осмотичний тиск
Процес однобічної дифузії розчинника через мембрану в розчин якої-небудь речовини назвивається осмосом.
Тиск, що утворюється в розчині внаслідок осмосу, називають осмотичним.
Вант-Гофф установив, що залежність осмотичного тиску розбавленого розчину неелектроліту від концентрації розчиненої речовини виражається рівнянням:
 ,
,
де  – осмотичний тиск, кПа;
– осмотичний тиск, кПа; 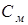 – молекулярна концентрація розчину;
– молекулярна концентрація розчину; 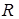 – газова постійна 8,314 Дж/(мольК);
– газова постійна 8,314 Дж/(мольК);  – температура, К.
– температура, К.
Приклад. У 200 мл розчину знаходиться 12,66 г гематину. Осмотичний тиск цього розчину дорівнює 243 кПа. Визначити молекулярну масу гематину.
Розв’язування. Беремо рівняння Вант-Гоффа:
 ;
;  ;
;
 моль/г.
моль/г.
Визначивши молярну концентрацію розчиненої речовини, обчислюємо її масу:
 ;
;  .
.
З цих співвідношень бачимо, що для визначення молярної маси необхідно знати масу речовини, розчиненої в 1 л розчину, яку знаходимо з пропорції:
12,66 г гематину знаходиться в 200 мл розчину
 – в 1000 мл розчину
– в 1000 мл розчину
 г.
г.
Звідси молярна маса розчиненої речовини
 г/моль.
г/моль.
Молекулярна маса кількісно дорівнює молярній масі:
 а.о.м.
а.о.м.