ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТА МЕТАЛЛА
Объяснение опыта
Определение эквивалента металла основано на измерении объема водорода, который выделяется при реакции металла с кислотой:
Me(II) + 2HCl = MeCl2 + H2.
В соответствии с законом эквивалентов:
 , (1.1)
, (1.1)
где  - количество эквивалентов металла;
- количество эквивалентов металла;
 - количество эквивалентов водорода
- количество эквивалентов водорода
или 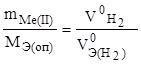 , (1.2)
, (1.2)
где m - масса металла, г;
 - эквивалентная масса металла, определенная из опыта, г/моль;
- эквивалентная масса металла, определенная из опыта, г/моль;
 - объем выделившегося водорода, приведенного к нормальным условиям, мл;
- объем выделившегося водорода, приведенного к нормальным условиям, мл;
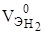 - эквивалентный объем водорода при нормальных условиях, 11200 мл.
- эквивалентный объем водорода при нормальных условиях, 11200 мл.
Реакцию проводят в приборе - эвдиометре (рис. 1.1). Он состоит из двух сообщающихся бюреток, в которые залита вода. Одна бюретка 1, называемая измерительной, соединена с двухколенной пробиркой 3 (пробиркой Оствальда) с помощью газоотводной трубки 4. Другая бюретка 2 - вспомогательная. Обе бюретки передвигаются относительно друг друга по вертикали.
 |
|
Проведение опыта
Перед началом работы необходимо убедиться в герметичности прибора. Закрепите бюретки в штативе так, чтобы их можно было свободно передвигать по вертикали, т. е. их передвижению не мешала бы плоскость стола. Нулевая отметка в измерительной бюретке 1 должна быть на уровне глаз.
На пробирку 5 газоотводной трубки 4 плотно наденьте сухую реакционную пробирку 3. Опустите вспомогательную бюретку 2 вниз на 15-20 см. В измерительной бюретке 1 создается вакуум, который должен сохраняться. Если уровень воды в бюретке со временем остается неизменным, то прибор герметичен. Если уровень воды в бюретке 1 будет снижаться, то прибор не герметичен. В этом случае необходимо плотнее вставить пробку 6 газоотводной трубки 4 в бюретку 1 и плотнее надеть пробирку 3 на пробку 5.
ВНИМАНИЕ! Нельзя работать на негерметичном приборе. При работе со стеклом соблюдайте осторожность, учитывая хрупкость стекла.
Убедившись в герметичности прибора, снимите пробирку 3 и установите бюретку 1 так, чтобы уровень воды находился вблизи нулевой отметки. Отсчет уровня ведите по нижнему мениску (рис. 1.2).
|
 |
Затем в одно колено реакционной пробирки 3 поместите кусочек металла. Массу металла, указанную на бумажке, в которую он был завернут, запишите в табл. 1.1.
В другое колено пробирки 3 налейте раствор соляной кислоты до трети объема. Плотно наденьте пробирку 3 на пробку 5 газоотводной трубки.
Снова проверьте прибор на герметичность. Если прибор герметичен, то показания уровня воды (V1) в измерительной бюретке запишите в таблицу.
Поднятием пробирки 3 перелейте кислоту в колено с металлом. Выделяющийся водород вытеснит воду из бюретки 1 в бюретку 2. После прекращения реакции (прекращения выделения водорода), выждите 3-5 минут, чтобы содержимое реакционной пробирки охладилось до комнатной температуры.
Затем вспомогательную бюретку 2 опустите так, чтобы уровни воды в обеих бюретках находились на одной высоте. При равных уровнях воды внутри прибора создается атмосферной давление.
В таком положении бюреток замерьте уровень воды (V2) в измерительной бюретке 1 и запишите в табл. 1.1.
Вычисления:
1. Определение парциального давления водорода, 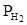 .
.
Водяной пар в воздухе обладает заметным парциальным давлением. Чтобы определить парциальное давление водорода 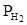 , необходимо исключить давление насыщенных паров воды
, необходимо исключить давление насыщенных паров воды  , которое находится по таблице 1.2 при соответствующей температуре опыта.
, которое находится по таблице 1.2 при соответствующей температуре опыта.
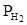 = Р -
= Р - 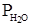 . (1.3)
. (1.3)
Таблица 1.1