Степень гидролиза
Объяснение опыта
Гидролиз соли, образованной слабым основанием и сильной кислотой, идет по схеме:
К+ + НОН Û КОН + Н+ .
Константа гидролиза:
 ,
,
где 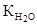 - ионное произведение воды, равное 10-14 при 22 0С,
- ионное произведение воды, равное 10-14 при 22 0С,
Кд ОСН - константа диссоциации слабого основания, образующего соль.
Из приведенного соотношения следует, что чем слабее основание, тем сильнее гидролиз.
Проведение опыта
Реактивы: хлористый алюминий, AlCl3 кр.;
хлористый магний, MgCl2 кр.;
дистиллированная вода;
универсальная индикаторная бумага.
В две пробирки налейте до половины объема дистиллированной воды. В одну внесите один микрошпатель хлористого алюминия AlCl3, в другую – хлористого магния MgCl2. Перемешиванием растворите соли. По отсутствию осадков убедитесь в том, что гидролиз идет по первой ступени.
Определите с помощью индикаторной бумаги значение рН в раствора этих солей.
Напишите уравнение гидролиза солей по первой ступени в молекулярной и ионно-молекулярной формах. Сделайте вывод о влиянии силы оснований (Кдисс (Al(ОН)3) = 1.4×10-9, Кдисс (Mg(OH)2)=2.5×10-3), образующих соль, на степень гидролиза.